山苦菜嫩茎直接分化无性系的建立
2012-12-09张卓王艳王晓旭李慧姜长阳
张卓,王艳,王晓旭,李慧,姜长阳
(辽宁师范大学生命科学学院,辽宁大连 116081)
山苦菜嫩茎直接分化无性系的建立
张卓,王艳,王晓旭,李慧,姜长阳
(辽宁师范大学生命科学学院,辽宁大连 116081)
为了保护山苦菜资源,满足人们对种苗栽培的需求,分别以山苦菜茎尖、叶片、叶柄和无芽嫩茎为外植体,进行直接分化不定芽的诱导培养.结果表明:嫩茎是直接分化出不定芽的理想材料,最佳分化培养基为MS+BA 0.5 mg/L+IBA 0.5 mg/L+KT 0.5 mg/L+蔗糖30 g/L;1/4 MS+IAA 0.2 mg/L+蔗糖20 g/L是分化芽生根的理想培养基;山苦菜再生苗移栽的理想基质是1/2园土+1/2河沙,移栽成活率为98.4%,移栽成活苗定植的成活率为98.8%.本实验证明:在适宜条件下可由嫩茎直接分化建立起山苦菜无性系.
山苦菜;直接分化;生根;无性系
山苦菜(Ixerischinensis),又名苦碟子、盘尔草、秋苦荬菜、鸭子食等[1-2],属菊科,苦荬菜属多年生草本植物[3].山苦菜既可食用又可药用,全草入药,具有解热、镇痛、消炎等功效.现代药理研究表明:山苦菜具有保肝抗炎、抗氧化、抗烟碱、抗病毒和抗白血病等药效[4].山苦菜新鲜茎叶具有适口性好等优点,已经成为人们极为喜爱的野菜和家禽、家畜喜食的青饲料[5].研究者的调查发现,在早春大连市场上,山苦菜的嫩芽价格达200元/kg.人们的大量食用和很高的售价,使得以根茎繁殖为主的山苦菜野生资源的分布和数量都急剧减少,有的地区已成为濒危野菜.现在,在大连郊区已经很难采到野生山苦菜.因此,寻求山苦菜快速繁殖的方法显得尤为重要.此前已多有关于苦荬菜属植物的研究报道[6-9],多集中于其食用及药用价值方面,迄今未见山苦菜组织培养、外植体直接分化并建立无性系的报道.本研究采用组织培养的方法,进行山苦菜直接分化的研究,建立山苦菜的高效离体再生体系,为满足人们对种苗的需要,并为山苦菜的野生资源的保护、转基因研究和基因库的建立提供技术基础.
1 材料与方法
1.1 材料灭菌及培养条件
将采自大连郊区山坡上生长旺盛的山苦菜植株用清水冲洗干净后,剪成若干5 cm左右的小段,放到500 m L的磨口广口瓶中,用自来水振荡洗涤10~20 min后,用体积分数0.05%的安利洗涤液洗涤约10 min,接着用无菌水震荡洗涤至无泡沫后置于超净工作台上,用体积分数75%的乙醇灭菌10~15 s后,迅速用无菌水振荡洗涤3~5次,加入质量浓度0.5 mg/L的HgCl2溶液浸泡13 min,紧接着用无菌水洗涤4~5次[10],将无菌材料转移到覆有干净无菌滤纸的培养皿中,吸干材料表面的水分,待剪切接种[11].培养基中琼脂的质量浓度为5.0 g/L,p H 5.8~6.0,持续光照时间为12 h/d,光强2 000~4 000 lx,培养温度15~27℃[12].
1.2 方法
1.2.1 不同种类及不同质量浓度激素对茎尖、叶片、叶柄和嫩茎直接分化的影响
从无菌材料上剪取茎尖、叶片、叶柄和茎段,其中叶柄和茎段长度为0.5~1.0 cm、叶片为边长0.5 cm左右块状,茎尖长约0.8 cm.将以上4种材料分别接种于以MS为基本培养基并添加不同种类及不同质量浓度激素的培养基上,置于光照恒温条件下进行直接分化的诱导培养.直接分化实验重复3次,每种培养基接种培养50个材料.
1.2.2 不同生长素对分化芽生根的影响
将嫩茎分化的分化芽从基部剪下,接种到以MS为基本培养基,分别附加IAA 0.2 mg/L,IBA 0.2 mg/L,NAA 0.2 mg/L,2,4-D 0.2 mg/L和蔗糖30 g/L的培养基上.接种时嫩茎植物学形态学下部的生长点接触到培养基(下同),于变温光照条件下进行生根培养.不同生长素对山苦菜分化芽生根的影响实验重复2次,每种培养基接种培养80个材料.
1.2.3 不同碳源及其质量浓度对分化芽生根的影响
以MS为基本培养基,附加的生长素为IAA 0.2 mg/L,分别采用蔗糖、葡萄糖和麦芽糖作为碳源并设置质量浓度梯度,将分化芽从基部剪下接种到各培养基中,于变温光照条件下进行生根培养.实验重复2次,每种培养基接种培养80个材料.
1.2.4 不同基本培养基对分化芽生根的影响
选用通过上述实验确定的生长素和碳源,即IAA 0.2 mg/L和蔗糖20 g/L附加到1/4 MS,1/2 MS,MS,B5,N6和White 6种不同的基本培养基中,再把从基部剪下的分化芽接种到上述培养基上后,于变温光照条件下进行生根培养,实验中每种培养基接种80个分化芽,重复2次.
1.2.5 试管苗生根继代培养
从生长旺盛的生根试管苗上剪取具有2个生长点的茎段,接种到筛选出的理想生根培养基上,于变温光照条件下进行继代培养,共接种50个茎段.生根继代培养实验重复3次,每次实验继代培养6代,接种培养200个茎段.
1.2.6 试管苗的移栽与定植
将培养着生长旺盛,根系发达试管苗的培养瓶打开瓶塞,炼苗4 d后移栽到上半层分别为干净河沙、炉灰渣和1/2园土+1/2河沙,下半层为肥沃园土的温室花盆中,移栽实验重复2次,共移栽550株.
把在温室中移栽成活的试管苗定植到山坡下水库旁的开垦地上,共定植500株.
1.2.7 数据处理
本实验所有数据均采用spss17.0进行差异显著性分析.
2 结果与分析
2.1 不同种类及不同质量浓度激素对茎尖、叶片、叶柄和嫩茎直接分化的影响
观察表明,培养至第6天,个别茎尖的生长点处开始抽芽,但只生长1个芽且向上生长,芽较小且呈黄绿色,长势较弱;叶片边缘、叶柄两端均开始膨大;茎段无明显变化.培养20 d,茎尖抽出的嫩芽仍较短,且大多已经开始脱分化形成愈伤组织,叶片边缘和叶柄两端形成了白色或淡黄色的愈伤组织,茎段已由两端或一端切口直接分化出不定芽(以下称为分化芽),一般抽出2~3个叶片(呈嫩绿色向四周生长);培养至第45天观察统计,结果见表1.由表1可见,4种材料在MS+BA 0.5 mg/L+IBA 0.5 mg/L+KT 0.5 mg/L这一培养基中的分化率均为最高值,但茎尖、叶片和叶柄分别仅为22%,14%和26%,且叶片和叶柄上的分化芽都是由愈伤组织分化而来,出现的愈伤组织团块较大,分化芽长势较弱且畸形苗较多.而以茎段为材料,不仅分化率达到了100%(平均每个茎段分化出56个高度为2.1~3.4 cm的直接分化芽),而且分化芽向四周生长,长势较好,叶为鲜翠绿色,每个不定芽具3~6个生长点,整体呈团簇状,无畸形苗,外观生长状态良好,充满整个三角瓶底部(图1).由此可见,MS+BA 0.5 mg/L+IBA 0.5 mg/L+KT 0.5 mg/L这一培养基是诱导茎段直接分化芽的理想培养基.

图1 山苦菜茎段的直接分化团簇状分化芽Fig.1 Cluster direct differentiation buds f rom tender stems of Ixerischinensis
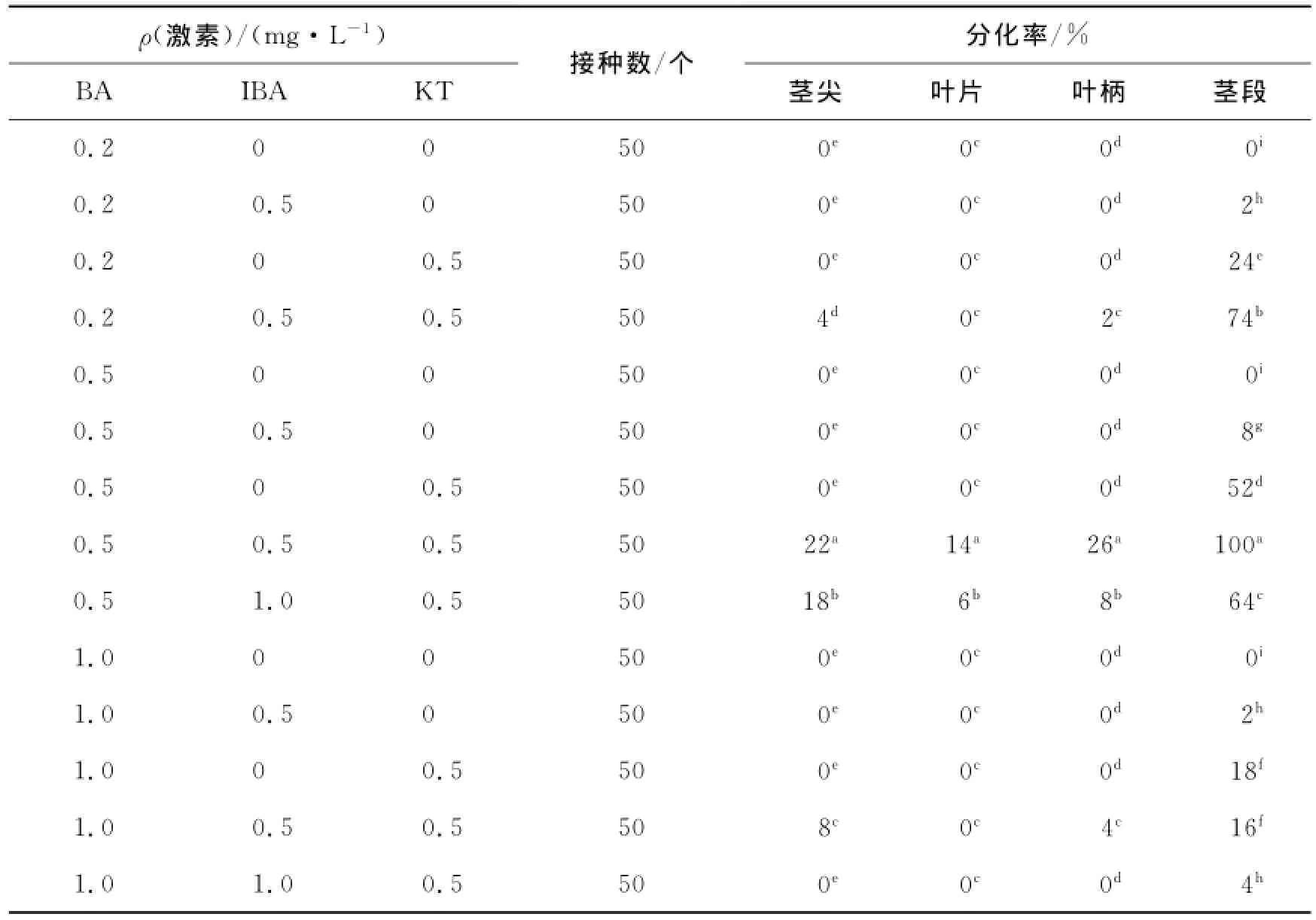
表1 不同激素配比对山苦菜不同材料直接分化的影响Tab.1 Effects of different hormone combinations on direct differentiation with different explants of Ixerischinensis
2.2 不同条件对分化芽生根的影响
2.2.1 不同生长素对分化芽生根的影响
生根培养28 d观察统计,结果见表2.由表2可见,在添加IAA,IBA和NAA的培养基上生根率均为100%,且以IAA为生长素进行生根的分化芽长势最好(图2).观察发现,分化芽培养至第5天开始生根,从平均生根数、根长以及苗长势等方面看,变温条件下有利于山苦菜分化芽生根的生长素依次为IAA,IBA,NAA和2,4-D.因此,IAA是山苦菜分化芽生根的理想生长素.
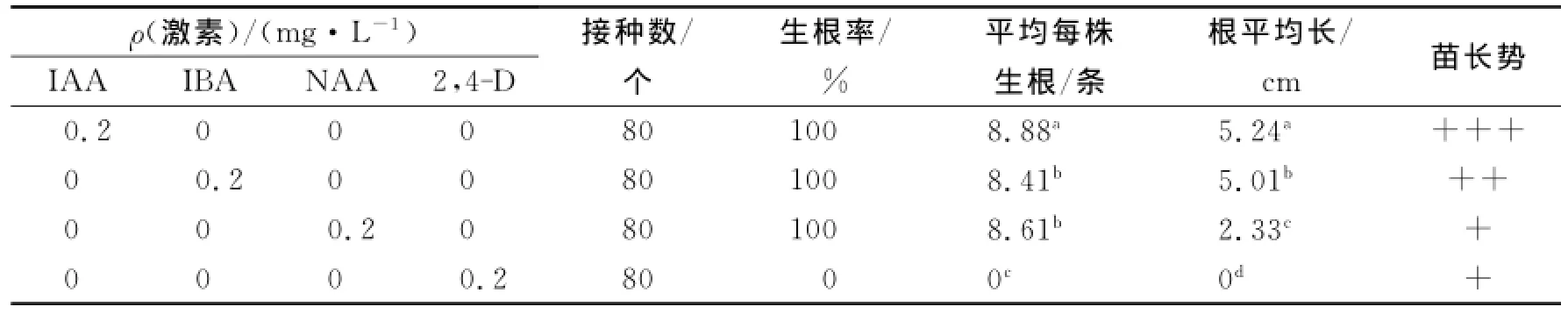
表2 不同生长素对分化芽生根的影响Tab.2 Effects of different auxins on rooting of differentiated buds
2.2.2 不同碳源及其质量浓度对山苦菜分化芽生根的影响
接种后每隔7 d观察1次生根情况并进行详细记录,培养至第28天进行第4次观察,结果见表3.观察发现分化芽培养6 d左右开始生根,以蔗糖为碳源的培养基对根的诱导效果要好于葡糖糖和麦芽糖,且添加蔗糖20 g/L的培养基上平均根数最多、根平均最长且苗长势最好(图3).因此蔗糖为诱导山苦菜分化芽生根的理想碳源,理想质量浓度为20 g/L.

图2 IAA对生根的诱导Fig.2 Rooting inducing of IAA

图3 20 g/L的蔗糖对生根的诱导Fig.3 Rooting inducing of sucrose 20 g/L
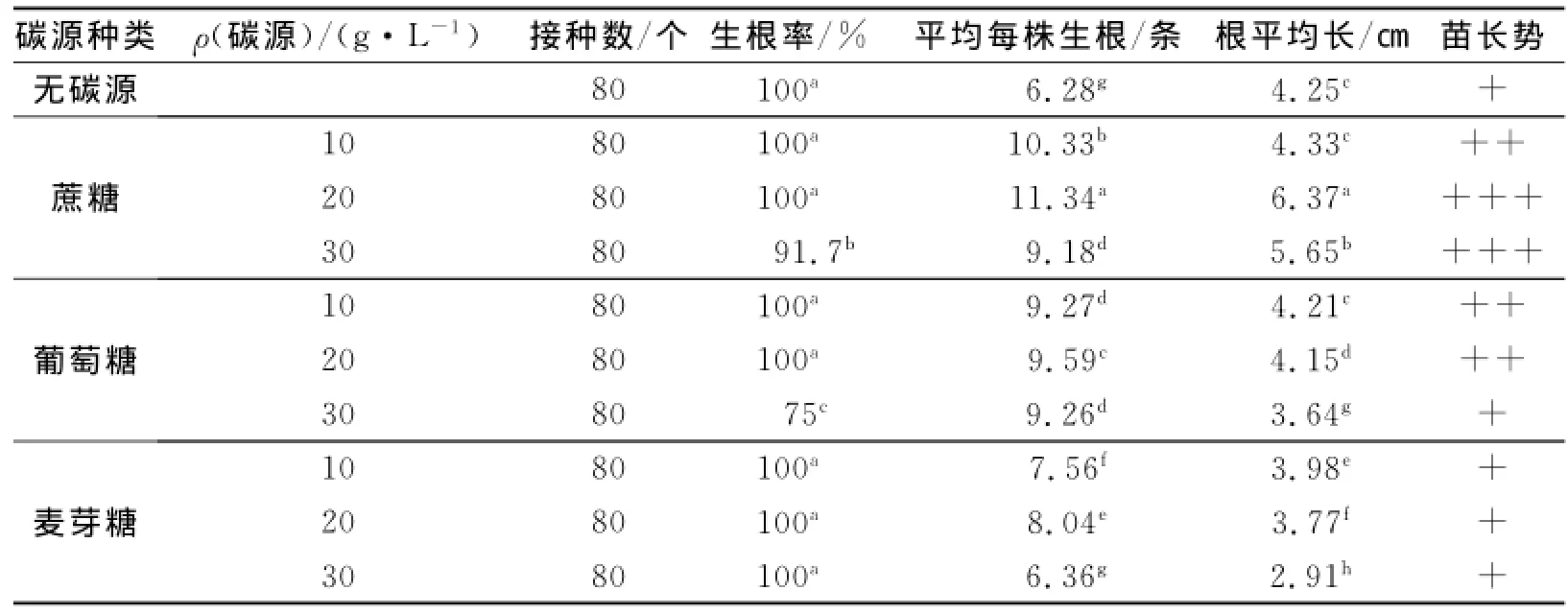
表3 不同碳源对分化芽生根的影响Tab.3 Effects of different carbon sources on rooting of differentiated buds
2.2.3 不同基本培养基对山苦菜分化芽生根的影响
观察表明,接种到培养基中的第4天已有植株开始生根,培养至第28天时对生根率、平均生根数、根的长度等进行观察统计,结果见表4.在糖与激素相同的条件下,6种基本培养基中以1/4 MS为基本培养基时分化芽生根状态最好(图4).在1/4 MS+IAA 0.2 mg/L+蔗糖20 g/L这种培养基上培养的分化芽,不仅生根率100%(平均每株试管苗生根6.80条(最多),每条根的平均长度3.99 cm),而且生根试管苗长势好,同时上根系白嫩.因此,1/4 MS是山苦菜分化芽生根的理想基本培养基,1/4 MS+IAA 0.2 mg/L+蔗糖20 g/L是山苦菜分化芽生根培养的理想培养基.
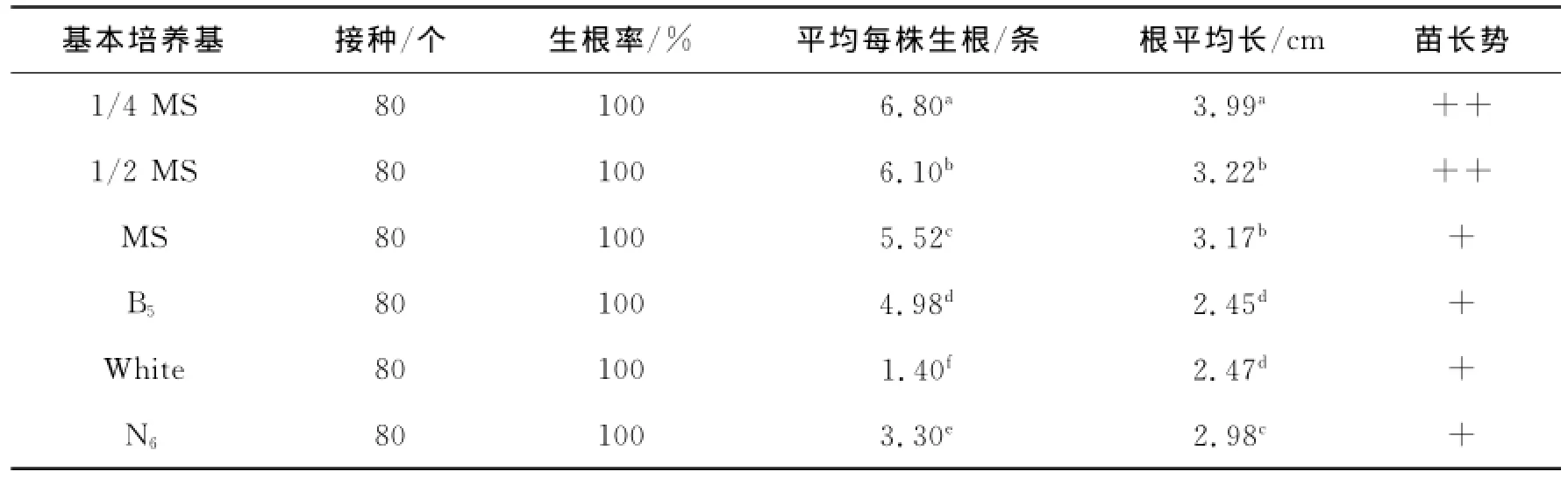
表4 不同基本培养基对分化芽生根的影响Tab.4 Effects of different basic mediums on rooting of differentiated buds
2.2.4 试管苗生根继代培养与快速繁殖
生根继代培养25 d后观察统计:试管苗成活率和生根率均为100%,且植株长势较好,叶片呈深绿色无枯叶(图5),根系发达.统计还证明,生根继代增殖速度为4.8倍/25 d,且几乎没有无效苗.3次重复实验,每次继代培养6代的结果基本一致.按照这种繁殖速度,理论上1株试管苗1年能繁殖出4.814.6株试管苗,即使除掉各种不利因素,也完全能达到快速繁殖、满足栽培和研究需求的目的.
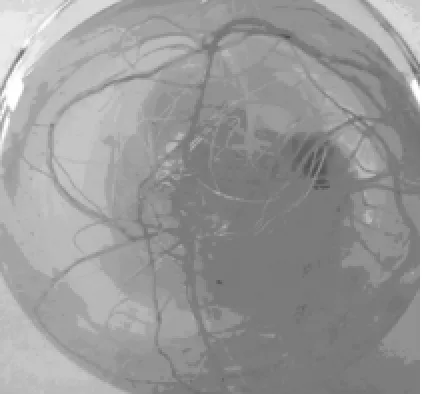
图4 1/4 MS对生根的诱导Fig.4 Rooting inducing of 1/4 MS

图5 生根继代培养的试管苗Fig.5 Tube seedlings of rooting multiplication
2.2.5 试管苗的移栽与定植
移栽后30 d统计证明:移栽的理想基质为1/2园土+1/2河沙,移栽成活541株,成活率为98.4%.定植后30 d统计证明:定植成活488株,成活率为97.6%.定植成活的试管苗初期生长缓慢,后期生长速度加快,长势旺盛,根系增加1倍左右,当年开花结果.
3 讨论
诱导山苦菜4种材料直接分化的实验证明:无芽嫩茎是最适合直接分化的外植体,这表明细胞的结构和生理状态的不同会导致不同组织在同种条件下产生不同的反应[13].当培养基中添加的BA质量浓度发生变化时,对山苦菜分化芽的诱导情况有显著影响,最适质量浓度为0.5 mg/L,这与蓝桃菊等人[14]对罗汉果不同器官直接分化的研究结果一致.IAA是植物天然生长素,高质量浓度抑制植物的生长,低质量浓度促进植物的生长,促进细胞伸长和细胞分化,进而促进植物的生长与发育.已有研究表明,IAA对菊科植物生根的诱导效果较好[15],本研究结果也证明IAA是诱导菊科植物山苦菜分化芽生根培养的最佳生长素.光不仅作为一种能源影响光合作用,还作为一种触发信号影响植物生长及发育的许多方面,光照条件不同,植物生长状态亦不同[16],日光为山苦菜生根培养的最佳光照条件.前人的研究表明,作为人工合成的生长素2,4-D,是常见生长素中诱导愈伤组织作用最强的[17-19],而对拟南芥试管苗生根抑制作用明显[20].本研究证明:在添加2,4-D的培养基上分化苗不生根,但在形态学下端出现了愈伤状膨大,经过一段时间的培养形成较多愈伤组织,这与前人的研究结果一致.
邱奉同等人[12]对山苦菜组织培养的研究采用的是愈伤组织诱导培养途径,这种方法周期较长.本次研究成功地获得了无芽嫩茎的直接分化芽,建立了山苦菜的无性系.诱导直接分化不仅操作简单、节省成本,而且繁殖速度要比以往愈伤再分化的速度快得多,提升了山苦菜快速繁殖的效率,能够更有效地解决各方面对山苦菜种苗的需求.本研究培养的山苦菜试管苗不仅可为栽培提供较理想的试管苗,而且也为山苦菜野生资源得到保护、转基因研究和基因库的建立奠定了基础.
[1]中国科学院北京植物所主编.中国高等植物图鉴:第4册[M].北京:科学出版社,1975:702.
CHINESE ACADEMY OF SCIENCES BEIJING INSTITUTE OF BOTANY.Higher plants of China:fourth volumes[M].Beijing:Science Press,1975:702.
[2]李书心.辽宁植物志:下册[M].沈阳:辽宁科学技术出版社,1991:620-621.
LI Shuxin.Flora liaoningica tomu:volume two[M].Shenyang:Liaoning Science and Technology Press,1991:620-621.
[3]中国科学院植物志编辑委员会.中国植物志:第76卷:第1分册[M].北京:科学出版社,1987:27.
CHINESE ACADEMY OF SCIENCES FLORA EDITORIAL COMMITTEE.Flora of China:seventy-sixth volumes:the first volume[M].Beijing:Science Press,1987:27.
[4]王晓飞,王晓静.中华苦荬菜化学成分研究[J].中草药,2007,38(8):1151-1152.
WANG Xiaofei,WANG Xiaojing.Studies on the chemical constituents ofIxeris[J].Chinese Traditional and Herbal Drugs,2007,38(8):1151-1152.
[5]张晓梅.苦荬菜的利用价值[J].宁夏农林科技,2002(6):51.
ZHANG Xiaomei.The utilization value of Ixeris[J].Ningxia Journal of Agriculture and Forestry Science and Technology,2002(6):51.
[6]王光全,孟庆杰.苦荬菜的开发利用及其栽培技术[J].农业科技通讯,2004(7):4-5.
WANG Guangquan,MENG Qingjie.The development and utilization of Ixeris and its cultivation techniques[J].Bulletin of Agricultural Science and Technology,2004(7):4-5.
[7]李凤玲,王笃学,李明,等.苦荬菜的药理作用及在畜牧业中的应用[J].安徽农业科学,2007,35(33):10723-10725.
LI Fengling,WANG Duxue,LI Ming,et al.Study on the pharmacological action and the application in the fanning ofLactucaindicaL.[J].Journal of Anhui Agricultural Sciences,2007,35(33):10723-10725.
[8]罗伟强,黄润均,邓光辉.苦荬菜茎黄酮类化合物提取方法研究[J].广西民族学院学报:自然科学版,2003,9(1):31-32.
LUO Weiqiang,HUANG Runjun,DENG Guanghui.Leaching method of flavones from ixerischinesis(thunb)nakai stem[J].Journal of Guangxi University for Nationalities:Natural Science Edition,2003,9(1):31-32.
[9]李春霞,刘红兵,管华诗.苦荬菜属植物化学研究进展[J].天然产物研究与开发,2000,12(5):95-99.
LI Chunxia,LIU Hongbin,GUAN Huashi.Developments of phytochemistry of Ixeris[J].Natural Product Research and Development,2000,12(5):95-99.
[10]姜长阳,周晓丽,李萍,等.稠李的组织培养及无性系的建立[J].辽宁大学学报:自然科学版,2003,30(4):384-387.
JIANG Changyang,ZHOU Xiaoli,LI Ping,et al.Tissue culture and establishment of asexual cell line of prunus padus[J].Journal of Liaoning University:Natural Sciences Edition,2003,30(4):384-387.
[11]佟凤芹,栾岚.两种植物小茎尖组织培养及快速繁殖[J].辽宁大学学报:自然科学版,2003,30(3):288-290.
TONG Fengqin,LUAN Lan.Tissue culture and rapid propagation of two plants[J].Journal of Liaoning University:Natural Science Edition,2003,30(3):288-290.
[12]邱奉同,张渝洁,张利.苦菜的组织培养与快速繁殖[J].安徽农业科学,2005,33(2):241-242.
QIU Fengtong,ZHANG Yujie,ZHANG Li.Tissue culture and rapid propagation of ixeris chinensis[J].Journal of Anhui Agricultural Sciences,2005,33(2):241-242.
[13]曾建军,欧阳群,李晓红,等.车前不定芽直接诱导及再生体系的建立[J].安徽农业科学,2008,36(5):1810-1811.
ZENG Jianjun,OUYANG qun,LI Xiaohong,et al.Direct induction of adventitious buds and establishment of regeneration system inPlantagoasiaticaL.[J].Journal of Anhui Agricultural Sciences,2008,36(5):1810-1811.
[14]蓝桃菊,许鸿源,何冰,等.罗汉果不同器官直接分化再生苗的研究[J].生物技术通报,2006(z1):514-516,533.
LAN Taoju,XU Hongyuan,HE Bing,et al.Studies on direct differentiatiing regenerated plantlets from different organs ofSiraitiagrosvenoriiin vitro[J].Biotechnology Bulletin,2006(z1):514-516,533.
[15]高琳娜.黄金菊组织培养及植株再生体系的建立[D].大连:辽宁师范大学,2010.
GAO Linna.Studies on tissue culture and plant regeneration ofAchyrophorusciliata(Thunb.)Schultz[D].Dalian:Liaoning Normal University,2010.
[16]廖祥儒,张蕾,徐景智,等.光在植物生长发育中的作用[J].河北大学学报:自然科学版,2001,21(3):341-345.
LIAO Xiangru,ZHANG lei,XU Jingzhi,et al.Role of light in plant development[J].Journal of Hebei University:Natural Science Edition,2001,21(3):341-345.
[17]安利佳,姜长阳.植物组织培养导论[M].大连:辽宁师范大学出版社,1996:55-56.
AN Lijia,JIANG Changyang.Introduction to plant tissue culture[M].Dalian:Liaoning Normal University Press,1996:55-56.
[18]巩振辉,申书兴.植物组织培养[M].北京:化学工业出版社,2007:68.GONG Zhenhui,SHEN Shuxing.Plant tissue culture[M].Beijing:Chemical Industry Press,2007:68.
[19]李浚明,朱登云.植物组织培养教程[M].北京:中国农业大学出版社,2005:44-45.
LI Junming,ZHU Dengyun.Plant organization of training courses[M].Beijing:China Agricultural University Press,2005:44-45.
[20]周索,庞振龙,庞发虎,等.不同生长素诱导对拟南芥根生长发育的影响[J].安徽农业科学,2006,34(9):1816-1818.
ZHOU Suo,PANG Zhenlong,PANG Fahu,et al.Different auxin induction of arabidopsis root growth[J].Journal of Anhui Agricultural Sciences,2006,34(9):1816-1818.
Clone construction through direct differentiation from tender stems ofIxerischinensis
ZHANG Zhuo,WANG Yan,WANG Xiao-xu,LI Hui,JIANG Chang-yang
(College of Life Sciences,Liaoning Normal University,Dalian 116081,China)
In order to preserve the wild resources and meet the needs of germchits for planting,meristems,leaves,stipe and tender stems without buds ofIxerischinensiswere used as explants to induce direct differentiation.The results indicated that tender stems without buds were the best one of the four stuffs for direct differentiation inducing without callus,MS+BA 0.5 mg/L+IBA 0.5 mg/L+KT 0.5 mg/L+sucrose 30 g/L was the perfect medium for direct differentiation induction;the best medium for rooting of differentiated buds was 1/4 MS+IAA 0.2 mg/L+sucrose 20 g/L;1/2 clays from garden+1/2 sands was the best substrate for transplanting of regeneration plants,the transplanting survival rate was 98.4%and stable planting survival rate was 98.8%.This experiment proved that clone through direct differentiation from tender stems ofIxerischinensiscan be established with perfect conditions.
Ixerischinensis;direct differentiation;rooting;clone
Q945
A
1000-1565(2012)02-0180-07
2011-09-16
辽宁省高等教育教学改革项目(20090304);辽宁师范大学教学改革项目(LSJG:20090108)
张卓(1987-),女,辽宁沈阳人,辽宁师范大学在读硕士研究生.
姜长阳(1953-),男,辽宁大连人,辽宁师范大学教授,主要从事植物技术研究.E-mail:changyangjiang@126.com
赵藏赏)
