内皮祖细胞对糖尿病心肌病大鼠氧化应激作用的研究
2012-12-09成永霞刘贵波颜彬郭素芬冯玉宽陈丽丽曹永王宏伟孙立新李志强
成永霞 刘贵波 颜彬 郭素芬 冯玉宽 陈丽丽 曹永 王宏伟 孙立新 李志强
近年来,糖尿病发病率呈上升趋势,我国糖尿病患者达9240万例,糖尿病前期患者高达1.48亿[1]。糖尿病心肌病(Diabetic cardiomyopathy,DCM)是糖尿病心肌损害的特异性表现,与糖尿病患者心力衰竭高发生率和高死亡率密切相关,病理表现为心肌肥大,心室重量/体重比(心脏重量指数)增加,局灶性心肌坏死和心肌纤维化等[2]。高血糖状态可通过各种机制导致血管内皮细胞损伤,同时,氧化应激及过氧化物产生过量与糖尿病心肌病发展密切相关,本实验拟探讨内皮祖细胞(Endothelial progenitor cells,EPCs)对糖尿病心肌病的治疗作用,及其对机体氧化应激的影响。
1 材料与方法
1.1 材料
实验用清洁级SD大鼠(中国医科大学实验动物中心);链脲佐菌素(STZ,Sigma 公司);EPCs细胞(本实验室分离培养);M199培养基、胎牛血清(Hyclone 公司);VEGF、FGF、EGF(PeproTech 公司);eNOS、iNOS 抗体(Abcam 公司);谷胱甘肽(GSH)测定试剂盒、丙二醛(MDA)测定试剂盒(南京建成生物工程研究所)。
1.2 实验方法
1.2.1 糖尿病心肌病大鼠模型的建立及内皮祖细胞治疗
EPCs 培养于含有 VEGF 10 μg/L、FGF 4 μg/L、EGF 3 μg/L、10%胎牛血清的M199培养基中。24只SD大鼠随机分为3组:对照组(A),糖尿病心肌病模型组(B),EPCs治疗组(C),每组 8 只。 参照文献[3]建立大鼠糖尿病心肌病模型,即高糖高脂饲料喂养6周后,一次性空腹注射STZ 60 mg/Kg,选择连续两次空腹血糖大于7.77 mmol/L,且有多饮、多食、多尿症状的大鼠进行后续实验。C组于STZ注射8周后于尾静脉注射 EPCs 1×106个(500μL)。A、B 两组注射等体积生理盐水,8周后进行生化指标检测。
1.2.2 大鼠心肌组织形态学观察及血糖水平、血清GSH、MDA含量检测
取各组大鼠心肌组织行HE染色,观察各组心肌组织的形态学改变;采用葡萄糖氧化酶法进行空腹血糖(FBG)测定;采用GSH测定试剂盒和MDA测定试剂盒检测各组大鼠血清中GSH和MDA含量。
1.2.3 RT-PCR检测心肌组织中iNOS和eNOS的mRNA表达水平
取各组大鼠心肌组织,提取样本总RNA,逆转录得到对应的cDNA,进行PCR检测。引物如下。
iNOS sense:5'-TCTCCCGAAACGCTACACTT-3';antisense:5'-CGTCTGGCGAAGAACAATC-3'; 产物 长 度 317 bp。 eNOS sense:5'-ATGTATGGCTCT GAGACTGGC-3';antisense:5'-GGGTTACCACATCGTATTCATC-3'; 产物长度 115 bp;β-actin sense:5'-GGAGATTACTGCCCTGGCTCCTAGC -3',antisense:5'-GGCCGGACTCATCGTACTCCTGCTT-3';产物长度155 bp。引物由生工生物工程(上海)有限公司合成。PCR扩增条件:95℃ 90 sec预变性,94℃ 45 sec变性,55℃ 45 sec退火,72℃ 90 sec复性,25个循环后,72℃10min延伸。β-actin作为内对照。
1.2.4 Western blot检测心肌组织中iNOS和eNOS的蛋白表达水平
取各组大鼠心肌组织,RIPA裂解液裂解组织,BCA法进行蛋白质浓度测定,取20 μg等量蛋白质进行聚丙烯酰胺凝胶电泳(SDS-PAGE),免疫印迹法检测iNOS和eNOS蛋白表达变化。
1.2.5 统计学分析
采用SPSS 16.0软件进行数据分析,数据以均数±标准差表示,组间比较采用单因素方差分析。
2 结果
2.1 各组大鼠心肌组织形态学观察
A组心肌细胞排列整齐,B组表现为心肌肥大、心肌细胞排列紊乱,C组心肌细胞排列较整齐,与正常组近似(图1)。
2.2 各组大鼠血糖、GSH和MDA含量检测
与A组相比,B组大鼠血糖显著增高(P<0.01),是A组的6.04倍;C组血糖明显低于B组(P<0.01),但仍高于A组(P<0.01);同时,B组大鼠血清GSH含量显著降低(P<0.01),MDA 含量显著升高(P<0.01);与 B组相比,C组GSH含量显著升高(P<0.01),MDA含量明显降低(P<0.01),表明EPCs可以缓解糖尿病心肌病导致的脂质过氧化作用(表1)。
2.3 大鼠心肌组织中iNOS和eNOS的mRNA表达
RT-PCR结果显示,B组中iNOS和 eNOS的mRNA表达均显著升高(P<0.01),C组明显低于B组(P<0.05)。
2.4 大鼠心肌组织中iNOS和eNOS蛋白表达水平
各组大鼠心肌组织中iNOS和eNOS蛋白的表达情况与RT-PCR结果一致。B组表达显著升高(P<0.05),C 组明显低于 B 组(P<0.05)。
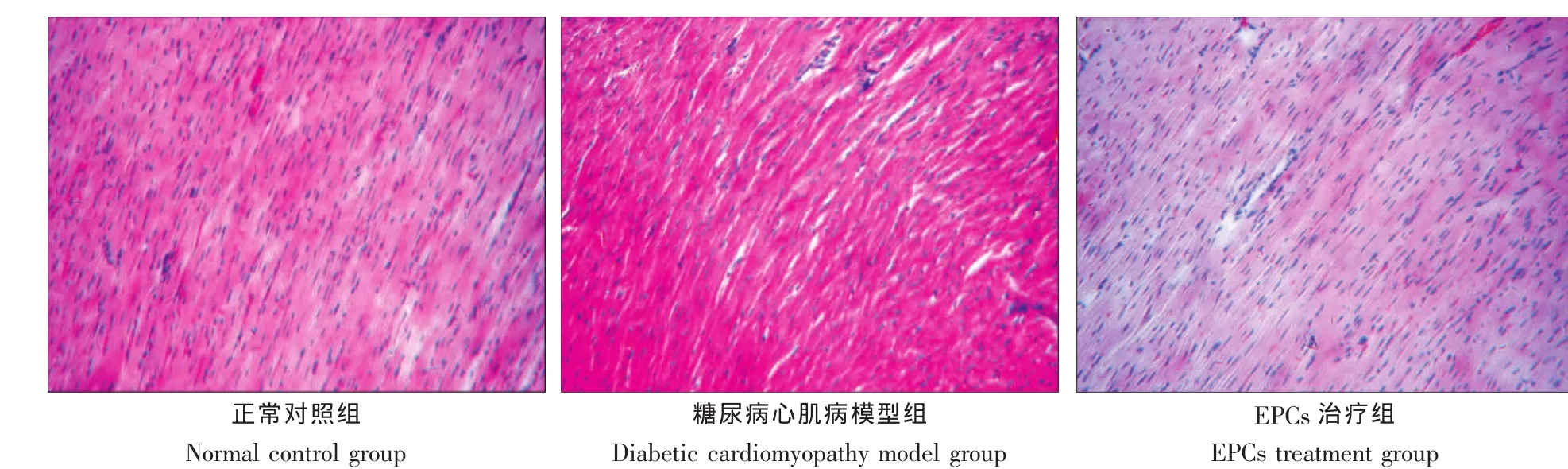
图1 大鼠心肌组织形态学观察Fig.1 Morphological observation of myocardial tissue in rat
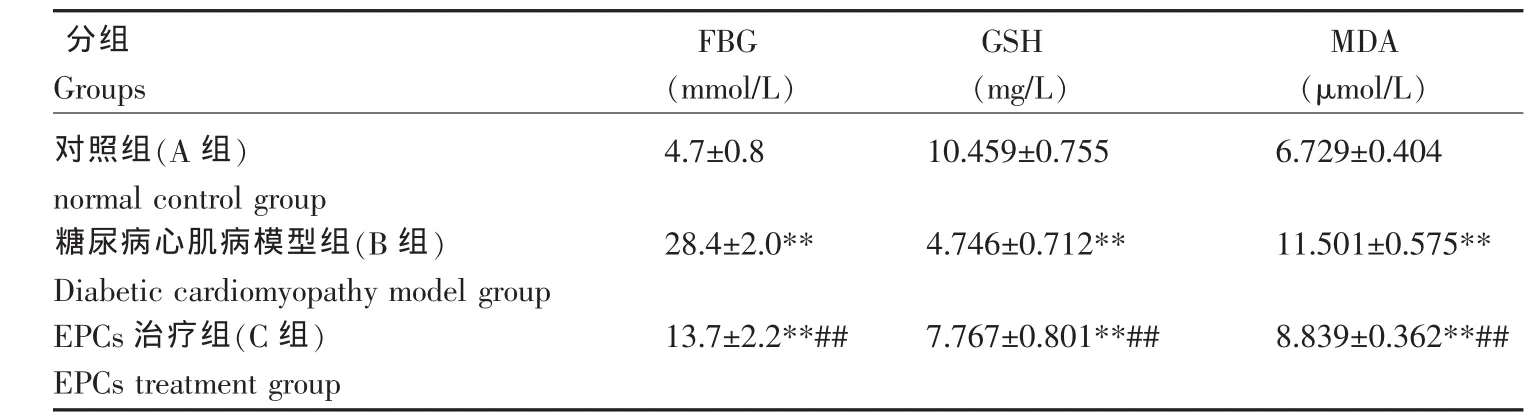
表1 各组大鼠血糖、GSH和MDA含量比较Table 1 Comparison of the blood glucose GSH and MDA content of different rat groups
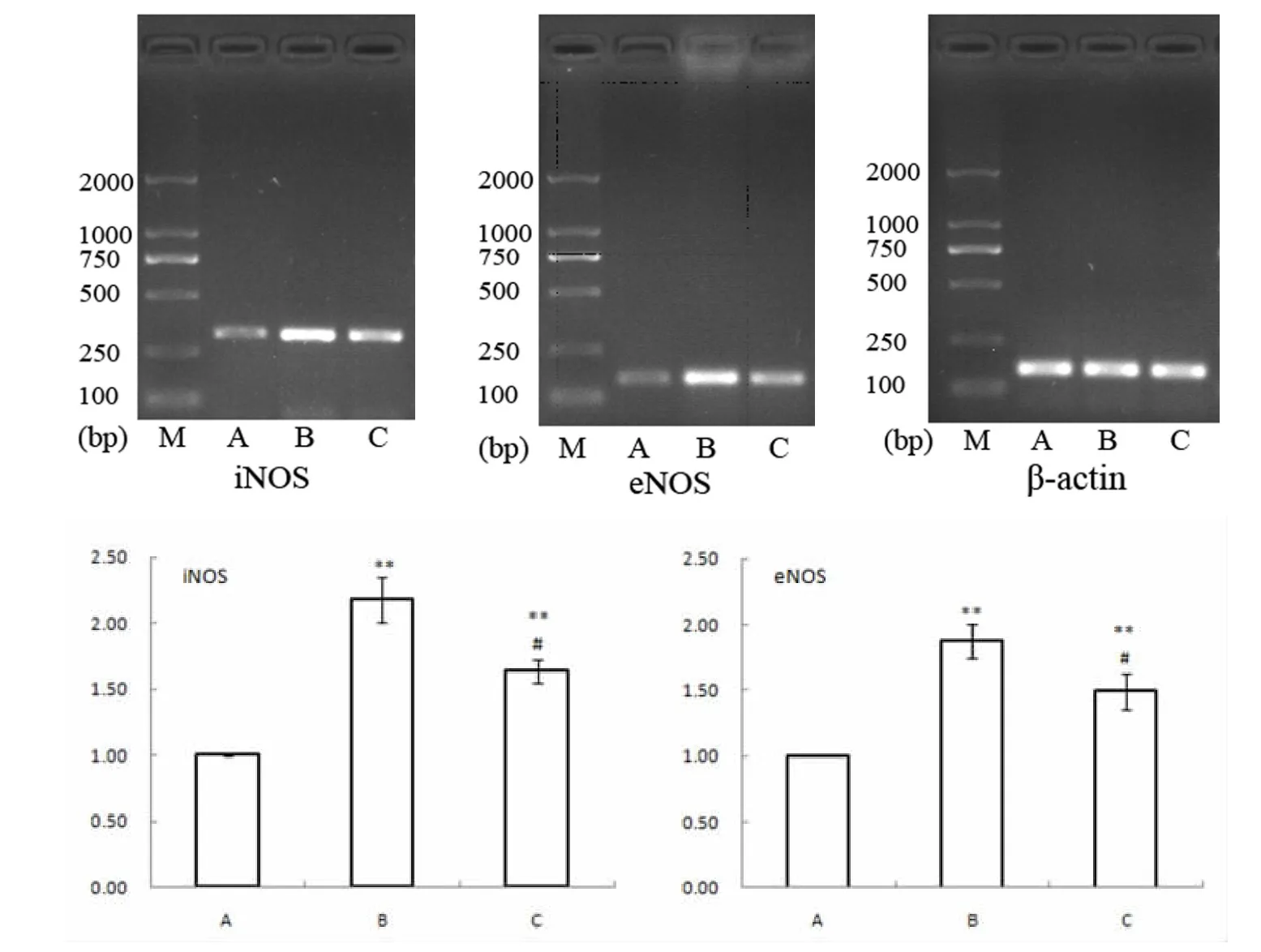
图2 大鼠心肌组织中iNOS和eNOS mRNA的表达比较Fig.2 Comparison of iNOS and eNOS mRNA expression in myocardial tissue of rats
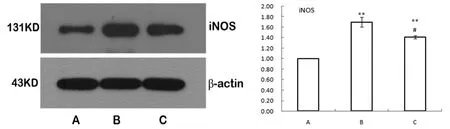
图3 大鼠心肌组织中iNOS蛋白表达比较Fig.3 Comparison of iNOS protein expression in myocardial tissue of rats
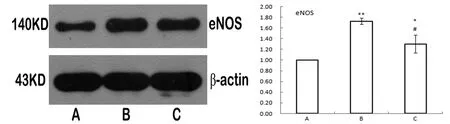
图4 大鼠心肌组织中eNOS蛋白表达比较Fig.4 Comparison of eNOS protein expression in myocardial tissue of rats
3 讨论
本研究采用高糖高脂饲料喂养合并STZ诱导的方法,建立大鼠糖尿病模型。此方法能够模拟临床2型糖尿病患者,并且具有建模周期短、死亡率低等优点[4],被广泛应用于糖尿病相关的实验研究。本实验所建立的大鼠模型具有稳定的高血糖和高血脂表现。HE染色显示,B组心肌细胞肥大且排列紊乱,表明已成功建立了大鼠DCM模型。
内皮组细胞(Endothelial progenitor cells,EPCs)是血管内皮细胞的前体细胞,能够参与血管内皮修复以及血管新生。研究表明,糖尿病患者EPCs数量明显减少,且血管功能发生病理性改变[5],Loomans等[6]认为,糖尿病患者EPCs的数量和增殖能力与空腹血糖、糖化血红蛋白水平呈显著负相关。胰岛素抵抗(IR)是2型糖尿病最重要的病理生理学特征。相关研究表明,血管内皮功能障碍与IR密切相关[7-8]。本研究中,C组血糖水平较B组显著降低,可能是血管内皮功能的修复改善了胰岛素抵抗状态。
DCM是糖尿病患者的一种特异性心肌疾病,随着糖尿病发病率的逐年增高和病程的延长,DCM成为糖尿病患者死亡的主要原因之一[9]。DCM的发病机制尚未明确。有研究表明,高血糖导致的氧化应激能够引起心肌功能障碍,并参与DCM发生发展的各个环节[10]。MDA是脂质过氧化反应的高毒性副产物,能够反映体内脂质过氧化损伤的程度及氧化应激的水平。GSH为体内重要的抗氧化剂和自由基清除剂,可阻断氧自由基对心肌的损害,预防、减轻及终止组织细胞损伤,在保护心肌细胞方面具有良好的作用[11-12]。本研究结果提示,B组大鼠血清MDA含量明显升高,GSH含量显著降低,表明机体中存在着一定的氧化损伤;采用EPCs治疗后,MDA含量显著降低,GSH含量显著回升,提示机体氧化应激损伤得到缓解。
机体的氧化应激作用可形成过多的超氧离子,超氧离子与NO相互作用能够形成潜在的细胞毒性物质,导致心血管功能的紊乱。正常情况下,心肌细胞能够合成少量NO维持生理功能,当受到外界刺激后,导致一氧化氮合酶(NOS)表达增加,从而产生大量的NO参与病理过程[13]。Crespo等[14]在STZ诱导的糖尿病心肌病大鼠模型中,检测到超氧化物含量的增加以及eNOS、iNOS的显著升高,表明eNOS和iNOS活性的升高与心脏功能的下降密切相关,推测心脏氧化应激可能是STZ诱导的糖尿病心肌病的主要病因。本研究中,B组大鼠心肌组织中eNOS和iNOS的表达均显著升高,与已有的报道一致[15],而C组eNOS、iNOS表达显著降低,提示EPCs具有缓解心肌损伤的作用。
DCM主要是由糖尿病引起的心脏微血管病变和心肌代谢紊乱所致的心肌局灶性坏死。研究表明,EPCs具有促进缺血组织新生血管形成的作用[16-17],将EPCs注射入大鼠心肌梗死灶边缘,能够显著提高心室射血分数和左心室短轴缩短率,表明EPCs能够改善心肌功能[18]。本研究表明,EPCs能够有效缓解DCM大鼠机体的氧化应激反应,降低NOS水平,恢复受损的心肌组织。我们推测可能与心肌血管生成,以及心肌功能的改善有关,但其详细的作用机理还有待于进一步研究。
[1]Yang W,Lu J,Weng J,et al.Prevalence of diabetes among men and women,China[J].N Engl J Med,2010,362(12):1090-1101.
[2]刘冬戈,乔旭柏,杜俊,等.糖尿病心肌病的组织病理学观察[J].中华病理学杂志,2007,36(12):801-804.
[3]董世芬,洪缨,孙建宁,等.实验性糖尿病心肌病大鼠模型建立及心脏功能和结构相关性分析[J].中国实验动物学报,2010,18(6):457-463.
[4]Asghar O,Al-Sunni A,Khavandi K,et al.Diabetic cardiomyopathy[J].Clin Sci(Lond),2009,116(10):741-760.
[5]Tepper OM,Galiano RD,Capla JM,et al.Human endothelial progenitor cells from Type II diabetics exhibit impaired proliferation,adhesion,and incorporation into vascular structures[J].Circulation,2002,106(22):2781-2786.
[6]Loomans CJ,de Koning EJ,Staal FJ,et al.Endothelial progenitor cell dysfunction:A novel concept in the pathogenesis of vascular complications of type 1 diabetes[J],Diabetes,2004,53(1):195-199.
[7]朱旅云,刘坤申.血管内皮功能与皮脂含量、分布及胰岛素抵抗的关系[J].解放军医学杂志,2003,18(3):739-741.
[8]Pinkney JH,Stehouwer CD,Coppack SW,et al.Endothelial dysfunction:cause of the insulin resistance syndrome[J].Diabetes,1997,46(Suppl):9-12.
[9]段云燕,赵雯,张军.糖尿病心肌病发病机理研究进展[J].心血管病学进展,2011,32(4):524-527.
[10]Hamblin M,Friedman DB,Hill S,et al.Alterations in the diabetic myocardial proteome coupled with increased myocardial oxidative stress underlies diabetic cardiomyopathy[J].Mol Cell Cardiol,2007,42(4):884-895.
[11]张赢予,方春钱,陈赟.还原性谷胱甘肽对糖尿病心肌病大鼠心肌线粒体功能的影响[J].中国生物制品学杂志,2010,23(4):358-368.
[12]宫艳丽,张清媛.还原型谷胱甘肽预防表阿霉素心脏毒性的观察[J].中国康复理论与实践,2008,14(8):754-756.
[13]朱莉,徐道亮,朱妍.糖尿病心肌组织中NOS的改变与糖尿病心肌病关系探讨[J].江苏医药杂志,2001,27(10):738-739.
[14]Crespo MJ,Zalacaín J,Dunbar DC,et al.Cardiac oxidative stress is elevated at the onset of dilated cardiomyopathy in streptozotocindiabetic rats[J].J Cardiovasc Pharmacol Ther,2008,13(1):64-71.
[15]Farhangkhoee H,Khan ZA,Chen S,et al.Differential effects of curcumin on vasoactive factors in the diabetic rat heart[J].Nutr Metab(Lond),2006,3:27.
[16]Zhou B,Xiao C.Prevention of diabetic microangiopathy by prophylactic transplant of mobilized peripheral blood mononuclear cells[J].Acta Pharmacologica Sinica,2006.28(1):89-97.
[17]Zhou B,Feng XM.Impaired therapeutic vasculogenesis by transplantation of OxLDL-treated endothelial progenitor cells[J].J Lipid Res,2007,48(3):518-527.
[18]杨亚荣,曾秋棠,郎明健,等.内皮祖细胞移植对大鼠心肌梗死后缺血心肌血管再生及心功能的影响[J].中国组织工程研究与临床康复,2008,12(25):4815-4818.
