HMGB 1分子A-Box的表达纯化及其促分化功能鉴定的研究
2012-12-09曹小芳王恒湘何梓铭王芳杨洋郭子宽
曹小芳 王恒湘 何梓铭 王芳 杨洋 郭子宽
(何梓铭,王芳,杨洋,郭子宽)。
高迁移率族蛋白(High mobility group box 1,HMGB1)是广泛存在于真核生物细胞核内的染色体结合蛋白,也存在于细胞质和细胞外,具有多种生理和病理学作用,主要由A-box、B-box及酸性尾端3个结构域组成[1]。HMGB1与炎细胞表面的RAGE受体、TLR22和TLR24等受体相互作用后可引起细胞内信号转导途径的活化,释放炎性因子[2]。细胞坏死或损伤时,在肿瘤坏死因子的作用下,细胞核内的HMGB1可释放到胞外,刺激单核巨噬细胞分泌促炎因子,促炎因子又可促进HMGB1的分泌,形成正反馈环。在炎性反应的后期,这种正反馈效应对RA等疾病炎性反应的维持具有重要的作用[3-4]。间充质干细胞(Mesenchymal stem cells,MSC)是一类具有多向分化能力的成体干细胞,在适宜的条件下,可以分化为成骨细胞、成软骨细胞、成脂肪细胞、血管内皮细胞、肝脏细胞、神经细胞和心肌细胞等[5]。值得关注的是,间充质干细胞所处的微环境可能对其生物学特性产生相应的影响,赋予其独立的特征。然而,HMGB-1 A-box对MSC的作用研究甚少。为探讨HMGB1A-box是否具有促成骨作用,我们进行了其表达载体构建、重组蛋白纯化和生物学活性的研究。
1 材料和方法
1.1 材料
pGEM-T Easy Vector Systems购于Promega公司;pET24a HMGB1基因由生工生物工程(上海)股份有限公司合成;E.coli DH5α 和 BL21 PlySs(DE3)大肠杆菌感受态购于北京Transgen公司;人骨髓间充质干细胞由本室保存;测序公司为北京奥克生物技术公司;质粒提取试剂盒、琼脂糖凝胶回收试剂盒均购于北京天根生物公司;限制性内切酶BamHI、XhoⅠ购于Promega公司;蛋白定量试剂盒购于申能博彩生物技术有限公司;小鼠源HMGB1抗体为sigma产品;HRP2羊抗鼠2IgG购于Millipore公司;DNA marker购于天根生物技术公司;蛋白Marker购于上海生物工程有限公司;诱导剂IPTG为BBI产品;Western blot化学发光底物为Santa Cruz产品;α-MEM培养基购于Sigma公司;胎牛血清购于Hyclone公司。
1.2 方法
1.2.1 引物设计与合成
根据HMGB1基因序列,设计HMGB1 A-box上、下游特异性引物:5′-CAAATGGGTCGCGGATCCGAATTC-3′(划 线处 为 BamHI 酶 切 位 点 );5′-AAAAAGCTCGAGCACCACCACCACC-3′(划线处为XhoⅠ酶切位点)。上述引物均由北京奥克生物技术公司合成。
1.2.2 重组DNA技术
以质粒pET24a HMGB1为模板扩增目的基因,PCR回收产物与pGEM-T Easy Vector载体按摩尔数4:1的比例加入反应体系,室温连接4h后转化E.coli DH5α感受态。转化完成后,将菌液涂布于Amp+的LB琼脂板(先将5μL 1M 的IPTG 和20μL 50 mg/mL的X-gal涂布于琼脂板上)上,菌液体积要有一定梯度。将涂布好的琼脂板倒置于37℃的培养箱中,培养12~16 h,至平板上出现可辩的蓝、白菌落,将白色菌落标号,提质粒行酶切鉴定和DNA测序鉴定重组子。重组pGEM-T AboxA-box经BamHI、XhoⅠ双酶切分离目的基因片段,插入表达载体HIS-tag的相应位点。阳性克隆扩菌,保存菌种并提取质粒备用。
1.2.3 重组蛋白的表达
经鉴定的阳性重组表达载体pET24a+转化E.coli BL21感受态菌株,挑取单个克隆菌落扩增培养至对数生长期。加入诱导剂IPTG,终浓度为1 mmol/L,37℃诱导4h。细菌裂解物行SDS-PAGE电泳,凝胶图像拍照记录,分析目的蛋白表达水平。
1.2.4 包涵体的制备、蛋白纯化和验证
重组菌株扩菌,超声破碎。离心收取沉淀(包涵体)。按照 MagneHISTM Protein purification system cat说明书裂解包涵体。重组菌株的超声上清与His-Link亲和层析柱4℃充分结合3 h,将亲和层析柱连于HID-2核酸检测仪,洗涤和洗脱获得纯化的重组蛋白,透析去除洗脱液中的咪唑等小分子物质。SDS-PAGE检测蛋白纯度。用小鼠源HMGB1单抗和辣根过氧化酶标记的抗小鼠二抗行Western blot,鉴定重组蛋白。
1.2.5 重组蛋白的生物学活性测定
收获传代3次的hBMSC,悬浮于含10%胎牛血清的低糖DMEM培养基中,按12000个细胞/孔接种于24孔培养板中。培养体系分为:①阴性对照组,培养体系为含10%胎牛血清的低糖DMEM培养基;②阳性对照组,培养体系中加入50 μg/mL维生素C磷酸盐,10 mM的磷酸甘油钠盐,10-7M地塞米松钠盐;③A-box组,体系中加入A-box,浓度分别为6.25 μg/mL,12.5 μg/mL,25 μg/mL 和 50 μg/mL。每组4孔。3次实验使用细胞来源于3个不同个体。培养1周后,吸除培养上清,1%多聚甲醛固定后,NBT/BCIP试剂进行碱性磷酸酶染色,倒置显微镜观察。
2 结果
2.1 重组表达载体的构建
以pET24a HMGB1为模板,行PCR扩增。 琼脂糖凝胶电泳显示扩增的基因片段约250 bp,与目的基因片段大小相符(图1)。
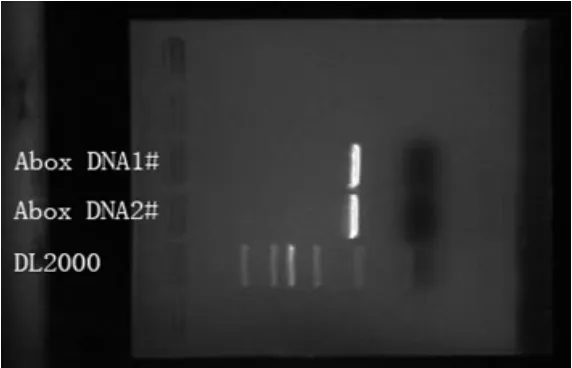
图1 PCR结果显示A-box目的片段Fig.1 Human HMGB1 A-box showed by DNA sequencing
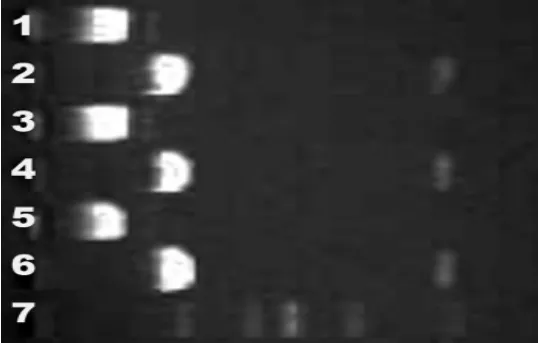
图2 pGEM-T A-box质粒酶经BamHI和XhoⅠ酶切后琼脂糖电泳结果。1,3,5道分别代表不同细菌克隆的质粒;2,4,6道分别代表相应质粒酶切后电泳结果;7道是DNA分子标准物Fig.2 The targeted cDNA fragment separated by agarose gel electrophoresis after enzyme digestion by BamH I and Xho I.1,3,5:different recombinant vector;2,4,6:different recombinant vector after enzyme digestion;7:DNA marker
将目的片段插入克隆载体pGEM-T,挑选阳性克隆,提取质粒并进行BamH I和XhoⅠ双酶切鉴定,证实克隆片段大小为250 bp(图2),符合预期结果。将质粒DNA回收,进行质粒DNA序列测定,测序结果与Genebank所记载的序列完全相符。
将克隆载体质粒用BamHI和XhoⅠ消化,纯化目的片段并将之插入原核表达载体pET24a+的HIS-tag相应位点,酶切验证所插入片段为250 bp左右(图3),与目的条带大小相符合,证实获得了人HMGB1 A-box的重组表达载体。
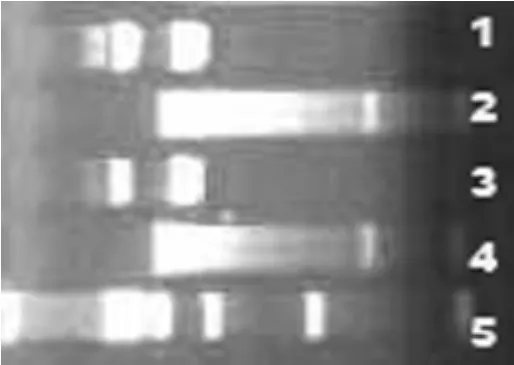
图3 pET24a+/A-box酶切鉴定结果。1,3代表双酶切结果;2,4代表质粒;5代表DNA分子标准物Fig.3 The targeted cDNA fragment after enzyme digestion by pET24a+/A-box.1,3:recombinant vector after enzyme digestion;2,4:recombinant vector;5:DNA marker
2.2 重组蛋白的表达
阳性重组菌株诱导前、后和含有pET24a+/A-box菌株裂解液均行SDS-PAGE。诱导后裂解pET24a+/A-box阳性重组菌株,电泳证实在相对分子质量约为11000处可见一明显蛋白条带,与预期蛋白大小相符(图4)。目的蛋白质总量约为菌体总量的45%。
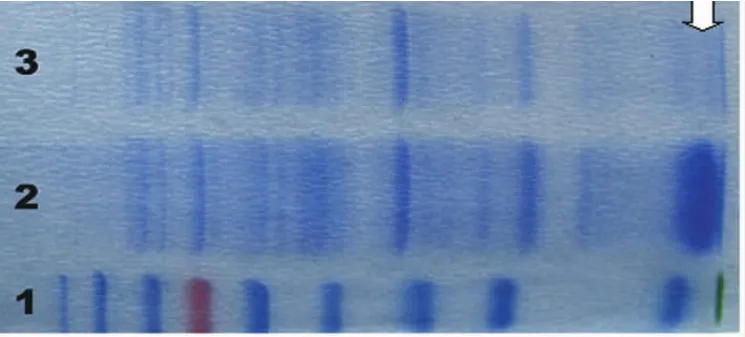
图4 转染的阳性细菌目的蛋白表达情况。1-3分别代表:蛋白质分子标记物,IPTG诱导的菌体裂解液,未诱导的菌体裂解液。箭头所指为目的蛋白大小Fig.4 A-box expression after transfection.1:marker;2:bacterium spallation induced by IPTG;3:un-induced bacterium spallation;arrow:the targeted protein
2.3 重组蛋白的纯化
将重组菌体扩增后,IPTG诱导表达。收集菌体,超声破碎包涵体,收获裂解上清,行His柱亲和层析,并收获目的蛋白。SDS-PAGE电泳显示,经纯化后,未见杂蛋白条带,表明收获蛋白纯度较高(图5)。
用小鼠源HMGB1单抗和辣根过氧化酶标记的抗小鼠的二抗行Western blot,以HMGB-1蛋白分子为阳性对照,以鉴定重组蛋白。结果两者均能与抗体发生特异性反应,表明重组蛋白为特异性人HMGB1 A-box蛋白(图 6)。
2.4 重组蛋白的生物学活性
我们的前期实验表明,HMGB1能诱导hBMSC向成骨细胞分化[6]。鉴于A-box是HMGB1分子的受体结合区,A-box可能具有相似的作用。实验表明,hBMSC培养体系中加入A-box,1周后进行碱性磷酸酶染色发现,随着A-box浓度增加,细胞染色逐渐变强,甚至较阳性对照孔细胞深。因此,A-box具有明显的促MSC分化为成骨细胞的作用(图7)。
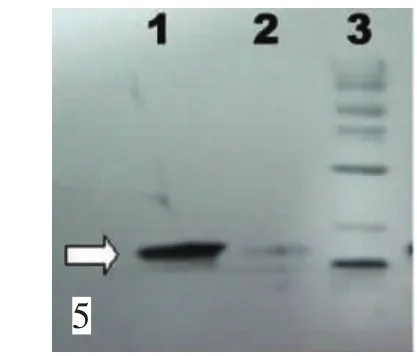
图5 经纯化后蛋白电泳图。1-3:包涵体裂解物经纯化后,上清经纯化后,蛋白质分子标准物。箭头为目的蛋白大小Fig.5 A-box expression after purification.1:inclusion lysate after purification;2:supernatant after purification;3:marker;arrow:the targeted protein
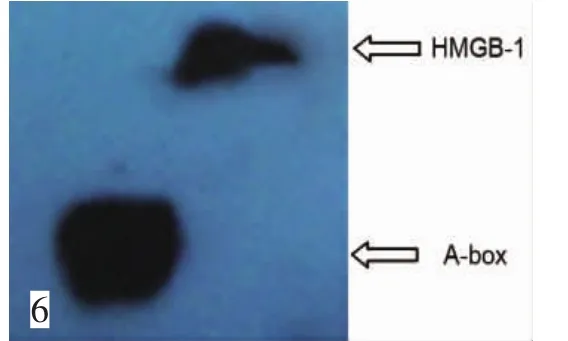
图6 Western blot结果。以HMGB1蛋白为阳性对照,证实所纯化蛋白为A-boxFig.6 A-box expression tested by western blot and HMGB1 was taken as positive control
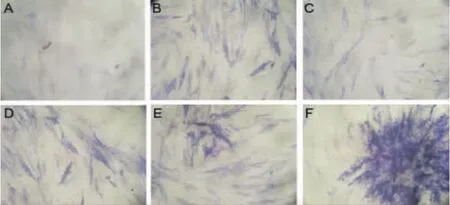
图7 A-box体外促MSC成骨分化作用。将人MSC培养于含10%胎牛血清的低糖DMEM(A),或在体系中加入成骨诱导剂组合(B),A-box(6.25 μg/mL)(C),A-box(12.5 μg/mL)(D),A-box(25 μg/mL)(E)和 A-box(50μg/ml)(F)。 NBT/BCIP染色显示碱性磷酸酶阳性细胞(成骨细胞)Fig.7 The induction-promoting effects on mesenchymal stem cells of A-box in vitro.A:normal medium;B:ossification revulsant added medium;C:6.25 μg/mL A-box added medium;D:12.5 μg/mL A-box added medium;E:25 μg/mL A-box added medium;F:50 μg/mL A-box added medium
3 讨论
HMGB 1含215个氨基酸残基,是高迁移率族蛋白的超家族成员之一。HMGB1是一个炎性因子,在自身免疫性疾病和脓毒血症等疾病发生发展中,起着十分重要的作用[7]。此外,间充质干细胞表达相关受体,可受HMGB-1趋化而迁徙至炎性组织,并在其作用下分化为成骨细胞[6]。因此,HMGB-1也可能参与了某些骨关节疾病的发病过程[8]。
HMGB1含有两个结构区域,称为A-box和B-box。其中,A-box是HMGB1细胞受体结合区域,B-box为效应区域。因此,体系中加入A-box单体,可竞争阻断HMGB1与受体的结合,从而抑制HMGB1引起的炎症反应。因此,A-box单体作为HMGB1拮抗剂,有可能用于自身免疫性疾病和败血症的治疗[9-11]。文献报道,HMGB1是重要的炎症因子,广泛参与各种急、慢性炎症过程,并在疾病的转归中起关键作用[11]。因而,以HMG蛋白作为药物治疗的靶点在炎症性疾病的研究中具有重要意义[10-11]。
我们的研究证实,A-box单体与HMGB-1类似,可促进MSC向成骨细胞分化,这种作用呈现剂量依赖性。A-box的作用具有双重性,即抗炎性反应和促成骨分化作用,为其在多种疾病中的应用提供了独特的可行性。如类风湿性关节炎,它是一种由免疫反应介导的关节局部炎性反应,在疾病后期,常出现骨蚀等骨关节损伤。因此,结合本实验结果可以推测,利用A-box单体治疗,可以通过阻断HMGB-1的活性,以抑制骨关节局部的炎性反应;而且,可以通过促成骨作用,加速骨组织损伤的修复。再如,骨折后骨不连同时存在炎性反应和骨修复障碍。A-box单体的双重作用,在促进局部MSC分化为成骨细胞的同时,拮抗由组织坏死引起的炎性反应,可能适用于此类疾病的治疗。然而,A-box能否真正应用于上述疾病,具体的应用途径和剂量,以及A-box单体是否具有其它生物学效应,仍需大量研究探讨。
[1]Andersson U,Erlandsson-Harris H,Yang H,et al.HMGB1 as a DNA-binding cytokine[J].J leukoc Biol,2002,72(6):1084-1091.
[2]Taguchi A,Blood DC,del Toro G,et al.Blockade of RAGE-amphoterin signalling suppresses tumour growth and metastases[J].Nature,2000,405(6784):354-360.
[3]Andersson U,Wang H,Palmblad K,et al.High mobility group 1 protein (HMG-1)stimustimulatesproinflammatory cytokine synthesis in human monocytes[J].J Exp Med,2000,192(4):565-570.
[4]Czura CJ,Tracey KJ.Targeting high mobility group box 1 as late-acting mediator of inflammation[J].Crit Care Med,2003,31(1 Suppl):S46-50.
[5]王恒湘,郭子宽.间充质干细胞在组织再生应用中的诸多问题[J].组织工程与重建外科杂志,2008,4(5):241-245.
[6]Meng E,Guo Z,Wang H,et al.High mobility group box 1 protein inhibits the proliferation of human mesenchymal stem cells and promotes their migration and differentiation along osteoblastic pathway[J].Stem Cells Dev,2008,17(4):805-813.
[7]Andersson U,Erlandsson-Harris H,Yang H,et al.HMGB1 as a DNA-binding cytokine[J].J Leukoc Biol,2002,72(6):1084-1091.
[8]Heinola T,Kouri VP,Clarijs P,et al.High mobility group box-1(HMGB-1)in osteoarthritic cartilage[J].Clin Exp Rheumatol,2010,28(4):511-518.
[9]Kokkola R,Li J,Sundberg E,et al.Successful treatment of collageninduced arthritis in mice and rats by targeting extracellular high mobility group box chromosomal protein 1 activity[J].Arthritis Rheum,2003,48(7):2052-2058.
[10]Nogueira-Machado JA,de Oliveira Volpe CM.HMGB-1 as a target for inflammation controlling[J].Recent Pat Endocr Metab Immune Drug Discov,2012,6(3):201-209.
[11]Scaffidi P,Misteli T,Bianchi ME.The release of chromat in protein HMGB1 by necrotic cells triggers inflammation[J].Nature,2002,418(6894):191-195.
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
