DPP-4抑制剂的心血管保护作用
2012-12-08汤智慧巴建明
汤智慧 巴建明
二肽基肽酶-4(DPP-4)抑制剂作为一类新上市用于治疗2型糖尿病的药物,最新的荟萃分析结果显示[1],DPP-4抑制剂可以有效地降低糖化血红蛋白(HbA1c)0.6%~1.1%,与安慰剂相比不易出现低血糖,且不易引起严重不良反应。
既往临床前研究以及初步临床资料显示,DPP-4抑制剂除可有效控制血糖外,可能同时具有心血管保护作用,但其上市时间尚短,其长期临床使用的心血管安全性仍是我们关心的主要问题。目前有关DPP-4抑制剂心血管安全性的诸多大型前瞻性临床研究正在进行之中,尚无最终结果报告。例如沙格列汀的SAVOR研究[2]、阿格列汀的EXAMINE研究[3]、西格列汀的TECOS研究[4]、Linagliptin的CAROLINA研究[5]等。本文将就DPP-4抑制剂对于心血管保护作用的相关研究,以及正在进行的相关前瞻性研究进展作一综述。
DPP-4抑制剂的作用机制及其降糖疗效
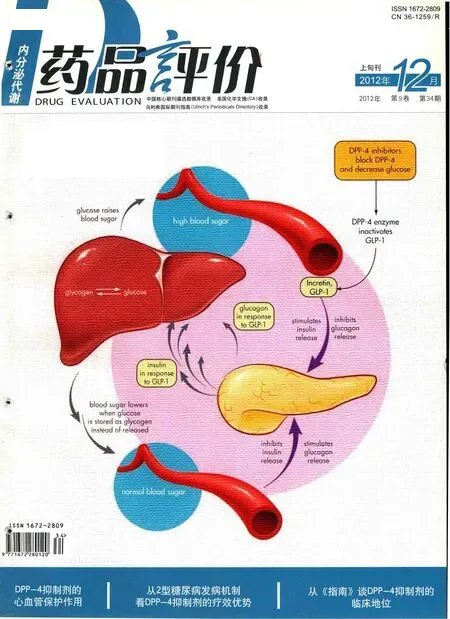
DPP-4抑制剂主要通过阻断DPP-4酶的活性,使其灭活胰高糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素分泌多肽(GIP)的作用减弱,从而提高体内GLP-1和GIP的浓度及延长其活性,进而通过发挥葡萄糖依赖的促胰岛素分泌作用,同时抑制胰高糖素分泌、延缓胃排空等来降低血糖。
DPP-4抑制剂作为新型降糖药物,其降糖疗效以及安全性已经得到临床的肯定。在一项为期54周的随机、双盲、对照试验中,将受试者(n=1091)在完成24周与安慰剂对比的试验后,885例患者继续30周的治疗分为下列5组:西格列汀100mg/d+二甲双胍2000mg/d (n=161)、西格列汀100mg/d+二甲双胍1000mg/d(n=160)、西格列汀100mg/d(n=141)、二甲双胍1000mg/d(n=147)、二甲双胍2000mg/d(n=153),结果显示,与基线平均HbA1c(8.7%)相比,以上各组HbA1c分别下降1.9%、1.7%、1.4%、1.2%和1.6%,提示单用西格列汀与常规剂量二甲双胍降糖效果相当,与二甲双胍合用可进一步增强降糖效果。在整个试验过程中,低血糖发生率为1%~3%[6]。在一项最新的中国人群研究中,395例二甲双胍单药治疗血糖控制不佳的糖尿病患者,随机分为两组,在原有二甲双胍(1000mg/d或1700mg/d)降糖基础上,分别加用西格列汀100mg/d和安慰剂,结果显示与基线平均HbA1c(8.7%)相比,西格列汀组HbA1c可进一步下降0.9%,空腹血糖下降1.2mmol/L,餐后2h血糖下降1.9mmol/L(P<0.001)[7]。 另外最新的一项随机、对照、双盲试验中,520例患者随机分为西格列汀(100mg/d)联合吡格列酮(30mg/d)组以及吡格列酮(30mg/d)单药治疗组,24周后,317例患者继续进行试验,将两组吡格列酮的剂量均增加至45mg/d,至54周结束,结果显示与基线比较,联合治疗组HbA1c下降2.4%,吡格列酮单药组下降1.9%[8]。
在一项为期24周的随机、对照、双盲试验中,在二甲双胍(1500mg/d)降糖基础上加用Linagliptin(5mg/d,n=524),与加用安慰剂(n=177)相比,HbA1c可有进一步下降(-0.49 % vs 0.15%),无体重和低血糖风险增加[9]。最新的一项荟萃分析结果显示,与安慰剂相比,维格列汀(100mg/d)组HbA1c下降0.77%,未见不良反应增加[10]。 最新一项纳入19项试验的荟萃分析结果显示,DPP-4抑制剂单药治疗,降糖作用弱于二甲双胍和GLP-1激动剂,与磺脲类药物和噻唑烷二酮类药物相当,但是DPP-4抑制剂消化道不适症状少于二甲双胍和GLP-1激动剂,低血糖发生以及体重增加的风险低于磺脲类药物,并且未见鼻咽炎、尿路感染以及上呼吸道感染的风险增加[11]。DPP-4抑制剂以其独特的降糖机制以及安全有效的降糖作用,目前已经成为多项权威指南中的推荐用药。
DPP-4抑制剂的心血管保护作用及可能机制
关于对8项沙格列汀Ⅱ、Ⅲ期临床研究的Meta分析结果显示,沙格列汀组(n=3356)心血管事件发生率低于包括二甲双胍、格列本脲、噻唑烷二酮类药物以及安慰剂在内的对照组(n=1251),分别为0.7% vs 1.4%,沙格列汀组的心血管事件发生风险显著降低(HR=0.43,95%CI:0.23~0.80)[12]。而一项对8项Linagliptin的Ⅲ期临床试验的Mata分析结果显示,Linagliptin组5mg qd(n=3159)或10mg qd(n=160)心血管事件发生率明显低于对照组(安慰剂,n=977;格列美脲1~4mg/d, n=781;伏格列波糖0.6mg/d,n=162),Linagliptin组的心血管事件发生风险低于对照组(HR 0.34, 95%CI:0.16~0.70)[13]。
体外实验显示,GLP-1通过内皮PKA/eNOS途径和PI3K/Akt途径可以刺激人冠状动脉内皮细胞的增殖,另外还可以通过作用于血管内皮生长因子使得具有血管保护作用的内皮祖细胞增殖。Goto等[14]人发现,给予血管损伤模型小鼠持续输注Exendin-4(GLP-1类似物)4周后,在不影响体重和其他代谢参数的情况下,可以减少新生内膜的形成,而在慢性心力衰竭的小鼠模型中,GLP-1类似物在降低血糖和高胰岛素血症的同时改善心脏结构与功能。临床的一些初步资料也证实了GLP-1可以减少餐后高血糖所引起的内皮功能障碍[15]。在一项大型的回顾性分析中提示使用GLP-1类似物艾塞那肽与其他降糖药物相比可显著降低心血管事件20%[16]。
上述体内及体外实验均证实GLP-1具有心肌保护作用。DPP-4抑制剂通过阻断GLP-1降解可以升高体内GLP-1的水平,起到相似的作用。鉴于实验所用的均是高浓度天然或重组GLP-1类似物,而DPP-4抑制剂只能维持GLP-1浓度在正常生理范围,其作用可能有所不同。另外,DPP-4在许多细胞表面均有表达,例如淋巴细胞、单核细胞且与免疫调节功能相关,其作用底物除了GLP-1之外还包括生长因子、神经肽、血管活性肽等。因此,DPP-4抑制剂显示出优于GLP-1的多效性。目前,有关DPP-4抑制剂心血管保护机制研究发现,DPP-4抑制剂可以抑制SDF-1的降解,增加其浓度,进而促进内皮祖细胞的回巢、活化和增殖,促进血管生成,发挥血管保护效应。并且,Huang[17]等通过给予下肢缺血的小鼠模型西格列汀,证实了DPP-4抑制剂对SDF-1的降解的抑制作用。因此,目前认为DPP-4抑制剂主要是通过抑制GLP-1和SDF-1的降解,促进内皮细胞及祖细胞的增殖,促进血管生成来发挥心血管保护效应。
DPP-4抑制剂对血压的影响。
一项观察西格列汀(40mg/kg,bid)对于自发高血压大鼠血压影响的结果显示,西格列汀组与对照组相比,血压明显下降,收缩压分别是(104±3)mmHg vs (123±5)mmHg(P<0.01),分析西格列汀降低血压的作用,部分是由于其抑制了肾脏近端小管微绒毛上Na/H交换子亚型3(NHE3)的活性及表达,使尿钠排出增加所致[18]。
另一项日本的研究发现,在维持原有的降糖、降压治疗基础上,17例血糖控制不理想的2型糖尿病患者给予西格列汀50mg隔日1次治疗6个月之后,平均收缩压由(130.0±37.2)mmHg降至(119.7±9.4)mmHg,HbA1c由(6.5±0.3)%下降至(5.8±0.3)%,体质指数无变化,然而统计结果显示,HbA1c水平下降与收缩压无显著相关(r=0.24),提示西格列汀降低收缩压并不依赖其降糖作用,另外西格列汀隔日1次与每日1次的降压作用相似。而其降压作用可能与GLP-1能够减少钠盐的摄入及增加尿钠的排出有关[19]。
DPP-4抑制剂对血脂的作用
近期的临床研究提示,DPP-4抑制剂对糖尿病患者的血脂异常有改善作用。Derosa等[20]进行的一项为期2年随机、双盲、对照试验,共纳入205例2型糖尿病患者,随机分成2组,在原有方案基础上,分别加用安慰剂和西格列汀(100mg/d),结果显示西格列汀可明显改善患者的血脂谱,使总胆固醇(TC)、甘油三酯(TG)及低密度脂蛋白胆固醇(LDL-C) 分别降低13.3%、32.3%和20.4%,而高密度脂蛋白胆固醇(HDL-C)增加13.6%。另一项关于DPP-4抑制剂对血脂影响的Meta分析[21]结果显示,DPP-4抑制剂能改善TC和TG,与安慰剂及吡咯列酮相比,DPP-4抑制剂对TC均有降低作用,提示该类药物对改善血脂作用确切,进一步的统计分析结果显示,血脂改善与血糖降低并无相关性,提示DPP-4抑制剂改善血脂作用并不依赖于血糖的降低。Tremblay[22]等进行双盲研究,36例2型糖尿病患者(30例男性,6例绝经后妇女),服用西格列汀100mg/d或者安慰剂各6周后,进行脂质餐负荷试验,结果显示西格列汀治疗组能显著地降低餐后脂蛋白的曲线下面积,载脂蛋白B下降5.1%,同时TG(-9.4%,P=0.006)及LDL-C(-9.3%,P=0.001)均有不同程度下降,另外胰高血糖素(-9.7%,P=0.001)及HOMA胰岛素抵抗指数(-14.6%,P=0.01)也有不同程度下降,而B细胞功能(+32.3%,P=0.007)改善,提示西格列汀可以改善糖尿病患者的血脂谱,同时可改善胰岛素抵抗及胰岛功能。
DPP-4抑制剂对血管内皮细胞的影响
DPP-4在内皮细胞上有表达,尤其是微血管内皮细胞,在高糖的作用下,DPP-4在微血管内皮细胞表达活性增加。近期Shah等[23]试图确定DPP-4抑制剂是否可以通过对内皮细胞的作用影响血管张力,结果发现,DPP-4抑制剂阿格列汀可以使得预收缩的主动脉舒张且呈剂量依赖性。在培养的内皮细胞,阿格列汀增加激活AKT-eNOS的途径和增加NO释放。另有动物研究显示,DPP-4抑制剂DFS(des-fluoro-sitagliptin)通过增加内皮eNOS的磷酸化来改善内皮功能异常并减少动脉粥样硬化病变形成[24]。这些数据表明,DPP-4抑制剂通过一氧化氮系统调节来改善内皮功能进而改善血管张力,进而使心血管受益。
DPP-4抑制剂对于炎症因子的影响
慢性低度炎性在心血管疾病发生中起着关键的作用,炎性进程以及免疫调节机制通过调节动脉粥样硬化斑块的增长导致心肌梗死以及中风的风险。Chun-Yao在糖尿病患者中研究发现,炎症不仅在血管床起着重要作用,而且在脂肪组织以及胰岛中也发挥着重要作用。巨噬细胞中白介素10(IL-10)过表达可以抑制LDL受体缺乏小鼠的动脉粥样硬化,Satoh-Asahara等[25]通过评估48例2型糖尿病患者(非治疗组n=24;西格列汀组n=24),给予西格列汀50mg/d治疗3个月后可以显著降低空腹血糖以及炎症因子如血清淀粉样蛋白A(SAA-LDL)、C-反应蛋白(CRP)、肿瘤坏死因子(TNF-α),另外,可以升高抗炎活性因子IL-10的水平,且多因素统计分析显示,西格列汀是IL-10升高的独立因素(P<0.05),而其他炎症因子的改善则提示与血糖改善有关。由于内脏脂肪增加、脂肪肝均会导致胰岛素敏感性下降和糖代谢异常,上述炎性终点获益也可能得益于DPP-4抑制剂的血糖改善作用。
DPP-4抑制剂心血管安全性前瞻性研究介绍和比较
SAVOR-TIMI 53研究[2]是目前正在进行的一项评估沙格列汀心血管安全性的多中心(25个国家700个中心)、随机、双盲、对照四期临床研究。该研究以期在沙格列汀Ⅱ、Ⅲ期临床研究Meta分析结果显示的其降低心血管风险基础上,进一步评价该药对于心血管的保护作用。该研究共纳入16500例2型糖尿病(HbA1c≥6.5%,均未接受过肠促胰素类降糖药物的治疗)合并心血管高危风险的患者,随机分为安慰剂组和治疗组(沙格列汀5mg/d,中度肾功不全者沙格列汀2.5mg/d),研究持续5年或观察到1040例主要终点事件(包括心血管疾病导致的死亡、非致死性心肌梗死、非致死性中风)。SAVOR-TIMI 53设计严谨,可充分验证沙格列汀与其他安慰剂比较的优越性,并且可以排除其他风险。该研究预计在2015年完成。
EXAMINE研究[3]是一项关于比较阿格列汀与常规治疗对于合并急性冠脉综合征的2型糖尿病患者心血管事件的影响。该研究共纳入5400例2型糖尿病(口服单药或联合治疗者6.5%<HbA1c≤11.0%、使用胰岛素者治疗者7.0%<HbA1c≤9.0%)且近15~90d诊断为急性冠脉综合征的患者,在常规治疗的基础上,随机分为安慰剂组和阿格列汀组(正常以及轻微肾功不全的患者25mg/d,中度肾功不全12.5mg/d,重度肾功不全或终末期肾病患者6.25mg/d),研究持续4.75年。主要终点事件包括:心血管死亡、非致死性心肌梗死、非致死性中风、急性血管重建导致的不稳定性心绞痛。EXAMINE研究预计在2014年完成。
TECOS研究[4]是一项多中心、随机、对照、双盲的大型临床研究,旨在评价西格列汀心血管方面的安全性。TECOS研究共纳入14000名2型糖尿病患者,入组条件为年龄≥50岁,既往有心、脑、外周血管疾病病史,使用单药或多药如双胍类药物、磺脲类药物、噻唑烷二酮类药物联合降糖治疗血糖控制不理想,HbA1c在6.5%~8.0%。在原有降糖方案基础上,随机分为安慰剂组和西格列汀组(100mg/d、中度肾功不全者50mg/d)。本研究计划治疗并随访约5年,直到观察到1300例主要心血管事件发生,包括心血管死亡、非致死性心肌梗死、非致死性中风、需住院治疗的不稳定心绞痛。TECOS研究预计在2014年12月完成。
CAROLINA研究[5]是一项多中心随机、对照、双盲研究,旨在比较Linagliptin和格列美脲对于伴心血管高危风险的2型糖尿病患者心血管方面的安全性。研究共纳入6000例既往有心血管疾病史的2型糖尿病患者或具有糖尿病大血管病变的2型糖尿病患者,年龄大于70岁或具有2种或2种以上心血管风险因素。主要终点事件包括:心血管死亡、非致死性心肌梗死、非致死性中风、急性血管重建导致的不稳定性心绞痛。该试验预计在2018年结束。
总 结
糖尿病一直被视为冠心病的“等危症”。糖尿病患者除高血糖外,常存在慢性炎症状态、氧化应激、内皮功能障碍等,加之常合并高血压及血脂紊乱,易共同导致心血管疾病及发生心血管事件。因此,降糖的同时降低心血管疾病发生风险,是目前糖尿病治疗的重要目标。DPP-4抑制剂作为一类具有新型作用机制的降糖药物,其肯定的降糖疗效以及良好的耐受性,在临床上获得日益广泛的应用。近年来,关于DPP-4抑制剂的体内外试验以及临床前研究均提示该类药物通过抗炎、改善血管内皮功能、降压、调脂等环节共同发挥心血管保护作用,但由于DPP-4抑制剂在临床使用时间尚短,其确切的心血管保护作用及其机制有待于进一步研究。目前已有多项专门针对DPP-4抑制剂心血管安全性的大型前瞻性研究正在进行中,其结果必将为DPP-4抑制剂的心血管保护作用提供更加充分的循证医学证据。
[1] Aroda VR, Henry RR, Han J, et al.Efficacy of GLP-1 agonists and DPP-4 inhibitors:meta-analysis and systematic review[J].Clin Ther, 2012, 34(6):1247-1258.
[2] Scirica BM, Bhatt DL, Braunwald E, et al.The design and rationale of the saxagliptin assessment of vascular outcomes recorded in patients with diabetes mellitus-thrombolysis in myocardial infarction (SAVORTIMI) 53 study[J].Am Heart J, 2011, 162(5):818-825.
[3] White WB, Bakris GL, Bergenstal RM, et al.EXamination of cArdiovascular outcoMes with alogliptIN versus standard of carE in patients with type 2 diabetes mellitus and acute coronary syndrome (EXAMINE):a cardiovascular safety study of the dipeptidyl peptidase 4 inhibitor alogliptin in patients with type 2 diabetes with acute coronary syndrome[J].Am Heart J, 2011, 162(4):620-626.
[4] Ethel MA, Green J, Califf RM, et al.Rationale and Design of the Trial Evaluating Cardiovascular Outcomes with Sitagliptin(TECOS)[J].Diabetes, 2009, 58(Suppl 1):A639.
[5] CAROLINA:Cardiovascular Outcome Study of Linagliptin Versus Glimepiride in Patients With Type 2 Diabetes NLMIdentifier:NCT01243424.
[6] Williams-Herman D, Johnson J, Teng R, et al.Efficacy and safety of initial combination therapy with sitagliptin and metformin in patients with type 2 diabetes:a 54-week study[J].Curr Med Res Opin, 2009, 25(3):569-583.
[7] Yang W, Guan Y, Shentu Y, et al.The addition of sitagliptin to ongoing metformin therapy significantly improves glycemic control in Chinese patients with type 2 diabetes[J].Diabetes, 2012, 4(3):227-237.
[8] Yoon KH, Steinberg H, Teng R, et al.Efficacy and safety of initial combination therapy with sitagliptin and pioglitazone in patients with type 2 diabetes:a 54-week study[J].Diabetes Obes Metab, 2012, 14(8):745-752.
[9] Taskinen MR, Rosenstock J, Tamminen I, et al.Safety and efficacy of Linagliptin as add-on therapy to metformin in patients with type 2 diabetes:a randomized, double-blind, placebo-controlled study[J].Diabetes Obes Metab, 2011, 13(1):65-74.
[10] Cai L, Cai Y, Lu ZJ, et al.The efficacy and safety of vildagliptin in patients with type 2 diabetes:a meta-analysis of randomized clinical trails[J].Clin Pharm Ther, 2012, 37(4):386-398.
[11] Karaglannis T, Paschos P, Paletas K, et al.Dipeptidyl peptidase-4 inhibitors for treatment of type 2 diabetes mellitus in the clinical setting:systematic review and meta-analysis [J].Bri Med J, 2012, 344:el369.
[12] Cobble ME, Frederich R.Saxagliptin for the treatment of type 2 diabetes mellitus:assessing cardiovascular data[J].Cardiovasc Diabetol, 2012, 11:6.
[13] Johansen OE, Neubacher D, von Evnatten M, et al.Cardivasular safety with Linagliptin in patients with type 2 diabetes mellitus:a pre-specified prospective, and adjudicated meta-analysis of phase 3 programme[J].Cardivasc Diabetol, 2012, 11:3.
[14] Goto H, Nomiyama T, Mita T, et al.Exendin-4, a glucagon-like peptide-1 receptor agonist, reduces intimal thickening after vascular injury[J].Biochem Biophys Res Commun, 2011, 405(1):79-84.
[15] Ceriello A, EspositoK, Testa R, et al.The possible protective role of Glucagon-Like Peptide1on Endothelium during the mealand evidence for an “endothelial resistance” to Glucagon-Like Peptide 1 in diabetes[J].Diabetes Care, 2011, 34(3):697-702.
[16] Best JH, Hoogwerf BJ, HermanWH, et al.Risk of cardiovascular disease events in patients with type 2 diabetes prescribed the glucagonlike peptide 1 (GLP-1) receptor agonist exenatide twice daily or other glucose-lowering therapies:a retrospective analysis of the Lifelink database[J].Diabetes Care, 2011, 34(1):90-95.
[17] Huang CY, Shih CM, Tsao NW, et al.Dipeptidyl peptidase-4 inhibitor improves neovascularization by increasing circulating endothelial progenitor cells[J].Bri;J Pharmacol, 2012, 167(7):1506-1519.
[18] Pacheco BP, Crajoinas RO, Couto GK, et al.Dipetidyl peptidase Ⅳattenuates blood pressure rising in young spontaneously hypertensive rats[J].J hypertens, 2011, 29(3):520-528.
[19] Ogawa S, Ishiki M, Nako K, et al.Sitagliptin, a dipeptidyl peptidase-4 inhibitor, decreases systolic blood pressure in Japanese hypertensive patients with type 2 diabetes[J].Ohoku J Exp Med, 2011, 223(2):133-135.
[20] Derosa G, Ragonesi PD, Fogari E, et al.Sitagliptin added to previously taken antidiabetic agents on insulin resistance and lipid profile:a 2-year study evaluation[J].Fundam Clin Pharmacol, 2012 Sep 11.doi:10.1111/fcp.12001.
[21] Monami M, Lamanna C, Desideri CM, et al.DPP-4 inhibitors and lipids:systematic review and meta-analysis[J].Adv Ther, 2012, 29(1):14-25.
[22] Tremblay AJ, Lamarche B, Deacon CF, et al.Effect of sitagliptin therapy on postprandial lipoprotein levels in patients with type 2 diabetes[J].Diabetes Obes Metab, 2011, 13(4):366-373.
[23] Shah Z, Pineda C, Kampfrath T, et al.Acute DPP-4 inhibition modulates vascular tone through GLP-1 independent pathways.Vascul.Pharmacol[J].Vascul Pharmacol, 2011, 55(1-3):2-9.
[24] Matsubara J, Sugiyama S, Sugamura K, et al.A dipeptidyl peptidase-4 inhibitor, des-fluoro-sitagliptin, improves endothelial function and reduces atherosclerotic lesion formation in apolipoprotein E-deficient mice[J].J Am Coll Cardiol, 2012, 59(3):265-276.
[25] Satoh-Asahara N, Sasaki Y, Wada H, et al.A dipeptidyl peptidase-4 inhibitor, sitagliptin, exerts anti-inflammatory effects in type 2 diabetic patients[J].Metabolism, 2012 Oct 10.pii:S0026-0495(12)00343-5.