芍药苷通过调节前列腺素E2受体抑制大鼠成纤维滑膜细胞增殖
2012-12-06汪庆童马昱琨
汪庆童,马昱琨,黄 蓓,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药理学省部共建教育部重点实验室,安徽合肥 230032)
滑膜炎是类风湿关节炎(rheumatoid arthritis,RA)这一自身免疫性关节疾病的特征性病理表现,其中成纤维样滑膜细胞(fibroblast-like synoviocyte,FLS)异常增殖活化[1-2]。前列腺素 E2(prostaglandin E2,PGE2)通过受体 EP(E-prostanoid)2和 EP4介导兴奋性G蛋白(stimulatory G protein,Gs)信号通路调节细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)水平和DNA合成而发挥致炎作用,是滑膜细胞活化导致滑膜炎的重要病理机制之一[3-4]。课题组研究发现,临床使用的天然药物白芍总苷(total glucosides of paeony,TGP),其活性单体为芍药苷(paeoniflorin,Pae),可以降低胶原性关节炎(collagen-induced arthritis,CIA)大鼠滑膜细胞中抑制性G蛋白(inhibitory G protein,Gi)的表达,恢复cAMP水平和蛋白激酶A(protein kinase A,PKA)活性[5]。本研究在以往工作的基础上,从调节EP2受体及信号通路的角度,观察Pae抑制PGE2诱导的大鼠FLS异常增殖的分子机制。
1 材料与方法
1.1 动物 Sprague-Dawley(SD)大鼠,体质量(120±20)g,♂,由安徽医科大学动物实验中心提供,合格证号:皖医实动准字第01号。
1.2 主要试剂 Pae,白色粉末,由安徽医科大学临床药理研究所化学室提供,高效液相法测纯度>95%(LC-10AD高效液相色谱仪,日本);氚标记的胸腺嘧啶核苷(3H-TdR)购于中国科学院上海应用物理研究所;兔抗大鼠β-arrestin 2和EP2一抗,小鼠抗大鼠β-actin一抗,辣根过氧化酶标记的山羊抗兔IgG抗体和免抗鼠IgG抗体均购于Santa Cruz公司;cAMP放免检测试剂盒为北京华英生物技术研究所产品。
1.3 FLS的分离培养 大鼠处死后,置于0.1%新洁尔灭液中浸泡15 min,于膝关节正中纵行切开皮肤,分离肌肉,露出膝盖骨,继续向下分离,可见平滑光亮的滑膜组织。用手术刀分离关节囊的滑膜层和纤维层,然后取出滑膜层组织。去除脂肪、纤维等,用D-Hank's液(无 Ca2+、Mg2+,含青霉素200 kU·L-1、链霉素 200 mg·L-1)反复冲洗后剪成 1 ~2 mm3小块,用玻璃吸管吸取均匀排列于培养瓶(预先用含20%胎牛血清DMEM培养液湿润)的底壁,瓶底朝上,37℃、5%CO2培养箱中培养6 h,使其贴壁。再轻轻翻转培养瓶,使培养液刚刚覆盖组织块,每隔2~3天换一次培养液,观察到有大量成纤维细胞长出后轻轻去除组织块,继续培养,待细胞快长满时用0.25%胰蛋白酶消化细胞并传代培养,取第3~5代细胞用于实验。
1.4 FLS增殖反应 将培养得到的FLS分为正常组、PGE2125 μg·L-1刺激组及 PGE2刺激 +Pae 1、10、100 nmol·L-1,1、10 μmol·L-1给药组,作用 24 h。采用3H-TdR参入法,终止培养前6 h每孔加入20 μl3H-TdR,培养结束后收集细胞,用液闪仪(LS6500液体闪烁计数仪,Beckman公司)测其放射性,结果以3个复孔cpm的均值表示。
1.5 FLS内cAMP浓度检测 取第3代FLS,每孔1×109cells·L-1接种于24孔板,给药后培养24 h,PBS洗涤细胞1次,每孔加50 mmol·L-1醋酸缓冲液1 ml终止反应,用枪头将孔底细胞刮下,移入1.5 ml eppendorf管,细胞超声破碎,4℃ 1 200×g离心5 min,取上清液,-20℃保存,按照125I cAMP放免试剂盒说明书进行,使用γ-911全自动放免计数仪(中国科技大学实业总公司生产)测定。
1.6 流式细胞术检测FLS细胞表面EP2的表达细胞给药处理后,PBS洗涤细胞1次,0.25%胰蛋白酶消化细胞,PBS洗涤1次后用4%多聚甲醛室温固定 40 min,2 000 r·min-1离心 10 min,去上清后,用含0.5%牛血清白蛋白(bovine serum albumin,BSA)的PBS重悬细胞,加入兔源性抗EP2受体一抗(1∶50),37℃孵育30 min,离心去上清重悬沉淀,加FITC标记的羊抗兔二抗(1∶200)37℃避光孵育20 min,网纱过滤后用流式细胞仪(Beckman FC500)检测。
1.7 Western blot法检测 β-arrestin 2胞膜和总表达以及EP2的总表达 取第3代FLS,每孔1×109cells·L-1接种于6孔板,各组给药后培养24 h,加入RIPA裂解液后超声降解,提取总蛋白,100 000 r·min-1离心1 h,沉淀物为胞膜蛋白,用裂解液溶解,加入上样缓冲液煮沸变性后进行SDS-PAGE电泳(5%的浓缩胶和10%的分离胶),转膜,5%的脱脂奶粉37℃封闭2 h,加抗β-arrestin 2或EP2(1∶1 000)抗体,内参用β-actin单克隆抗体,4℃孵育过夜,洗膜,加辣根过氧化物酶标记的相应二抗(1∶30 000)37℃孵育2 h,ECL法显影,分析条带灰度值。实验重复3次,以目的条带与β-actin条带的灰度比值来表示蛋白相对表达量。
2 结果
2.1 Pae抑制PGE2诱导的大鼠FLS异常增殖对不同浓度 PGE2(1、5、25、125、615 μg·L-1)作用不同时间(12、24、36、48、60 h)诱导 FLS 的增殖预实验结果提示,PGE2125 μg·L-1为刺激的亚适浓度,24 h为最适时间,这一条件用于本实验。第3代大鼠 FLS 体外用 PGE2125 μg·L-1刺激,同时加入不同浓度的 Pae,培养24 h,3H-TdR参入法检测 FLS的增殖能力。从Fig 1中可以看出,PGE2明显促进FLS 的增殖(P<0.01),Pae 10、100 nmol·L-1,1、10 μmol·L-1不同程度抑制FLS的增殖。

Fig 1 Effect of Pae on proliferation of PGE2-induced rat FLS(±s,n=5)
2.2 Pae恢复PGE2降低的FLS内cAMP浓度用放免法检测各
组FLS内cAMP水平,如Fig 2所示,PGE2作用24 h后降低了细胞内的cAMP浓度,Pae体外给药可以逐步升高cAMP浓度,其中Pae 100 nmol·L-1,1、10 μmol·L-1对 cAMP 水平有明显影响(P<0.05或P<0.01)。
2.3 Pae对细胞膜EP2受体表达的影响 采用流式细胞术检测不同浓度Pae对PGE2作用下FLS细胞膜EP2受体表达情况(Fig 3A~E),去除非特异性染色后,比较X轴平均荧光强度的变化(Fig 3F)。统计发现,正常大鼠FLS细胞膜上EP2受体的平均荧光强度为23.33±4.54,PGE2作用24 h后,EP2胞膜表达降低(15.23±1.30,与正常组比较P<0.01),Pae不同浓度体外给药升高EP2的胞膜表达(Pae 1 μmol·L-1为 19.73 ± 1.70,Pae 10 μmol·L-1为20.20 ±2.23)。

Fig 2 Effect of Pae on cAMP concerntration in PGE2-induced rat FLS(±s,n=5)
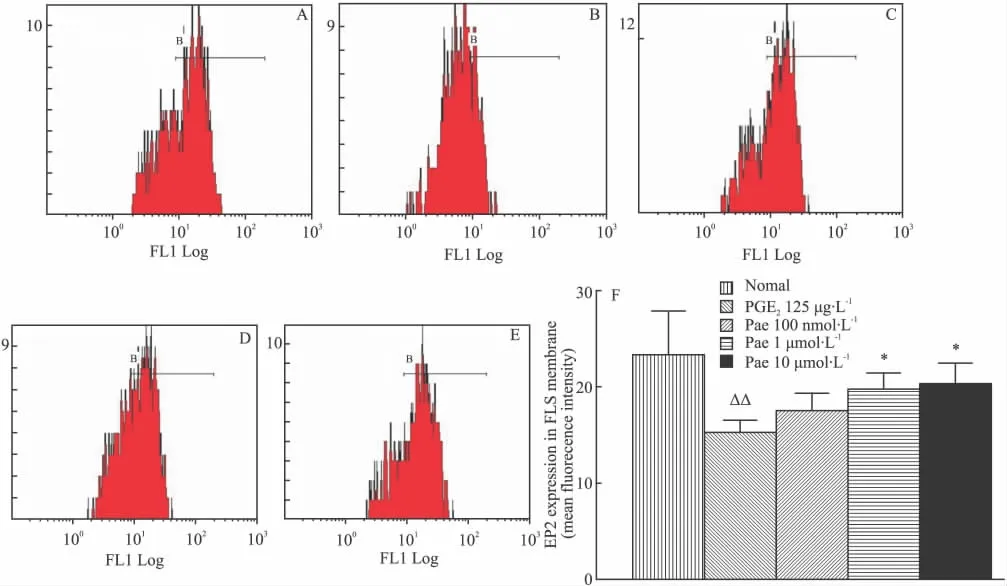
Fig 3 Effect of Pae on membrane EP2 expression in rat FLS treated by PGE2( ± s,n=4)
2.4 Pae对PGE2诱导的大鼠FLS总β-arrestin 2和EP2以及胞膜β-arrestin 2表达的影响 大鼠FLS裂解后经超速离心,分离出胞膜蛋白,Western blot法检测细胞胞膜和总蛋白的表达情况,结果显示PGE2作用下,FLS总β-arrestin 2、EP2以及胞膜β-arrestin 2 表达均升高,Pae 1、10 μmol·L-1可明显降低细胞总EP2和β-arrestin 2的表达,Pae 3个浓度可不同程度抑制胞膜β-arrestin 2表达。

Fig 4 Effect of Pae on membrane β-arrestin 2,total EP2 and β-arrestin 2 expression in rat FLS treated by PGE2(±s,n=3)
3 讨论
滑膜炎中FLS异常增殖活化,随之形成血管翳,逐渐向关节面和关节软骨扩散、侵蚀,并最终破坏关节软骨和软骨下骨,使关节畸形而失去功能[6]。多种信号转导参与了FLS的异常增殖,研究发现,作为最大受体超家族的G蛋白偶联受体(G protein-coupled receptors,GPCRs)介导的信号通路在RA FLS过度增殖中发挥了重要的作用。关节炎动物模型的FLS存在G蛋白的含量变化和功能障碍,cAMP水平和PKA活性降低[7]。EP2和EP4是表达于滑膜细胞膜上的重要GPCRs,均与Gs蛋白偶联[4]。本课题组研究发现,佐剂性关节炎(adjuvantinduced arthritis,AA)大鼠FLS的EP2受体表达升高[7],但为何细胞内cAMP水平和PKA活性反而降低?本实验发现PGE2诱导的大鼠FLS总EP2蛋白表达升高,与前期研究一致,但细胞膜EP2受体表达水平低于正常细胞,导致对Gs信号激活减弱,cAMP产生减少。
活化的FLS细胞膜EP2受体为何减少?我们检测了GPCRs重要的负调节因子之一β-arrestin 2。β-arrestin与GPCRs激酶(G-protein-coupled receptor kinases,GRKs)联合作用,通过介导受体脱敏和内吞,对大部分GPCRs信号转导通路具有重要的负调节作用[8]。当GPCRs被激活后,β-arrestin转移到细胞膜,结合到被激动剂占领的受体上,促使这些受体与G蛋白分离,从而导致受体脱敏。活化的β-arrestin分子释放出C末端,与胞内小泡表面的网格蛋白(clathrin)结合,介导 GPCRs的内吞。β-arrestin可以调节内吞后GPCRs的运输模式,在GPCRs循环中起到了特别的作用[9]。β-arrestin有 β-arrestin 1和2两个亚型,广泛的存在于各种细胞中。β-arrestin 1还可以进入细胞核内直接或间接影响一些转录因子,在基因表达调控上发挥更多的功能,βarrestin 2主要介导受体的调节和信号转导[10]。CIA大鼠滑膜细胞β-arrestin 1,2表达的增高与病程一致,在关节炎症高峰期表达最高,TGP体内给药抑制FLS中 β-arrestin 1,2 的表达水平[11]。本实验进一步发现活化的FLS总β-arrestin 2和胞膜β-arrestin 2表达均升高,提示在PGE2刺激下,由于β-arrestin 2产生和募集到胞膜上的量增多,介导了EP2受体的内吞,从而降低了Gs下游信号分子cAMP的水平,引起FLS异常增殖。
目前RA的治疗效果仍不尽人意,天然药物因疗效肯定,不良反应少显示出了广阔的应用前景。白芍总苷(total glucosides of paeony,TGP)已经作为一个抗炎免疫调节药被正式批准生产上市,用于治疗RA等疾病。前期研究发现,TGP的主要有效成分Pae可以升高cAMP水平和PKA活性,改善滑膜细胞功能[12-13]。本实验观察到Pae通过减少细胞膜β-arrestin 2的富集,升高细胞膜EP2受体水平,改善Gs信号通路,从而提高FLS内cAMP水平,抑制PGE2刺激下FLS的过度增殖,这一分子机制可能部分解释Pae发挥作用的分子机制。然而,Pae如何影响到细胞内的β-arrestin 2,进而发挥调节细胞表面GPCRs数量和活性的作用,仍需进一步阐明。
[1]Chihara H,Hino M,Makizono T,et al.Inhibitory effects of hybrid liposomes on the growth of synoviocyte causing rheumatoid arthritis[J].Bioorg Med Chem Lett,2011,21(1):207-10.
[2]Wang Q T,Ma Y K,Liu D D,et al.The roles of B cells and their interactions with fibroblast-like synoviocytes in pathogenesis of rheumatoid arthritis[J].Int Arch Allergy Imm,2011,155:205-11.
[3]McCoy J M,Wicks J R,Audoly L P.The role of prostaglandin E2receptors in the pathogenesis of rheumatoid arthritis[J].J Clin Invest,2002,110(5):651-8.
[4]Kunisch E,Jansen A,Kojima F,et al.Prostaglandin E2differentially modulates proinflammatory/prodestructive effects of TNF-alpha on synovial fibroblasts via specific E prostanoid receptors/cAMP[J].J Immunol,2009,183(2):1328-36.
[5]张玲玲,魏 伟,汪庆童,等.芍药苷对胶原性关节炎大鼠滑膜细胞G蛋白偶联信号的调节作用[J].中国药理学通报,2008,24(3):330-5.
[5]Zhang L L,Wei W,Wang Q T,et al.Regulatory effects of Paeoniflorin on G protein-coupled signaling of synoviocytes in collagen-induced arthritis rats[J].Chin Pharmacol Bull,2008,24(3):330-5.
[6]Wang Q T,Ma Y K,Liu D D,et al.The roles of B cells and their interactions with fibroblast-like synoviocytes in pathogenesis of rheumatoid arthritis[J].Int Arch Allergy Imm,2011,155:205-11.
[7]Xu H M,Wei W,Jia X Y,et al.Effects and mechanisms of total glucosides of paeony on adjuvant arthritis in rats[J].J Ethnopharmacol,2007,109(3):442-8.
[8]Eric R,Robert J L.GRKs and β-arrestins:roles in receptor silencing,trafficking and signaling[J].Trends Endocrinol Metab,2006,17(4):159-65.
[9]Wolfe B L,Trejo J.Clathrin-dependent mechanisms of G proteincoupled receptor endocytosis[J].Traffic,2007,8(5):462-70.
[10]Mo W,Zhang L,Yang G,et al.Nuclear beta-arrestin 1 functions as a scaffold for the dephosphorylation of STAT 1 and moderates the antiviral activity of IFN-gamma[J].Mol Cell,2008,31(5):695-707.
[11]Wang Q T,Zhang L L,Wu H X,et al.The expression change of βarrestins in fibroblast-like synoviocytes from rats with collagen-induced arthritis and the effect of total glucosides of paeony[J].J Ethnopharmacol,2011,133(2):511-6.
[12]张玲玲,魏 伟.针对类风湿关节炎分子靶点的治疗药物研究进展[J].中国药理学通报,2006,22(11):1291-6.
[12]Zhang L L,Wei W.Study of therapeutic drugs on molecular targets in rheumatoid arthritis[J].Chin Pharmacol Bull,2006,22(11):1291-6.
[13]常 艳,魏 伟,张 磊,徐红梅.白芍总苷对IL-1α诱导胶原性关节炎大鼠成纤维样滑膜细胞功能的影响[J].中国药理学通报,2007,23(2):185-8.
[13]Chang Y,Wei W,Zhang L,Xu H M.Effects of TGP on functions of fibroblast-like synoviocytes under the stimulation of IL-α in CIA rats[J].Chin Pharmacol Bull,2007,23(2):185- 8.
