(Ni-Mo)/TiO2纳米薄膜光催化降解刚果红的性能与机理
2012-12-05李爱昌李桂花冯玲玲郑彦俊
李爱昌 李桂花 郑 琰 冯玲玲 郑彦俊
(廊坊师范学院化学与材料科学学院,河北廊坊065000)
(Ni-Mo)/TiO2纳米薄膜光催化降解刚果红的性能与机理
李爱昌*李桂花 郑 琰 冯玲玲 郑彦俊
(廊坊师范学院化学与材料科学学院,河北廊坊065000)
用恒电流复合电沉积方法制备(Ni-Mo)/TiO2薄膜,以扫描电子显微镜(SEM)、X射线衍射(XRD)、拉曼(Raman)光谱和紫外-可见漫反射光谱(UV-Vis DRS)对薄膜的表面形貌、晶相结构和光谱特性进行了表征,以刚果红为模拟污染物对薄膜的光催化性能进行了测定,并讨论了刚果红溶液的pH值对薄膜光催化活性的影响.采用循环伏安技术和向溶液中加入活性物种捕获剂的方法对薄膜光催化降解机理进行了探索.结果表明: (Ni-Mo)/TiO2薄膜是由粒径为50-100 nm TiO2纳米粒子相和纳米晶Ni-Mo固溶体相构成的复合薄膜.薄膜具有较高的光催化活性,卤钨灯照射80 min后,复合薄膜光催化刚果红的降解率是多孔TiO2(Degussa P25)/ ITO(氧化铟锡)纳米薄膜的2.43倍.(Ni-Mo)/TiO2薄膜光催化活性的提高主要归因于薄膜层中有效形成的(Ni-Mo)/TiO2异质结和良好的电子通道,以及Ni-Mo纳米晶合金对溶解氧和激发电子还原反应的催化作用.分别给出了在紫外和可见光下薄膜光催化降解刚果红的反应机理.
光催化;(Ni-Mo)/TiO2纳米膜;复合电沉积;刚果红;反应机理
1 引言
近些年来,半导体光催化降解水中污染物备受人们关注.1-3与传统技术相比,这种深度氧化的光催化技术具有成本低、矿化率高、二次污染少等优势,有望成为下一代环保新技术.4
在众多的半导体光催化剂中,TiO2纳米粒子以光稳定性好、高效性、无毒和廉价备受人们的青睐.为了使光催化处理后的TiO2与水分离和回收再利用,当前人们多采用负载型催化剂,特别是薄膜(层)负载型光催化剂.5为提高催化效率,使这一技术能够实用化,需要对负载型光催化剂进行修饰改性,常见的有金属沉积、金属和非金属离子掺杂、复合半导体及染料敏化修饰等,其中金属沉积是最为行之有效的方法之一.6多数研究者在纳米TiO2薄膜表面沉积贵金属,如Au、Pt、Ag、Pd等.7,8最近出现以过渡金属Ni修饰TiO2的报道.9为了进一步提高光量子产率,人们从开始的纯TiO2纳米粒子薄膜研制及其表面修饰逐步转向复合薄膜的制备,从而使对TiO2薄膜的修饰由表面发展到膜内.Hosseini等10把银纤维固定在不锈钢基片上,用电泳法制备了TiO2(质量分数为11%)含银薄膜,并研究了光催化亚甲基蓝的性能.更多的文献以非金属碳11(活性碳或碳纳米管)和金属镍作为复合物制备TiO2复合薄膜.9,12
本工作以复合电沉积方法制备(Ni-Mo)/TiO2纳米薄膜光催化剂,以刚果红为模拟污染物研究薄膜的光催化性能和反应机理,旨在高效负载型光催化剂制备与光催化污染物机理方面进行有益探索,此类薄膜光催化剂在国内外鲜见报道.
2 实验
2.1 (Ni-Mo)/TiO2复合薄膜的制备
实验所用原料为TiO2纳米粉(德国Degussa P25,80%锐钛矿相,20%金红石相)、分析纯的NiSO4·6H2O(纯度98.5%)、Na2MoO4·2H2O(纯度99%)、Na3C6H5O7·2H2O(纯度99%)和NH3·H2O(纯度25%-28%)化学试剂.
用上述试剂制备镀液,13镀液的组成为:NiSO4· 6H2O 79 g·L-1;Na2MoO4·2H2O 48 g·L-1;Na3C6H5O7· 2H2O 88 g·L-1;氨水适量.随后在镀液中加入一定量的TiO2纳米粉制成悬浮液.将悬浮液超声处理20 min,继之以氨水和稀硫酸调节其pH值为10.5.将300 mL悬浮液注入自制的恒温镀槽中,镀液的温度由501A型超级数显恒温水浴(上海浦东荣丰科学仪器公司)控制,以JWL-30III型直流稳流器(上海第二电表厂)为电源,采用恒电流沉积.沉积过程中用S212-90C型恒速搅拌器(上海豫康科教有限公司)搅拌,使TiO2微粒均匀悬浮于镀液中.不锈钢板(8cm× 6 cm)作阳极,紫铜片(1cm×2 cm)作阴极,阴极非工作面用绝缘胶带封固,两极之间的距离为5 cm,电沉积时间为15 min,其它实验参数为:电流密度95 mA·cm-2;镀液温度25°C;pH值10.5;搅拌速率360 r·min-1,TiO2在镀液中的悬浮量6.0 g·L-1.所制薄膜不进行后处理.以质量法测定薄膜的厚度为13.2 μm.
2.2 多孔TiO2/ITO薄膜的制备
为了说明(Ni-Mo)/TiO2薄膜的光催化性能,在最佳工艺条件下制备多孔P25 TiO2/ITO(氧化铟锡)纳米薄膜,14以作比较.制备过程为:把4.5 g P25 TiO2纳米粉加入到150 mL二次蒸馏水中,加入0.188 g聚乙二醇(相对分子质量为800)粘合剂,在200 W超声波中处理1.5 h,此为涂敷液.将导电玻璃ITO(15 Ω·□-1,深圳市三信达公司)放入涂敷液中,用提拉法制备薄膜,提拉速率为2 mm·s-1.湿膜在空气中自然晾干,重复涂敷4次,最后放在450°C的转管式电阻炉中(天津实验电炉厂)保温1h,自然冷却至室温.按质量法测定薄膜的厚度为0.5 μm.该厚度为薄膜最佳厚度,超过此厚度光催化活性随厚度的增加而降低.这个结果与文献15报道的对于厚度小于1 μm的锐钛矿薄膜,光催化的活性随厚度增加而增大不同.这可能与薄膜的制备方法不同有关.由于薄膜厚度的变化不仅会使与光有效作用的催化剂数量发生改变(当薄膜厚度小于光照有效厚度时),而且也会引起薄膜表面状态和表面积的变化,因而会引起光催化性能的变化.
2.3 薄膜表征
用德国LEO公司生产的1530型热场发射扫描电镜(SEM)观察薄膜的表面形貌.用英国Oxford 7426型能谱仪(EDS)测定薄膜表面的组成.用日本理学产D/max-RB型X射线衍射仪(XRD)分析薄膜的结构,CuKα辐射,掠角为3°.用日本JASCO公司生产的V-570型紫外-可见-近红外分光光度计测定紫外-可见漫反射(UV-Vis DRS)光谱.用英国Renishaw公司生产的inVia型拉曼光谱仪测定薄膜的拉曼光谱,激发波长514 nm.
2.4 光催化实验
室温(25°C)下,将14 mL浓度为5.0 mg·L-1(7.18×10-6mol·L-1)、pH=3.5的刚果红溶液注入带有封盖的硬质试管(7 cm×2 cm)内,将1片尺寸为1 cm×2 cm的(Ni-Mo)/TiO2薄膜(或TiO2/ITO薄膜)浸入溶液中并使其保持垂直状态.用150 W卤钨灯为光源进行照射,薄膜与光源距离为18.5 cm,氧气流量为40 mL·min-1.每隔一定时间用721型分光光度计(上海第三分析仪器厂)在最大可见光吸收波长下测定刚果红溶液的吸光度,并以此计算刚果红的降解率.
3 结果与讨论
3.1 薄膜组成及SEM、XRD表征
图1是电沉积时间为15 min、TiO2在镀液中的悬浮量为6.0 g·L-1所制复合薄膜表面形貌的SEM照片.由图可以看出:(Ni-Mo)/TiO2为多孔薄膜,表面由大小不等的微粒构成,其中白色虫卵状小颗粒为TiO2,粒径大部分为50-100 nm,较大的球状颗粒为掺杂TiO2的Ni-Mo微晶,粒径多数在0.2-0.5 μm之间.TiO2纳米粒子均匀镶嵌在薄膜表面,其裸露部分约占薄膜总面积的40%左右.
能谱分析表明,(Ni-Mo)/TiO2复合薄膜中Mo在Ni-Mo基质合金中所占质量分数为15.42%,这与文献13中制备的Ni-Mo合金镀层的Mo含量基本一致.这说明在Ni-Mo合金中引入TiO2微粒,并未改变其化学组成.将Ti折算为TiO2,得到复合薄膜中TiO2所占的体积分数为13.91%.

图1 (Ni-Mo)/TiO2薄膜的SEM照片Fig.1 Scanning electron microscopy(SEM)photograph of(Ni-Mo)/TiO2thin film
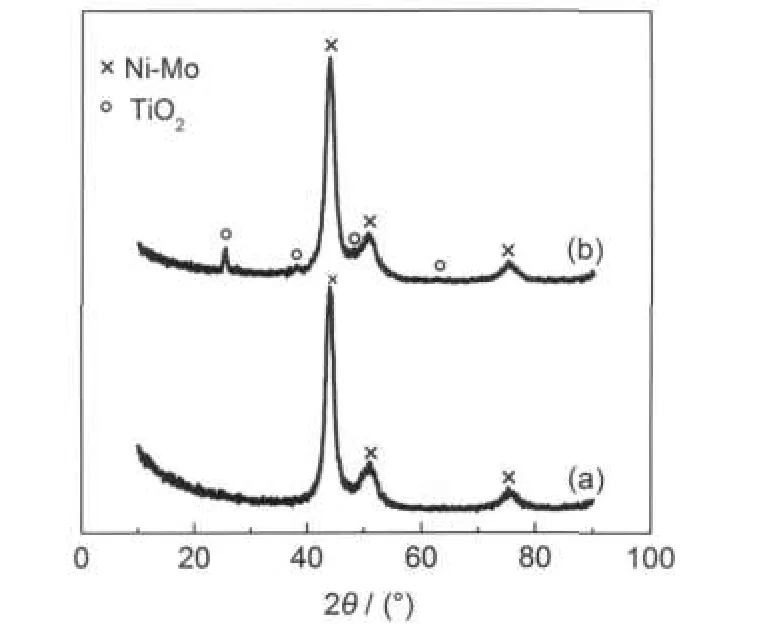
图2 Ni-Mo(a)和(Ni-Mo)/TiO2(b)薄膜的XRD谱图Fig.2 XRD spectra of Ni-Mo(a)and(Ni-Mo)/TiO2(b) thin films
图2是(Ni-Mo)/TiO2复合薄膜的XRD谱.为了便于比较,图中给出了Ni-Mo合金薄膜的谱图. Ni-Mo合金的制备除镀液中不加TiO2微粒外,其余制备条件与(Ni-Mo)/TiO2复合薄膜相同(见2.1节).由图2可见,(Ni-Mo)/TiO2复合薄膜在2θ为25.41°、38.03°、48.23°和62.68°处出现锐钛矿TiO2的第1-4衍射峰,其它3个峰的峰位与Ni-Mo合金完全相同,这表明TiO2微粒的引入并没有改变Ni-Mo合金的晶相结构.另外谱图中未见金红石相衍射峰,这也许是其含量低的缘故.Ni-Mo合金薄膜的3个强衍射峰分别出现在43.83°、51.25°和75.31°处,这与文献16的数值相近,考虑到Ni(PDF-040850)的3个强衍射峰位(2θ=44.51°、51.85°、76.37°),并且图2中未出现Mo及其化合物的峰位,可以确定Ni-Mo合金是以Ni为溶剂,Mo为溶质的置换型固溶体合金.16
依据Ni-Mo合金薄膜和(Ni-Mo)/TiO2复合薄膜最强衍射峰,用Scherrer公式17计算晶粒平均尺寸,结果完全相同,均为4.8 nm.由此可见,(Ni-Mo)/TiO2薄膜是由纳米TiO2粒子相与平均尺寸为4.8 nm的纳米晶Ni-Mo固溶体合金相构成的复合薄膜.
3.2 薄膜的拉曼光谱和紫外-可见漫反射光谱结果
图3是(Ni-Mo)/TiO2薄膜和P25纳米TiO2/ITO薄膜的拉曼光谱图.由图可见,每个薄膜均有6个拉曼峰,其中有5个峰的拉曼位移两薄膜对应相同,它们分别是143.45、195.20、395.43、513.88、636.68 cm-1,这是TiO2锐钛矿相的拉曼峰.18另外的一个拉曼峰两薄膜峰位接近,(Ni-Mo)/TiO2薄膜和P25纳米TiO2/ITO薄膜拉曼位移分别是449.36和447.19 cm-1,是TiO2金红石相的拉曼峰.此外,在143.45 cm-1处附近金红石相也有较强的拉曼散射,故此峰也有金红石相的贡献.18由图还可以看出,两薄膜的峰宽基本相同.(Ni-Mo)/TiO2薄膜的拉曼散射强度明显小于TiO2/ITO薄膜,这是复合薄膜TiO2含量低于纯TiO2薄膜的缘故.由上述数据可知,在(Ni-Mo)/ TiO2复合薄膜中,TiO2纳米微粒的晶相结构、原子的空间排布及其相互作用并未受到基质Ni-Mo合金明显的作用.

图3 薄膜的Raman光谱Fig.3 Raman spectra of thin films
图4是TiO2/ITO和(Ni-Mo)/TiO2薄膜的UV-Vis漫反射光谱.图中TiO2/ITO薄膜的光谱与文献19相近.由图可见,两薄膜的光吸收阈值相同.在紫外光区域,(Ni-Mo)/TiO2薄膜的吸光强度小于TiO2/ITO薄膜,前者与后者之比约为75%左右.在可见光区域,(Ni-Mo)/TiO2薄膜有较强的光吸收,并且未出现明显的光吸收峰,表明复合薄膜中Ni-Mo的存在并未使TiO2的带隙发生改变,薄膜对可见光较强的吸收应归因于薄膜表面Ni-Mo金属微粒对可见光的吸收作用,7它并不能有效加速光催化反应.(Ni-Mo)/ TiO2薄膜在紫外区吸光度的减少是由于薄膜表面部分被Ni-Mo微粒覆盖造成的.
3.3 刚果红溶液的pH值对薄膜光催化性能的影响
(Ni-Mo)/TiO2薄膜对不同pH值的刚果红溶液光催化降解的实验结果如图5所示.溶液的pH值用稀NaOH和H2SO4调节,光催化实验条件如2.4节所示.由图可知,在实验的pH值范围之内,薄膜的催化活性表现出先随溶液pH值的增大而增加,而后又随溶液pH值的增大而减小的规律.在pH值为3.5的刚果红溶液中,薄膜表现出最佳的催化活性.
pH值对光催化活性的影响主要通过改变催化剂的表面电子特性和表面吸附特性以及被降解物的存在形式起作用.20就催化剂的表面吸附性能和刚果红的存在形式而言,较低的pH值溶液有利于光催化活性的提高.主要原因有二:一是刚果红是阴离子型染料,在溶液中以阴离子形式存在;二是当溶液pH值较低时(小于TiO2的等电点),薄膜中的TiO2带正电,而且溶液的pH值越低,越有利于薄膜表面的TiO2吸附溶液中的H+离子,20使薄膜表面荷正电的数量越大,薄膜表面电势(热力学电势)越正.在异性电荷静电引力作用下,有利于刚果红在催化剂表面的吸附,从而使薄膜光催化刚果红的活性增大.从催化剂的表面电子特性来说,低pH值也有利于光催化活性的提高.因为此时薄膜表面荷正电,有利于光生电子向催化剂表面迁移,并与溶液中的O2作用生成O-•2等活性物种.同时也有利于阻止光生电子与空穴的复合,从而提高光催化剂的催化效率.20然而,过低的pH值并不利于光催化活性的提高.主要原因是此时催化剂表面所荷正电量过高,由于同性电荷的静电斥力作用,抑制了光生空穴向催化剂表面的迁移并与降解物作用.本文的实验结果证明光生空穴对刚果红的降解有较高的催化活性(见3.6节),这将导致催化效率的降低.其次,在过低pH值的溶液中(pH<3)刚果红以不带电的形式存在,不利于它在薄膜表面吸附.这就是薄膜最佳光催化活性不出现在溶液最低pH值的原因.下述光催化实验均在pH=3.5的刚果红溶液中进行.

图4 TiO2/ITO(a)和(Ni-Mo)/TiO2(b)薄膜的紫外-可见漫反射光谱Fig.4 UV-Vis diffuse reflectance spectra of TiO2/ITO(a) and(Ni-Mo)/TiO2(b)thin films

图5 刚果红溶液的pH值对(Ni-Mo)/TiO2薄膜光催化性能的影响Fig.5 Effectof pHvalueof the Congo redaqueous solution on the photocatalytic activity of(Ni-Mo)/TiO2thin film
3.4 (Ni-Mo)/TiO2薄膜的光催化活性
图6中比较了(Ni-Mo)/TiO2薄膜、TiO2/ITO和Ni-Mo薄膜光催化刚果红的降解率随反应时间的变化.Ni-Mo薄膜的制备除在镀液中不加入TiO2微粒外,其它工艺条件与(Ni-Mo)/TiO2薄膜相同.由图可见,存在Ni-Mo薄膜的刚果红溶液也表现出一定量的降解,光照80 min降解率为8.8%.这与图中空白实验(不加入任何薄膜)的结果(光照80 min降解率7.2%)相差不大.可以认为Ni-Mo薄膜没有光催化活性.光催化80 min,(Ni-Mo)/TiO2薄膜和多孔TiO2/ ITO薄膜对刚果红的降解率分别是82.3%和33.8%,前者是后者的2.43倍.复合薄膜表现出优良的光催化性能.
3.5 薄膜的电化学行为
为了揭示(Ni-Mo)/TiO2薄膜光催化机理,对薄膜催化还原溶解氧的能力进行了循环伏安(CV)测定.为了便于比较,对TiO2/ITO薄膜也进行了测量.实验在室温(25°C)下进行,使用H型硬质玻璃电解槽,以(Ni-Mo)/TiO2薄膜或TiO2/ITO薄膜为工作电极,Pt片电极为辅助电极,饱和甘汞电极(SCE)为参比电极构成三电极系统.测试溶液为pH值为3.5、浓度为0.5 mol·L-1的Na2SO4溶液,实验前通入纯O2,使测试溶液为大气压力下的饱和氧溶液.用辰华CHI660C电化学工作站进行测定,扫描速率为50 mV·s-1,先阴极后阳极扫描.以150 W卤钨灯为光源,其它条件同光催化实验.

图6 不同薄膜对刚果红降解率的影响Fig.6 Effect of different thin films on Congo red degradation rateThe pH value of Congo red solution is 3.5.
实验结果如图7所示.由图可知,TiO2/ITO薄膜的电流响应远小于(Ni-Mo)/TiO2.为便于观察TiO2/ ITO薄膜的细节,图中内插图给出了该薄膜的CV曲线.图中曲线(a)是TiO2/ITO薄膜在暗态下的CV曲线,电极电势为-0.790 V的阴极峰对应于溶解氧在TiO2表面上的还原反应,11峰电流密度为1.13 mA· cm-2.曲线(b)是TiO2/ITO在光照下的CV曲线,峰电势为-0.776 V,相对于暗态正移了14 mV;峰电流密度为1.15 mA·cm-2,相对于暗态只增加了0.02 mA· cm-2,光响应不大.图7中曲线(c)和(d)分别是(Ni-Mo)/TiO2在暗态和光照下的CV曲线,暗态和光照下溶解氧还原的峰电势分别为-0.109和-0.104 V,两者相差不大;峰电流密度分别是4.75和6.09 mA· m-2,光响应十分明显.
由上述数据可知,光照下(Ni-Mo)/TiO2薄膜电极相对于TiO2/ITO电极对溶解氧还原的电极电势正移了0.672 V左右;复合薄膜的光电流密度是TiO2/ITO薄膜的5.3倍.由此可以得出:(Ni-Mo)/TiO2薄膜是氧气光催化还原优良的催化剂.
3.6 (Ni-Mo)/TiO2薄膜的光催化机理
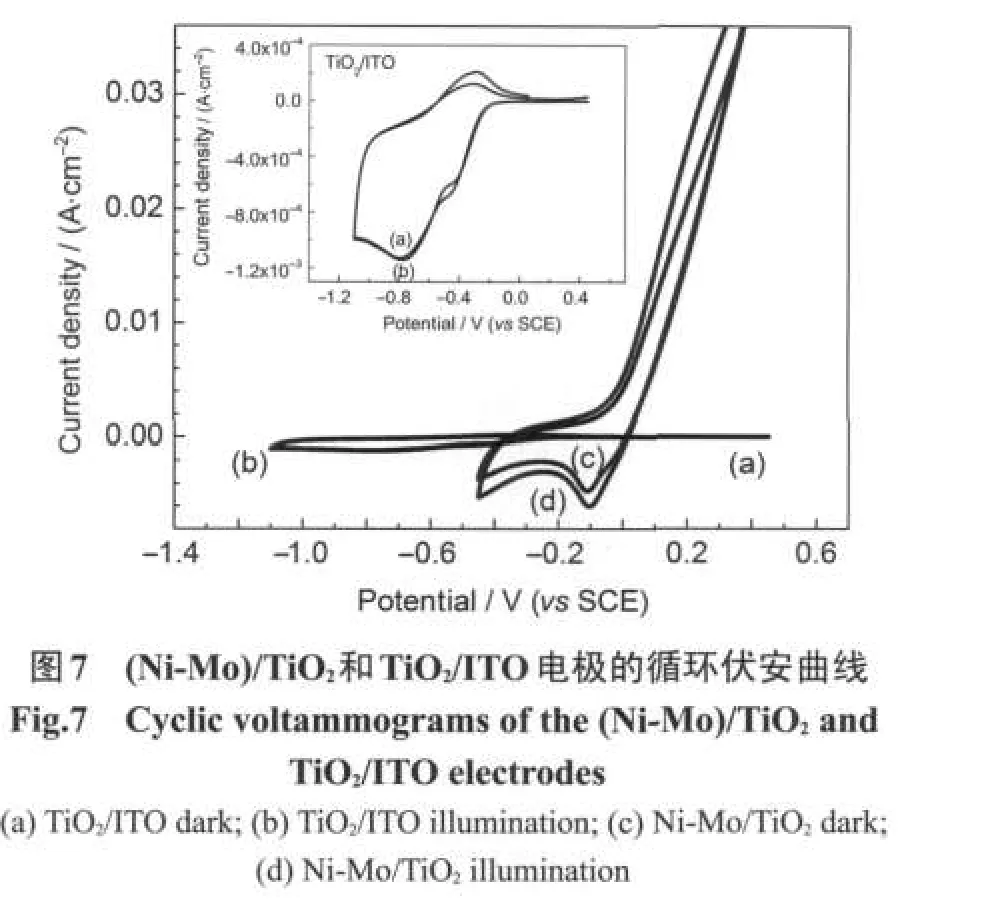
由图1可知,TiO2微粒均匀镶嵌在Ni-Mo合金中,并且以50-100 nm的粒径裸露于薄膜表面.这种结构一方面使得TiO2微粒与合金充分接触,有效形成Schottky异质结,有利于TiO2中的光生电子落入金属势阱中而不易返回,另一方面Ni-Mo合金为光电子的输运提供了良好通道.3.5节实验结果表明,纳米晶Ni-Mo对水溶液中O2的还原有优异的催化作用,这在反应动力学上有利于光生电荷的分离以及含氧活性物种的产生.总之,纳米晶固溶体Ni-Mo对光生电子的上述三种作用是(Ni-Mo)/TiO2薄膜光催化活性提高的重要原因.
当前人们认为,导致有机物降解的活性物种主要包括光生电子(e-)、光生空穴(h+)、超氧自由基()、羟基自由基(·OH)和单线态氧(1O2).但是,对于活性物种生成机理仍有争议,对活性物种的生成效率与作用还缺乏深入系统的研究.4为了深入了解(Ni-Mo)/TiO2光催化降解刚果红的反应机制,本实验进行了一些相关探索.由于光催化所用卤钨灯光源包含紫外和可见两部分光波,故下文分别进行讨论.
3.6.1 紫外光照下的反应机理
图8是在紫外光照射下,在催化体系中加入不同活性物种捕获剂的实验结果.实验所用紫外光由滤光片对卤钨灯光源滤光而得,主波长为365 nm.以AgNO3为电子捕获剂、(NH4)2C2O4为空穴捕获剂、叔丁醇作为羟基自由基捕获剂,实验中各种捕获剂在反应体系中的初始浓度均与模拟污染物刚果红的初始浓度相同,即为7.18×10-6mol·L-1,其它光催化条件与2.4节相同.

图8 紫外光照下不同捕获剂对(Ni-Mo)/TiO2薄膜光催化活性的影响Fig.8 Effect of different scavengers on the photocatalytic activity of(Ni-Mo)/TiO2thin film under UV light irradiation(a)with electron and hydroxyl radical scavenger,(b)with hydroxyl radical scavenger,(c)with electron scavenger,(d)without any scavenger,(e)with hole scavenger;The pH value of Congo red solution is 3.5.
我们认为,以光催化40 min的实验数据进行分析比较合理,这是因为光催化时间太短,不同实验光催化降解率的差别不能充分表现出来.时间太长,一是加入的各种捕获剂消耗较多,二是被降解物有浓度效应,这都会掩盖实验的实质.以下均以此时刻的数据进行讨论.由图8可见,向溶液中加入h+捕获剂使刚果红的降解率明显降低(曲线(e)),与不加任何捕获剂相比较(曲线(d)),光催化40 min,降解率由43.0%降低为27.9%,这说明h+是降解刚果红的主要活性物种.单独加入e-捕获剂和·OH捕获剂(曲线(c)和(b)),光催化相同时间,刚果红降解率都有所增加,但加入e-捕获剂使污染物降解率的增加更明显.向溶液中同时加入e-捕获剂和·OH捕获剂(曲线(a)),降解率大幅度增加至70.2%,是不加捕获剂的1.63倍.这个结果说明,在紫外光照射下,光生电子及其与溶解O2生成的·OH和不是光催化刚果红的主要活性物质,或者说它们与h+相比较,与刚果红的反应速率很慢.加入e-捕获剂或(和)·OH捕获剂使光催化反应速率的提高是因为它们加速了光阴极反应(如下述反应式(5)和(7)),提高了光生电子-空穴的分离效率,从而加快了光生空穴的生成速率所致.考虑到1O2是由h+和反应而生成,21由上述实验事实可知它的活性更小,故在反应机理的讨论中不再涉及.
综合以上分析和当前人们的认识,22,23提出(Ni-Mo)/TiO2薄膜在紫外光照下催化降解刚果红(CR)的反应机理为:

光阳极反应:

光阴极反应:
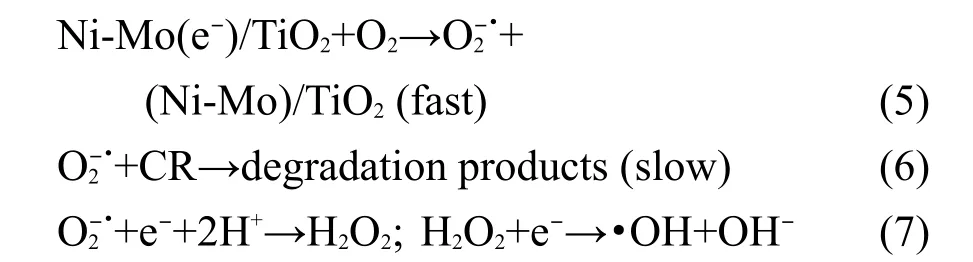
式(1)表示在紫外光照射下,(Ni-Mo)/TiO2薄膜中TiO2的价带电子跃迁至导带,并随之进入Ni-Mo中,空穴留在价带中.
3.6.2 可见光照射下的反应机理
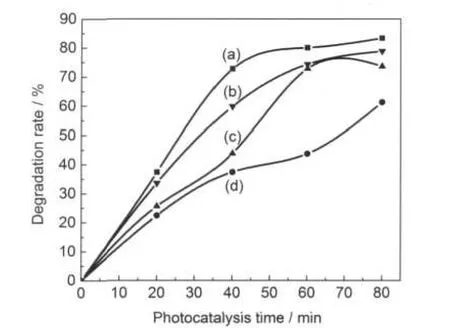
图9 可见光照射下不同捕获剂对(Ni-Mo)/TiO2薄膜光催化活性的影响Fig.9 Effect of different scavengers on the photocatalytic activity of(Ni-Mo)/TiO2thin film under visible light irradiation(a)without any scavenger;(b)with hydroxyl radical scavenger; (c)with superoxide radical scavenger;(d)with electron scavenger
图9是在可见光照射下,在催化体系中加入不同活性物种捕获剂的实验结果.实验所用可见光是对卤钨灯光源滤光所得,最小波长为420 nm.以苯醌作为超氧自由基(捕获剂,电子捕获剂和羟基自由基捕获剂与3.6.1节相同.各种捕获剂在反应体系的初始浓度以及其它光催化条件也与上小节相同.
对比图9中曲线(a)和(d)可知,加入电子捕获剂使刚果红的降解率急剧下降,光催化40 min,降解率由72.7%(不加任何捕获剂)降至37.4%,这一结果说明催化体系中产生的光电子是引发刚果红降解的活性物种之源.由图9中曲线(b)可见,向反应体系中加入·OH捕获剂,光催化40 min,刚果红的降解率(59.8%)虽有降低,但降低幅度相对较小.图中曲线(c)是向溶液中加入捕获剂的实验结果,光催化相同时间,污染物降解率大幅度下降至43.8%,与加入电子捕获剂的实验结果(37.4%)接近,这一结果表明,是可见光照下光催化刚果红的主要活性物种,它的活性远大于·OH.据式(6)可知与刚果红自由基CR+•的作用是刚果红被降解的主要途径(式(11)),这与文献24相一致.
可见光下TiO2催化降解染料污染物属于染料敏化光催化,25由上述讨论可以推测出(Ni-Mo)/TiO2薄膜在可见光照射下催化降解刚果红的反应机理:


式中CR*表示刚果红的电子激发态,CR+•表示刚果红自由基.式(8)表示刚果红吸收可见光被激发,(9)式表示电子从刚果红的激发态跳入复合薄膜TiO2的导带,式(10)则表示复合薄膜TiO2的导带电子进入Ni-Mo中.
4 结论
用恒电流复合电沉积方法制备了(Ni-Mo)/TiO2薄膜,该薄膜由TiO2纳米粒子相和纳米晶Ni-Mo固溶体相构成.(Ni-Mo)/TiO2薄膜对于刚果红的降解具有优异的光催化活性.薄膜光催化活性的提高主要归因于薄膜层中有效形成的(Ni-Mo)/TiO2异质结和良好的电子通道,以及Ni-Mo纳米晶合金对O2和激发电子还原反应的催化作用.较详细地探讨了在紫外光和可见光照射下(Ni-Mo)/TiO2薄膜光催化降解刚果红的反应机理.
(1)Antoniadou,M.;Lianos,P.Catal.Today 2009,144,166.
(2) Szabo-Bardos,E.;Zsilak,Z.;Horvath,O.Prog.Colloid Polym. Sci.2008,135,21.
(3) María-José,L.M.;Rafael,V.G.;José,A.Catal.Today 2005, 101,307.
(4) Xu,Y.M.Prog.Chem.2009,21(2/3),524.[许宜铭.化学进展,2009,21(2/3),524.]
(5) Esquivel,K.;Arriaga,L.G.;Rodriguez,F.J.;Martinez,L.; Godinez,L.A.Water Res.2009,43,3593.
(6) Hufschmidt,D.;Bahnemann,D.;Testa,J.J.J.Photochem. Photobio.A-Chem.2002,148,223.
(7) Ren,X.C.;Shi,Z.F.;Kong,L.R.Chin.J.Catal.2006,27(9), 815. [任学昌,史载峰,孔令仁.催化学报,2006,27(9),815.]
(8)Hongfan,G.;Marianna,K.;Mikko,H.;Markku,L.Appl.Catal. B-Environ.2010,95(3-4),358.
(9) Ramírez-Meneses,E.;García-Murillo,A.;Carrillo-Romo,F.D. J.;García-Alamilla,R.Sol-Gel Sci.Technol.2009,52,267.
(10) Hosseini,Z.;Taghavinia,N.;Sharifi,N.;Chavoshi,M.; Rahman,M.J.Phys.Chem.C 2008,121(47),18686.
(11) Peralta-Hernández,J.M.;Manríquez,J.;Meas-Vong,Y. J.Hazard.Mater.2007,147,588.
(12)Liu,S.Y.;Wu,L.D.;Zhao,Z.X.;Feng,Q.G.;Wang,X.;Yang, C.D.J.Inorg.Mater.2009,24(5),902.[刘少友,吴林东,赵钟兴,冯庆革,王 翔,杨朝德.无机材料学报,2009,24(5), 902.]
(13) Fan,C.L.;Priron,D.L.;Sieb,A.;Paradis,P.J.Electrochem. Soc.1994,141(2),382.
(14) Mei,Y.;Jia,Z.B.;Qiu,L.;Cao,J.L.;Zhang,Y.F.;Wei,Y.Acta Energiae Solaris Sinica 2002,23(2),199.[梅 燕,贾振斌,邱 丽,曹江林,张艳峰,魏 雨.太阳能学报,2002,23(2), 199.]
(15) Wu,J.M.;Huang,B.;Zeng,Y.H.Thin Solid Films 2006,497 (1-2),292.
(16) Paula,P.;Liana,A.;Teodor,V.Univ.Politeh.Buchar.Sci.Bull. Series B 2010,72(4),11.
(17) Fan,X.Metal X-Ray Diffractometry;China Mechine Press: Beijing,1996;p 45.[范 雄.金属X射线衍射学.北京:机械工业出版社,1996:45.]
(18) Wang,J.Q.;Xin,B.F.;Yu,H.T.;Xie,Y.T.;Zhao,B.;Fu,H.G. Chem.J.Chin.Univ.2003,24,1237.[王建强,辛柏福,于海涛,谢玉涛,赵 冰,付宏刚.高等学校化学学报,2003,24, 1237.]
(19) Li,X.Z.;He,C.;Graham,N.;Xiong,Y.J.Appl.Electrochem. 2005,35,741.
(20)Zhang,Y.R.;Wang,J.;Ke,Y.Q.J.Hazard.Mater.2010,177 (1-3),750.
(21)Nosaka,Y.;Daimon,T.;Nosaka,A.T.Phys.Chem.Chem.Phys. 2004,6,2917.
(22) You,X.F.;Chen,F.;Zhang,J.L.;Huang,J.Z.;Zhang,L.Z. Chin.J.Catal.2006,27(3),270. [尤先锋,陈 锋,张金龙,黄家桢,张利中.催化学报,2006,27(3),270.]
(23)Han,S.T.;Xi,H.L.;Shi,R.X.;Fu,X.Z.;Wang,X.X.Chin.J. Chem.Phys.2003,16(5),339.[韩世同,习海玲,史瑞雪,付贤智,王绪绪.化学物理学报,2003,16(5),339.]
(24) Yang,J.;Dai,J.;Zhao,J.C.;Miu,J.Chin.Sci.Bull.2009,54 (15),2196.[杨 娟,戴 俊,赵进才,缪 娟.科学通报, 2009,54(15),2196.]
(25)Ji,H.W.;Ma,W.H.;Hang,Y.P.;Zhao,J.C.;Wang,Z.P.Chin. Sci.Bull.2003,48(21),2199.[籍宏伟,马万红,黄应平,赵进才,王正平.科学通报,2003,48(21),2199.]
September 16,2011;Revised:November 27,2011;Published on Web:December 8,2011.
Photocatalytic Property and Reaction Mechanism of(Ni-Mo)/TiO2Nano Thin Film Evaluated with Congo Red
LIAi-Chang*LI Gui-Hua ZHENG Yan FENG Ling-Ling ZHENG Yan-Jun
(Faculty of Chemistry and Material Science,Langfang Teachers College,Langfang 065000,Hebei Province,P.R.China)
(Ni-Mo)/TiO2composite thin films were prepared by composite electroplating at a constant current.The surface morphology,phase structure,and optical characteristics of the thin films were analyzed by scanning electron microscopy(SEM),X-ray diffraction(XRD),Raman spectrum,and ultravioletvisible diffuse reflectance spectroscopy(UV-Vis DRS),respectively.The photocatalytic properties of the (Ni-Mo)/TiO2composite thin films were evaluated with Congo red as a model compound.The effects of pH of the Congo red aqueous solution on the photocatalytic activity of the(Ni-Mo)/TiO2thin films were investigated.Using cyclic voltammetry technique and a method of adding active species scavengers to the solution,the mechanisms of photocatalytic degradation of the films were explored.The results show that the(Ni-Mo)/TiO2films consist of crystalline grains of TiO2in the size range of 50-100 nm and nanocrystalline grains of Ni-Mo in solid solution.The(Ni-Mo)/TiO2films are photocatalytically more active than a TiO2/ITO(indium tin oxide)reference film.Under halogen light irradiation,the photocatalytic degradation rate of the(Ni-Mo)/TiO2films is 2.43 times as much as that of a porous TiO2(Degussa P25)/ ITO film.The improvement in photocatalytic activity for the composite films could be mainly attributed to the heterojunction of(Ni-Mo)/TiO2,the electronic passageway of Ni-Mo in the composite films,and the catalysis of Ni-Mo in the composite film for the reaction of excited electrons with dissolved oxygen.The photocatalytic reaction mechanisms of the(Ni-Mo)/TiO2films evaluated with Congo red are given under visible and UV light irradiation,respectively.
Photocatalysis;(Ni-Mo)/TiO2nanofilm;Composite electroplating;Cogon red; Reaction mechanism
10.3866/PKU.WHXB201112081 www.whxb.pku.edu.cn
*Corresponding author.Email:aichangli@hotmail.com;Tel:+86-316-2197299.
The project was supported by the Science and Technology Project of Hebei Province,China(11276732).
河北省科技支撑计划项目(11276732)资助
O643
