环介导等温扩增技术检测食品中铜绿假单胞菌
2012-12-03刘伟侯丽萍赵良娟曲鹏郑文杰张宏伟
刘伟,侯丽萍,赵良娟,曲鹏,郑文杰,张宏伟
(天津出入境检验检疫局,天津 300201)
铜绿假单胞菌(Pseudomonas Aeruginosa,PA),革兰染色阴性菌,在自然界中分布广泛,为淡水和土壤中最常见的细菌种类之一。空气、动物皮肤、肠道、呼吸道等处均可有该菌的存在。
铜绿假单胞菌的多种产物有致病性,其内毒素则在发病上无重要意义。其分泌的外毒素A(PEA)是最重要的致病、致死性物质,进入敏感细胞后被活化而发挥毒性作用,使哺乳动物的蛋白合成受阻并引起组织坏死,造成局部或全身疾病过程。动物模型表明:给动物注射外毒素A后可出现肝细胞坏死、肺出血、肾坏死及休克等,如果注射外毒素A抗体则对铜绿假单胞菌感染有保护作用。铜绿假单胞菌尚能产生蛋白酶,有外毒素A及弹性蛋白酶同时存在时则毒力最大;胞外酶S是铜绿假单胞菌所产生的一种不同于外毒素A的ADP-核糖转移酶,可促进铜绿假单胞菌的侵袭扩散,感染产此酶的铜绿假单胞菌病人,可有肝功能损伤而出现黄疸[1-2]。
拟以铜绿假单胞菌的PEA基因序列为靶序列,设计特异性引物[4-6],建立食品中铜绿假单胞菌LAMP检测方法,应用于食品样品中并与检验检疫行业标准进行比较[3],为准确快速铜绿假单胞菌的检测试验提供科学参考。
1 材料与方法
1.1 菌种
本实验对约36株阳性样品进行了检测,其中American Type Culture Collection(ATCC)标准铜绿假单胞菌4株,中国医学细菌保藏管理中心(CMCC)标准铜绿假单胞菌8株,实验室自分离铜绿假单胞菌菌10株,其他来源假单胞菌株CGMCC 14株。本研究所使用的菌株见表1。
1.2 细菌培养
尽管35℃~37℃培养时铜绿假单胞菌生长良好,但干扰菌也同时竞争增殖,降低检出率。利用铜绿假单胞菌42℃生长的特性,可与其他相关细菌区别,得到较高的阳性证实率。
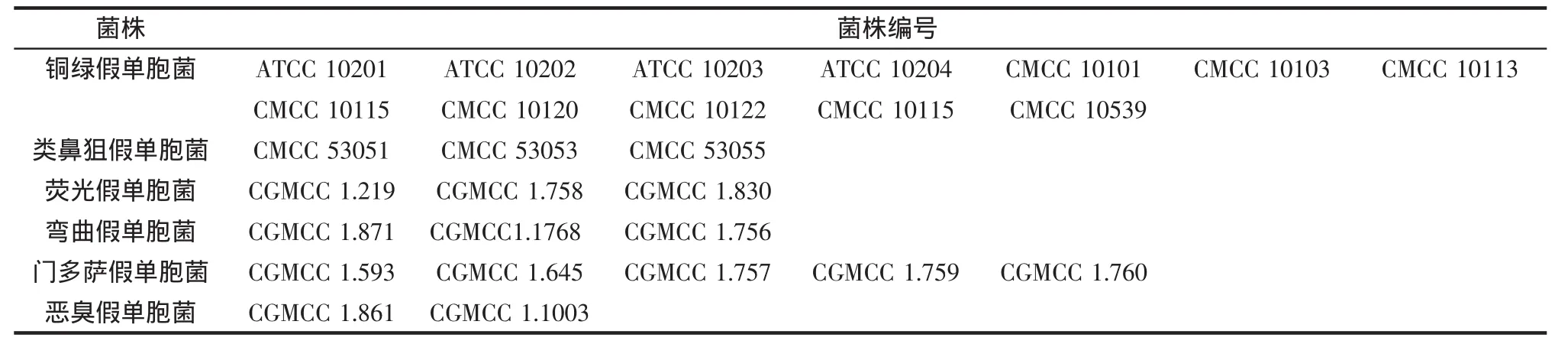
表1 本研究中使用菌株Table 1 strains of the study
1.3 细菌基因组DNA提取的方法
取1.5 mL过夜菌悬液,根据说明书,用DNA提取试剂盒(Promega公司)提取细菌DNA,所提DNA的溶于50 μL Tris-EDTA缓冲液中,-20℃保存备用。
1.4 引物设计
搜集GenBank已公布基因组全序列铜绿假单胞菌的PEA基因序列。GeneTool软件进行比对,发现此序列中大约在800~1400的区域是一段假单胞菌高度同源的序列,并在GenBank上BLAST证明与其它菌高度特异。故我们在此序列区段设计引物并用PrimePrimer 5进行评价,确定后交由上海英俊公司合成。共设计6条LAMP引物(2条内引物,2条外引物,2条促环引物)。引物序列及在基因中的定位见图1。

图1 引物序列定位Fig.1 Position of the primer in the sequence
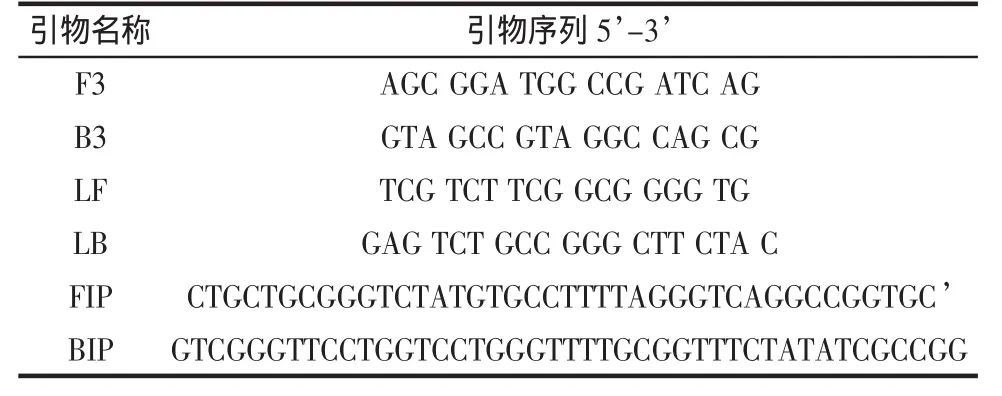
表2 铜绿假单胞菌特异性引物Table 2 Primer of Pseudomonas Aeruginosa
1.5 LAMP反应检测
总反应体系为 50 μL,其中:10×buffer 2.5 μL(Fermentas),dNTP (10 mmol/L)1 μL(TaKaRa),MgSO4(10 mmol/L)0.5 μL (Fermentas),0.8 mol/L betained,dH2O 14.4 μL(Sigma),Bst polymerase 1 μL(BioLabs),F3(10 μmol/L)0.2 μL,FIP (10 μmol/L) 1.6 μL,B3(10 μmol/L)0.2μL,BIP(10μmol/L)1.6μL,模板 DNA2μL。
反应于63℃恒温扩增60 min;4℃保存。1.5%琼脂糖凝胶,电压5 V/cm,电泳时间2 h。
1.6 灵敏度测试
模板浓度梯度测试
将模板DNA进行浓度梯度稀释,然后分别以101、102、103、104、105、106、107、108、109和 1010拷贝作为模板进行等温扩增,反应结果用电泳观测。
1.7 干扰菌添加实验
取3份经证实未污染铜绿假单胞菌的食品样品(矿泉水、碳酸饮料、奶制品各1份)。经过粉碎后分别接种一定含量的铜绿假单胞菌ATCC 10201菌液的梯度稀释液(同样体积的该稀释液同时进行平板计数)和类似浓度(以吸光度OD值为参照)10倍体积的类鼻狙假单胞菌和10倍体积的恶臭假单胞菌。按照1.2、1.3的方法增菌和提取基因组DNA,按照1.5进行LAMP法检测。
2 实验结果
2.1 LAMP引物特异性
肺炎克氏菌LAMP特异性引物组在63℃扩增时特异性最好,实验用近缘菌株都无假阳性出现,而肺炎克氏菌反应管中都出现白色沉淀,并在电泳中出现特异性泳带(图2)。
2.2 检测灵敏度
通过对一系列梯度稀释过的模板进行等温扩增并进行电泳分析,结果见图3,表明,在对灵敏度检测中的菌液模板DNA进行检测,在电泳分析中,发现LAMP反应灵敏度可达到2.2×10 cfu/100 mL。用肉眼进行浊度观测的灵敏度与电泳检测相同,也为2.2×10cfu/100mL。
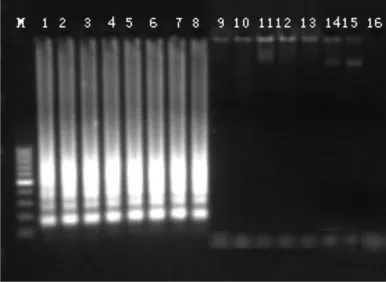
图2 LAMP引物特异性检测结果Fig.2 Electrophoresis detecting the specificity of Pseudomonas Aeruginosa with LAMP
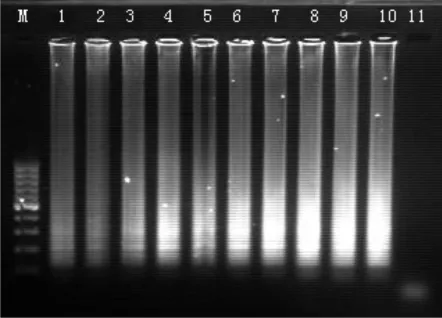
图3 灵敏度检测电泳结果Fig.3 Sensitivity detection the electrophoresis results
2.3 添加实验
取3份经证实未污染铜绿假单胞菌的食品样品(矿泉水、碳酸饮料、奶制品各1份)。经过粉碎后分别接种一定含量的铜绿假单胞菌ATCC 10201菌液的梯度稀释液(同样体积的该稀释液同时进行平板计数)和类似浓度(以吸光度OD值为参照)10倍体积的类鼻狙假单胞菌和10倍体积的恶臭假单胞菌。按照1.3的方法增菌和提取基因组DNA,按照1.5进行LAMP法检测,阳性结果表示为+,阴性结果表示为-,结果见表3。

表3 LAMP检测铜绿假单胞菌添菌试验结果Table 3 Detection of Pseudomonas Aeruginosa Tim bacteria test results with LAMP
在增菌前,添加绿脓假单胞菌的灵敏度试验表明,本方法的检测下限为2.2 cfu/100 g~3.5 cfu/100 g。
通过对3份食品样品添加一定含量的铜绿假单胞菌和干扰菌(类鼻狙假单胞菌和恶臭假单胞菌)做干扰试验,经LAMP法检测,结果表明:该方法可用于复杂基质的实际样品检测,且检测结果用沉淀法和电泳法观察结果一致。
3 分析讨论
LAMP方法的关键在于多引物之间无交叉反应,且能成环,在恒温的条件下,由于选择的外毒素A(PEA)基因的GC含量比很高,刚性结构很强,不利于LAMP引物的成环,在设计引物的时候尽量将引物的长度缩短,同时在GC比最高的地方设计促环引物和成环引物,加大Bst酶量,使方法得以稳定。试验表明,本方法检测灵敏度可达到2.2 cfu/100 g~3.5 cfu/100 g,适用于食品样品中铜绿假单胞菌的快速检测。
[1]Moulton P J,Vivian A,Hunter P J,et al.Changes in cultivarspecificity toward pea can result from transfer of plasmid RP4 and other incompatibility group P1 replicons to Pseudomonas syringae pv.pisi[J].Microbiology Dec,1993,139:3149-3155
[2]Khan A A,Cerniglia C E.Detection of Pseudomonas aeruginosa from clinical and environmental samples by amplification of the exotoxin AgeneusingPCR[J].ApplEnvirMicrobiolOct,1994,60:3739-3745
[3]郑晶,黄晓蓉,赵贵明.SN/T 2099-2008进出口食品中绿脓杆菌检测方法[S].北京:中国标准出版社,2008:1-9
[4]张宏伟,叶露萌,彭阳思,等.利用环介导等温扩增技术对沙门氏菌进行检测[J].食品研究与开发,2009,30(5):115-118
[5]张宏伟,于佳,郑文杰,等.利用环介导等温扩增技术对奶粉中阪崎肠杆菌进行检测[J].食品研究与开发,.2009,30(6):114-117
[6]Takenouchi T,Sakagawa E,Sugawara M.Detection of gyra mutations among 335 Pseudomonas aeruginosa strains isolated in Japan and their susceptibilities to fluoroquinolones antimicrob[J].Agents Chemother.,Feb 1999;43:406-409
