LC-MS法测定人血浆中瑞格列奈的浓度及其片剂的生物等效性研究
2012-12-03任进民殷立新王川平张志清王淑梅河北医科大学第二医院石家庄050000
任进民,孙 倩,殷立新,王川平,张志清,王淑梅(河北医科大学第二医院,石家庄 050000)
瑞格列奈(Repaglinide)为新型的短效口服促胰岛素分泌降糖药,耐受性强、安全性高,是较理想的口服降糖药。临床用于治疗2型糖尿病,特别是合并肾功能不全的患者[1]。关于生物样品中瑞格列奈含量的测定,已有文献报道主要使用高效液相色谱(HPLC)法[2~5],液-质联用(LC-MS)法[6]则很少。笔者建立了LC-MS法测定人血浆中瑞格列奈浓度的方法,并对国产与进口瑞格列奈片的人体药动学及生物等效性进行研究。
1 材料
1.1 仪器
API 4000型液相色谱-三重四极杆质谱联用仪,配有电喷雾离子化源和Analyst 1.4.1数据采集系统软件(美国ABI公司);Prominence LC-20A型液相色谱仪,配有二元梯度泵、在线脱气机、自动进样器和柱温箱(日本岛津公司);AG-135分析天平(瑞士Mettler Toledo公司);TG16-WS型离心机(湖南湘仪离心机仪器有限公司);GZ-20G-Ⅱ型离心机(上海安亭科学仪器厂);SB3200型超声波清洗仪(上海音波声电科技公司);ZH-2型混合器(天津药典标准仪器厂)。
1.2 试药
瑞格列奈对照品(批号:100753-200501)、格列齐特对照品(内标,批号:0269-9701)均购自中国食品药品检定研究院,含量均>99.9%;受试制剂:瑞格列奈片(北京万生药业有限责任公司研制,规格:每片0.5 mg(A1),批号:S20090601;规格:每片1 mg(A2),批号:S20090604);参比制剂:瑞格列奈片(R,丹麦诺和诺德公司(Novo Nordisk A/S,规格:每片1 mg,批号:XM70002);甲醇为色谱纯,甲酸为分析纯,水为纯净水。
2 方法与结果
2.1 色谱及质谱条件
色谱柱:C18柱(4.6 mm×50 mm,5 μm),保护柱C18(4.0 mm×3.0 mm);流动相:甲醇-0.1%甲酸水溶液(90∶10);流速:0.5 mL·min-1;柱温:20 ℃;进样量:20 μL。
离子源:电喷雾离子化(ESI)源;喷雾电压:4500 V;雾化温度:450 ℃;雾化气:30 L·min-1;帘气:20 L·min-1;碰撞气:8 L·min-1;辅助气:35 L·min-1;检测方式:正离子多反应监测(MRM);监测离子:m/z 454.4→231.5(瑞格列奈),m/z 324.1→127.2(内标,格列齐特);碰撞诱导解离电压:40 V(瑞格列奈)和20 V(格列齐特);驻留时间(Dwell time):100 ms。
2.2 溶液的配制
2.2.1 对照品溶液。准确称取瑞格列奈对照品25.0 mg,置于25 mL容量瓶中,用甲醇溶解并定容,得浓度为1 mg·mL-1的对照品贮备液。以空白血浆稀释至1.0 μg·mL-1,混匀,作为对照品工作样品。
2.2.2 内标溶液。准确称取格列齐特对照品10.05 mg,置于10 mL容量瓶中,用甲醇溶解并定容,作为内标贮备液。精密吸取100 μL置250 mL容量瓶中,用甲醇定容,得400 ng·mL-1的内标工作液。
2.3 血样处理
精密吸取100 μL血浆(标准曲线、质控样品取健康志愿者空白血浆制备)中依次加入内标溶液(400 ng·mL-1格列齐特的甲醇溶液)100 μL、甲醇1 mL,涡流混合30 s,离心(11000 r·min-1)5 min后,取上清液200 μL装入自动进样器小瓶,取样20 μL进行分析。
2.4 专属性试验与基质效应
2.4.1 专属性考察。瑞格列奈和内标格列齐特的ESI一级全扫描质谱主要生成准分子离子峰[M+H]+,分别为m/z 454.4和m/z 324.1。选择性对准分子离子峰[M+H]+进行二级质谱分析,将各待测物及内标物生成的主要碎离子用于定量分析时监测的产物离子。瑞格列奈和内标格列齐特生成的主要碎片离子为m/z 231.5和m/z 127.2。分别取6名受试者的空白人血浆100 μL,除不加内标溶液外(以甲醇代替),按“2.3”项下方法操作;将相应的瑞格列奈标准溶液加入空白血浆中制备200 ng·mL-1的血浆模拟样品,按同法操作;另取志愿受试者用药0.1 h后的血浆样品100 μL,按同法操作。由血浆样品按本法分离测定所得的色谱图表明,空白样品中内源性物质不干扰瑞格列奈的分析,通过与空白血样添加标准对照品(瑞格列奈、格列齐特)色谱图比较,确证瑞格列奈和内标的保留时间约为1.8、1.5 min。色谱图见图1。
2.4.2 基质效应考察。取对照品贮备液适量,用甲醇适当稀释,分别取0.1 mL,加入空白血浆基质溶液0.9 mL,制备低、中、高浓度(1.0、10.0、160.0 ng·mL-1)的血浆模拟样品并测定。结果基质效应分别为104%、103%、101%,RSD(n=5)均<1.9%;内标基质效应为104%,RSD(n=9)均<0.6%。
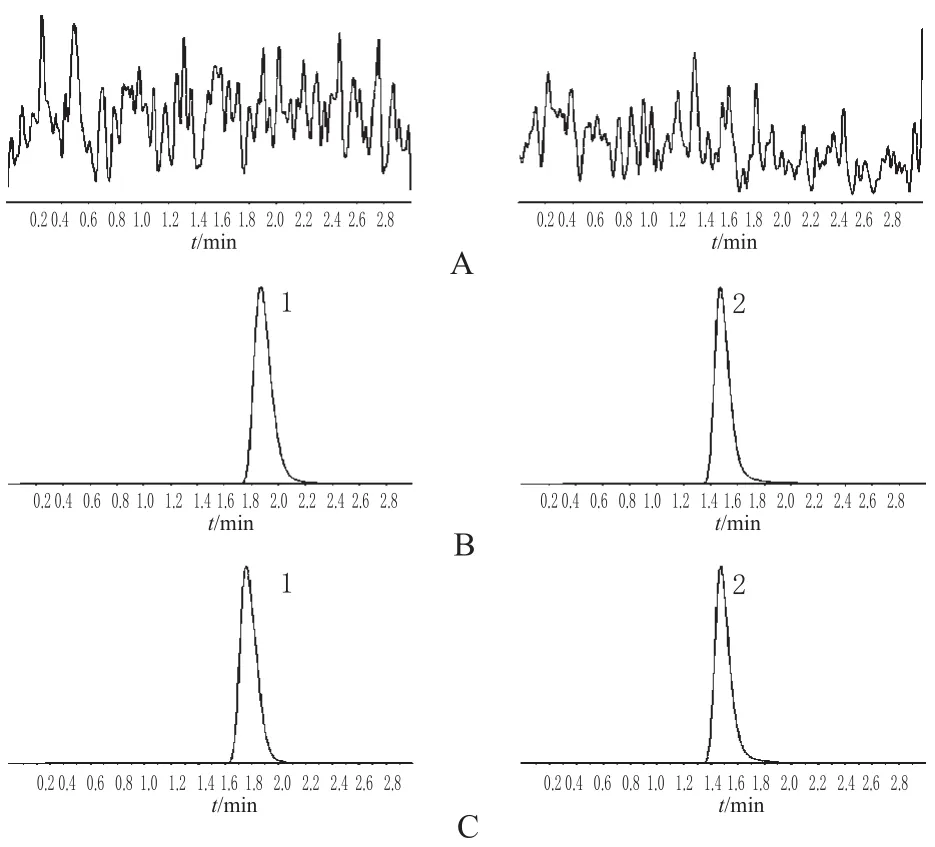
图1 MRM图谱Fig 1 MRM chromatograms
2.5 标准曲线的制备
取对照品工作液适量,加入空白血浆,分别稀释成200.0、40.0、10.0、3.0、1.0、0.5 ng·mL-1的系列浓度线性工作样品,按“2.3”项下方法操作后进样测定,记录色谱。以瑞格列奈与内标峰面积之比(R)为纵坐标,瑞格列奈浓度(c)为横坐标,进行线性回归,得回归方程为R=0.00925c+4.28×10-5(r=0.9992)。结果表明,瑞格列奈血药浓度在0.5~200.0 ng·mL-1范围内线性关系良好。定量下限为0.5 ng·mL-1,准确度偏差为-4.9%,RSD(n=6)为2.4%。
2.6 精密度及回收率试验
按“2.5”项下方法制备低、中、高(1.0、10.0、160.0 ng·mL-1)浓度的血浆样品,各6份,共4批,分别进样测定,计算得日内、日间RSD(n=6)及方法回收率,结果见表1。同上制备低、中、高浓度(1.0、10.0、160.0 ng·mL-1)的血浆样品,各6份,分别测定其中瑞格列奈的峰面积S1与相应浓度瑞格列奈溶液的峰面积S2,按S1/S2×100%计算瑞格列奈的提取回收率,结果分别为83.2%、85.4%、86.6%(n=6),内标的提取回收率为91.6%(n=9)。
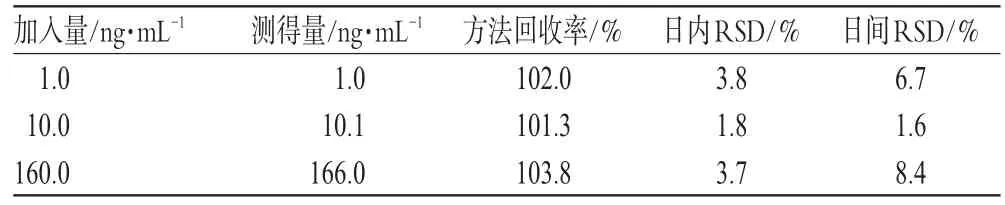
表1 回收率及精密度试验结果(n=6)Tab 1 Results of recovery and precision test(n=6)
2.7 稳定性试验
考察浓度为1.0、160.0 ng·mL-1的瑞格列奈血浆样品分别避光室温放置4 h、样品处理后室温放置24 h、冻融3次和冻存32 d的稳定性,结果瑞格列奈峰面积的RSD(n=6)均<6.5%,表明血浆样品在上述条件下均稳定。
2.8 血药浓度测定和药动学试验
2.8.1 研究对象。24名男性健康志愿者,年龄(20.4±1.2)岁,体重(65.1±5.9)kg,身高(172±5)cm,试验前经体检证实心、肝、肾功能和血糖等均正常,试验前2周及试验期间未用其他药物,且无烟、酒嗜好。本试验方案经河北医科大学第二医院医学伦理委员会审核批准,志愿者均书面签署知情同意书。
2.8.2 试验方案。采用完全三交叉试验设计(3×3)进行本项生物等效性研究,24名受试者随机分为6组,每组4人,分别按A1RA2、A1A2R、A2A1R、A2RA1、RA1A2、RA2A1顺序入组进行试验,每2周期间隔为7 d,共进行3周期。根据瑞格列奈制剂的临床常用剂量,确定本试验的给药剂量为4 mg。受试者于试验当日晨空腹口服受试制剂和参比制剂,用200 mL温开水送服,2 h内禁水,4 h后各进食标准餐1次。试验期间保持日常轻微活动,不允许长时间卧床,并避免剧烈活动。受试者禁用其他药及含咖啡因类成分的饮料,禁止吸烟、饮酒。
2.8.3 血样采集。分别在服药前取空白血样,于服药后0.1、0.2、0.33、0.5、0.75、1、1.5、2、2.5、3、4、5、6 h各个时刻采集14个血样:自上肢静脉取血3 mL,注入肝素化管中,混匀后离心(转速:3000 r·min-1)10 min,血浆样品于-70 ℃冰箱保存待测。
2.8.4 数据处理。试验所得瑞格列奈血药浓度数据用DAS 2.0程序软件计算药动学参数,权重系数取1。数据处理方法用逐个受试者的药-时数据作曲线拟合,求得个体参数后计算平均值。tmax、cmax取实测值,药-时曲线下面积(AUC)由梯形法求得,消除半衰期按t1/2=-0.693/Zeta计算。cmax及AUC值经对数转换后作方差分析、双单侧t检验和90%置信区间检验,tmax用非参数法分析,评价受试制剂与参比制剂的生物等效性。24名受试者口服单剂量受试制剂A1、A2和参比制剂R的药动学参数计算结果见表2;平均药-时曲线见图2。

表2 24名受试者口服受试制剂与参比制剂后的主要药动学参数(n=24)Tab 2 Main pharmacokinetic parameters of test preparations and reference preparation in 24 healthy volunteers with oral administration(n=24)
3 讨论
本试验参考相关文献[6],通过优化色谱和质谱条件建立了LC-MS法测定血浆中瑞格列奈的浓度,经过方法学确证,结果表明本法专一性好、灵敏度高,准确度、精密度和线性关系良好,完全满足药动学和生物样品分析测定要求。本法血样预处理较文献[2~4]简便易行,甲醇直接沉淀蛋白后直接测定,无需碱化后以乙酸乙酯等有机试剂提取,并且灵敏度高、分析时间短,便于进行大样本量的分析测定。
本文国产和进口的瑞格列奈片的主要药动学参数无显著差异,与文献报道[5]相似。生物等效性统计分析结果表明,国产受试制剂A1、A2的AUC0~6h分别为93.1%~112.9%、88.0%~106.8%,cmax的90%置信区间分别91.5%~112.0%、89.1%~109.1%。按照生物等效性判断标准,受试制剂AUC的90%置信区间落在标准参比制剂的80%~125%之间,cmax落在70%~143%之间即可认为等效,故判定受试制剂A1、A2与参比制剂具有生物等效性。受试制剂A1和A2相对于参比制剂的相对生物利用度分别为(106.5±31.1)%、(100.9±30.6)%。

[1]Marbury TC,Ruckle JL,Hatorp V,et al.Pharmacokinetics of repaglinide in subjects with renal impairment[J].Clin Pharmacol Ther,2000,67(1):7.
[2]Venkatesh P,Harisudhan T,Choudhury H,et al.Simultaneous estimation ofsix anti-diabetic drugs--glibenclamide,gliclazide,glipizide,pioglitazone,repaglinide and rosiglitazone:development of a novel HPLC method for use in the analysis of pharmaceutical formulations and its application to human plasma assay[J].Biomed Chromatogr,2006,20(10):1043.
[3]Ruzilawati AB,Wahab MS,Imran A,et al.Method development and validation of repaglinide in human plasma by HPLC and its application in pharmacokinetic studies[J].J Pharm Biomed Anal,2007,43(5):1831.
[4]El-Houssieny BM,Wahman LF,Arafa NM.Bioavailability and biological activity of liquisolid compact formula of repaglinide and its effect on glucose tolerance in rabbits[J].Biosci Trends,2010,4(1):17.
[5]胡晋红,李 珍,刘晓东,等.国产与进口降糖药瑞格列奈片的生物等效性研究[J].第二军医大学学报,2001,22(5):432.
[6]Varanasi KK,Sridhar V,Potharaju S,et al.Development and validation of a liquid chromatography/tandem mass spectrometry assay for the simultaneous determination of nateglinide,cilostazol and its active metabolite 3,4-dehydro-cilostazol in Wistar rat plasma and its application to pharmacokinetic study[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,865(1):91.
