LC-MS/MS测定肠衣中7种大环内酯类抗生素残留量
2012-12-02林维宣陈溪张宁董伟峰王秋艳赵景红
林维宣,陈溪,张宁,董伟峰,王秋艳,赵景红
(1.辽宁出入境检验检疫局,辽宁大连116001;2.大连出入境检验检疫局,辽宁 大连 116001)
大环内酯类抗生素是兽医临床上十分重要的一类抗生素,广泛用于畜禽细菌性和支原体感染的化学治疗,同时也是重要的生长促进剂,在动物药品和饲料添加物中占有重要位置。它包括螺旋霉素(spiramycin)、替米考星(tilmicosin)、竹桃霉素(oleandomycin)、泰乐菌素(tylosin)、红霉素(erythromycin)、罗红霉素(roxithromycin)、交沙霉素(josamycin)等多种兽药[1]。
食品中大环内酯类药物残留可引起过敏和携带耐药基因的扩散,对人们威胁很大,许多国家对大环内酯类抗生素在动物上的使用和在食品中的残留进行了严格的监控。美国、欧盟、日本等国家都已规定了大环内酯类抗生素在动物源性食品中的残留限量。
大环内酯类兽药的检测方法主要有:微生物法、免疫分析法(ELISA)、薄层色谱法(TLC)、气质联用法(GC/MS)、高效液相色谱法(HPLC)、液质联用法(LC/MS,LC-MS/MS)等。微生物效价法选择性低,特异性不高,且仅检测单一药物的残留。免疫分析法(ELISA),特别是近来发展的放射受体分析法(CharmⅡ法),涉及的样品前处理简单、快速,具有良好的特异性和灵敏度,但因影响因素多且难以控制,难以实现多残留分析。薄层色谱法主要应用于原料药和制剂中大环内酯类兽药的分析。该方法设备简单,检验成本低,操作简便快速,但缺点是分离能力较差,检测灵敏度较低,不适合食品中MALs残留的微量分析。由于大环内酯类抗生素分子量比较大(一般都在500以上),且分子结构中大多带有多个极性基团,不能直接采用气相色谱方法检测,必须衍生后才可以用气质联用法检测。由于衍生过程繁琐,对于动物产品样品处理过程十分复杂,限制了该方法的应用。高效液相谱法检测大环内酯类抗生素尽管有些文献报导[2-4],检测器通常为紫外检测器。近年来液质联用法检测大环内酯类抗生素的研究比较活跃,用液相色谱-串联质谱法检测牛奶、蜂王浆、蜂蜜、鳗鱼、目鱼、河水中大环内酯类抗生素的方法已有报导[5-10]。
本课题利用液相色谱-串联质谱检测技术,研究建立肠衣中多种大环内酯类抗生素残留量的检测和确证方法。
1 材料与方法
1.1 主要仪器与装置
液相色谱-串联质谱仪:美国AB公司API4000,配有电喷雾离子源;固相萃取装置:Waters公司,12孔;HB-4型旋转蒸发器:IKA公司;LD5-2A离心机:转速4000 r/min 以上;均质器:美国 WARING,10000 r/min;氮吹仪:美国Organomation氮吹仪N-EVAPIII型,24孔。
1.2 主要材料与试剂
10 mmol/L乙酸胺溶液(pH 4.5),0.05 mol/L磷酸盐缓冲溶液(pH=8.5),0.25 mol/L磷酸盐缓冲溶液(pH=7.0)。C18固相萃取小柱(500 mg/6 mL),Oasis(HLB)固相萃取小柱(500 mg/6 mL),MCX固相萃取小柱(500 mg/6 mL)。螺旋霉素、替米考星、竹桃霉素磷酸盐、泰乐菌素酒石酸盐、红霉素、罗红霉素、交沙霉素标准品:纯度大于等于95%。
7种大环内酯标准储备溶液:分别称取经折算适量标准品,分别用甲醇溶解为浓度为100μg/mL,1℃~4℃冰箱保存,临用前根据需要用甲醇稀释适当浓度的工作液。
1.3 提取和净化
1.3.1 提取
称取5 g均匀试样(精确到0.01 g)置于50 mL具塞离心管中,加25 mL甲醇,涡旋,于4000 r/min离心3 min,将上层甲醇提取液收集于50 mL容量瓶中,再加20 mL甲醇,重复上述操作,合并甲醇提取液,加甲醇定容至50 mL。精密量取10 mL甲醇提取液于20 mL离心管中,在45℃以下水浴减压浓缩至近干,用15 mL磷酸盐缓冲溶液分次溶解残渣。
1.3.2 净化
Oasis(HLB)小柱(500 mg,6 mL,或相当者)依次用5 mL甲醇、5 mL水预洗。将提取液转移过HLB净化柱,弃去流出液,用 5 mL 水和 5 mL 甲醇-水(3∶7,体积比)依次洗涤离心管,洗涤液过HLB柱,弃去流出液,负压抽干,用6 mL甲醇洗脱。收集全部洗脱液,在45℃以下水浴减压浓缩至近干,加2 mL甲醇-水(1∶1,体积比)溶解,混匀,过0.22μm针筒滤膜,进LC-MS/MS分析。
1.4 仪器条件
1.4.1 液相色谱条件
液相色谱柱:ZORBAXEclipseC8柱,5μm,150mm×4.6 mm(i.d);流动相:B 组分是乙腈,A 组分是 0.15%甲酸水溶液;梯度洗脱程序:0→3.5min,A=70%→30%;3.5→8 min,A=30%;8→10 min,A=30%→70%;10→16 min,A=70%。流速:400μL/min;进样量:20μL。
1.4.2 质谱条件
离子源:电喷雾离子源。扫描方式:正离子扫描。检测方式:多反应选择离子检测(MRM)。分辩率:Q1和Q3均为单位分辨率。电喷雾电压:5500V。电喷雾电压(IS):4800 V;雾化气压力(GS1):42 Psi(即289.6×103Pa);气帘气压力(CUR):25 Psi(即172.4×103Pa);辅助气流速(GS2):45 Psi(即310.3×103Pa);离子源温度(TEM):540℃;碰撞气(CAD):6 Psi(即41.4×103Pa)。其它参数见表1。

表1 质谱参数Table 1 MS parameters
2 结果与讨论
2.1 色谱柱的选择
分别选用 ZORBAX Eclipse XDB-C85μm,4.6 mm×150 mm(i.d)、ZORBAX Eclipse XDB-C185μm,4.6 mm×150 mm(i.d),Lichrospher C18柱,5μm,4.6 mm×250 mm(i.d),结果表明各种色谱柱均适用,实验选定ZORBAX Eclipse XDB-C8(4.6 mm×150 mm、5μm)色谱柱。
2.2 流动相的选择
研究了甲醇-0.15%甲酸和乙腈-0.15%甲酸溶液两种流动相的色谱分离效果,结果表明乙腈-0.15%甲酸溶液作为流动相效果最好。
2.3 质谱条件的优化选择
分别采用7种大环内酯类兽药标准溶液在正离子模式下进行母离子全扫描,再对其子离子进行全扫描,对其质谱条件进行了一系列的优化,确定定性定量离子对,兼顾各成分灵敏度的不同而对离子源条件有所偏重,建立了最佳质谱条件。
2.4 样品提取溶剂的选择
大环内酯类兽药属于极性物质,易溶于甲醇、乙腈。试验结果表明,用乙腈、甲醇提取样品,大环内酯类兽药的回收率大于70%,两者没有显著差异,考虑到成本和毒性,本文选用甲醇提取方法。
2.5 净化条件的选择
试验了 C18、Oasis(HLB)和 MCX 固相萃取柱对样品中大环内酯类兽药残留的净化效果。C18和Oasis(HLB)两种净化柱效果较好,回收率在70%~110%之间。对MCX小柱,交沙霉素不能洗脱下来。综合考虑,实验选定Oasis(HLB)柱,淋洗条件为:5 mL水和5 mL甲醇-水(3+7,V/V)依次洗涤小柱,然后用6 mL甲醇洗脱。
2.6 线性范围
用7种大环内酯混合标准工作曲线溶液绘制成标准曲线用工作液,按上述色谱和质谱条件测定其峰面积,以质量浓度X(μg/kg)为横坐标,峰面积的比值Y为纵坐标,绘制7种大环内酯混合标准溶液工作曲线,计算回归方程和相关系数,见表2。

表2 线性方程Table 2 The linear equation
结果表明,7种大环内酯类药物浓度与对应的峰面积呈现良好的线性关系,线性范围:10μg/kg~250μg/kg。
2.7 检测低限
按所建立的色谱条件,以3倍噪音比作为检测低限,测得本方法7种大环内酯类药物的测定低限均为20μg/kg,满足国内和国际对大环内酯类药物残留监控的要求。
2.8 回收率与精密度
以不含大环内酯类药物残留的肠衣为空白样品,分别添加7种大环内酯混合标准溶液,添加浓度为20、100、200μg/kg 3个浓度水平,按照上述方法进行6次重复实验,测得回收率和精密度,回收率为70.9%~98.4%;相对标准偏差5.8%~17.8%。
肠衣空白样品和添加浓度为20μg/kg的样品的LC-MS/MS选择离子流图谱图见图1~图2。
保留时间(min):螺旋霉素(spiramycin)9.26 ,替米考星(tilmicosin)9.63,竹桃霉素(leandomycin)10.01,泰乐菌素(tylosin)10.17,红霉素(erythromycin)10.11,罗红霉素(roxithromycin)10.59,交沙霉素(josamycin)11.04。
2.9 样品检测
采用上述方法对出口保留的和市场上购买的10个猪肠衣样品检验,结果均为未检出。
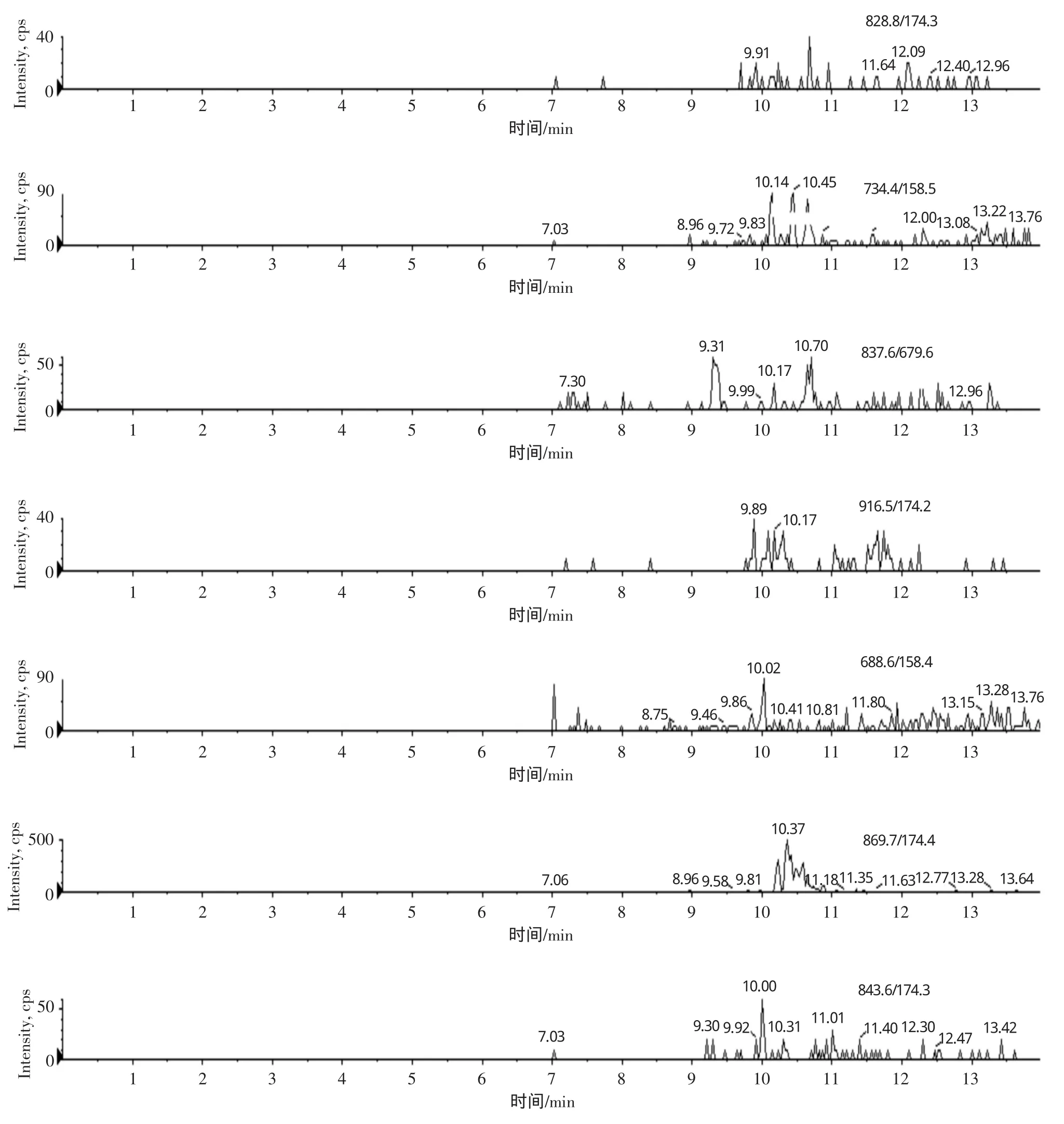
图1 空白肠衣样品的选择离子流图Fig.1 Selected ion chromatograms of macrolides in blank Pig Casing
3 结论
建立了肠衣中螺旋霉素、替米考星、竹桃霉素、泰乐菌素、红霉素、罗红霉素、交沙霉素等7种大环内酯类抗生素残留量的液相色谱-串联质谱测定方法。试样用甲醇提取,Oasis(HLB)固相萃取柱净化,以ZORBAX Eclipse C8(150 mm×4.6 mm,5μm)色谱柱,乙腈-0.15%甲酸水溶液为流动相,梯度洗脱,电喷雾、正离子扫描模式分离与检测7种大环内酯类抗生素残留量。通过对质谱条件的一系列优化,兼顾各成分的灵敏度,建立了最佳质谱分析条件。7种大环内酯类抗生素的检出限均为20μg/kg,平均回收率为70.9%~98.4%,相对标准偏差5.8%~17.8%。方法的技术指标满足国内外对肠衣中大环内酯类抗生素残留检测的有关要求。

图2 添加20μg/kg 7种大环内酯肠衣样品的选择离子流图Fig.2 Selected ion chromatograms of macrolides in spiked Pig Casing(20μg/kg)
[1]李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002:413-438
[2]NAOTO FURUSAWA.Normal-phase high-performance liquid chromatographic determination of spiramycin in eggs and chicken[J].Talanta,1999,49(2)461-465
[3]MARCODELIGUORO,PAOLAANFOSSI,ROBERTOANGELETTIC,et al.Determination of tylosin residues in pig tissues using high-performance liquid chromatography[J]Analyst,1998,123:1279-1282
[4]DUDRIKOVA,SOKOL JOZEF,NAGY JOZEF.Liquid chromatographic determination of tylosin in mastitic cow’s milk following therapy[J].Journal of AOAC international,1999,82(6):1303-1307
[5]谢丽琪,岳振峰,唐少冰,等.高效液相色谱串联质谱法测定牛奶中林可酰胺类和大环内酯类抗生素残留量的研究[J].分析试验室,2008,27(3):5-8
[6]谢文,丁慧瑛,奚君阳,等.蜂王浆产品中5种大环内酯类抗生素残留量的高效液相色谱-质谱/质谱检测方法[J].色谱,2007,25(3):404-407
[7]陈莹,陈辉,林谷园,等,超高效液相色谱串联质谱法对鳗鱼中大环内酯类、喹诺酮类和磺胺类兽药残留量的同时测定[J].分析测试学报,2008,27(5):538-541
[8]IAN WANG.Determination of five macrolide antibiotic residues in honey by LC-ESI-MS and LC-ESI-MS/MS[J].J Agric Food Chem,2004,52:171-181
[9]刘玉春,徐维海,余莉莉,等.固相萃取液相色谱-质谱/质谱联用测定河水中大环内酯类抗生素[J].分析测试学报2006,25(2):1-5
[10]NG-HWAN L,BEOM-SU J.Determination of roxithromycon resodies in the flounder muscle with electrospray liquid chromatography-mass spectrometry[J].Journal Chromatogr B,2000,746(2):219-225
