匹多莫德口服液佐治过敏性紫癜疗效观察
2012-12-01柏雅坤陈乔良吴雪兰
柏雅坤 陈乔良 吴雪兰
过敏性紫癜(HSP)是儿童常见的血管炎之一。临床可表现为非血小板减少性丘疹性紫癜、腹痛、关节炎、肾小球肾炎等[1]。由于部分病例易出现皮疹、腹痛、关节痛退而复现,以及肾脏或其他器官损害的迁延性,少数发展为慢性肾炎,死于慢性肾衰竭。故值得临床重视。现将我科2007年2月至2011年7月应用匹多莫德口服液佐治过敏性紫癜的168例患儿进行临床观察,现总结如下。
1 资料与方法
1.1 一般资料 168例患儿,男101例(60.1%),女67例(39.9%),男女之比为1.51∶1;年龄为2岁3月~14岁,以4~8岁发病最高,均符合美国风湿病协会制定的诊断标准[2]。随机分为两组,治疗组85例,男53例,女32例,年龄2岁3月~13岁8月;平均(5.62±2.68岁);对照组83例,男48例,女35例,年龄2岁5月~14岁;平均(5.58±2.67)岁,两组性别、年龄、临床分型等经统计学处理差异无统计学意义(P>0.05)。
1.2 方法 168例,除11例单纯性紫癜外,其余157例为关节型、腹型、肾型,均采用早期足量皮质类固醇激素治疗,132例先用氢化可的松琥珀酸钠静脉滴注,剂量为5~6 mg/(kg·d),5~7 d病情改善后逐渐减量,继之改为泼尼松口服;25例开始予泼尼松口服,剂量为0.4~0.8 mg/(kg·d);一般3~5 d后关节肿痛和腹痛消退后开始减量,整个疗程约1个月。所有患儿均给予抗组胺药,伴感染者加用抗生素治疗,胃肠道出血者用西咪替丁和止血剂,维生素C辅助用药。治疗组85例辅以匹多莫德口服液治疗。对照组不辅以匹多莫德口服液治疗。
2 结果
两组患者腹痛、关节痛、皮疹消退时间、住院天数及皮疹退而复现次数比较,见表1。
表1 (±s,d)
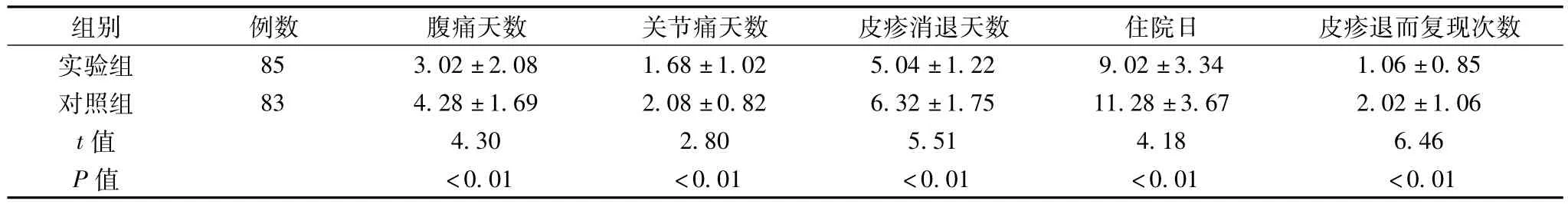
表1 (±s,d)
?
2.1 不良反应 未发现对匹多莫德过敏者,治疗中出现消化道症状,头痛,眩晕对照组5例,治疗组4例,嘱多喝水,未给其他特殊处理,无一例不良反应退出实验。两组比较差异无统计学意义。
3 讨论
过敏性紫癜是儿童时期最常见的血管炎之一。以非血小板减少性紫癜、关节炎或关节痛、腹痛、胃肠道出血及肾炎为主要临床表现。称为(Henoch-Schonlein Purpura,HSP),其发病机制至今尚未完全明确,多数学者认为,该病属于自身免疫介导的全身性血管炎。流行病学研究发现,感染(细菌、病毒、寄生虫等)、食物(牛奶、鸡蛋、鱼虾海鲜类等)、药物(抗生素、磺胺类、解热镇痛剂等)、花粉吸入、虫咬及预防接种等因素均可作为致敏因素,所诱发的免疫功能紊乱在过敏性紫癜的发病中占有重要地位。但是对过敏性紫癜免疫网络自身的调节机制及其在血管内皮损伤过程中的作用少有报道。研究发现过敏性紫癜患儿存在细胞免疫和体液免疫功能紊乱。T淋巴细胞在免疫应答和免疫调节中占有重要地位。T淋巴细胞按其细胞表面分化抗原分为CD4+细胞和CD8+细胞两大亚群,按免疫功能分为辅助性 T细胞(Th),抑制性T细胞(Ts),细胞毒性T细胞(Tc)亚群。根据受抗原或有丝分裂原刺激后所释放的淋巴因子类型的不同,Th细胞可分为Th1,Th2两大类。Th1细胞产生IFN-γ,IL-2和淋巴细胞毒素,诱导巨噬细胞介导的免疫反应,延迟超敏反应,有利于机体根据外来病原微生物的侵袭。Th2细胞则产生IL-4、IL-5、IL-9、IL-10、IL-13等细胞因子。与此相反,Th2细胞主要刺激抗体介导的反应,激活肥大细胞,释放IgE,组织嗜酸细胞增多,促进Ⅰ型超敏反应,同时通过负性调节机制抑制Th1细胞介导的细胞免疫反应。健康情况下,Th1∕Th2系统维持在一种相对平衡状态。较多临床研究证实,HSP患者体内IL-2水平下降,同时IL-6水平升高,提示HSP患者体内存在Th1受抑制,Th2细胞功能亢进,Th1∕Th2平衡状态失衡[3]。近年来研究证实B淋巴细胞多克隆活化为过敏性紫癜的特征,其机制为在炎症反应过程中,活化的CD4+T细胞通过过度表达膜蛋白CD40L,可与B细胞单核细胞CD40配体(CD40L)过度表达,促进B淋巴细胞分泌大量IgA和IgE[4,5]。约半数患儿在急性期时其血清IgA、IgM升高。
匹多莫德口服液是一种人工合成的免疫调节剂。主要成分是吡酮莫特,是一种全合成的胸腺二肽类结构的新型生物反应调节剂及免疫刺激调节剂,对动物和人类均有免疫刺激活性。体外研究显示,它能够显著下调由植物血凝素诱导的血单个核细胞IL-4等细胞因子的分泌,增加IFN-r和IL-12等Th1型细胞因子的分泌,从而调节Th1∕Th2细胞因子平衡[6]。匹多莫德可激活CD4+,促使其向Th1分化,从而调节Th1∕Th2细胞因子平衡[7]。从而达到诱导缓解过敏性紫癜的病理过程的目的。
近年关于链球菌感染导致过敏性紫癜的报道较多。多数患儿在发病前1~3 W常有上呼吸道感染史,有报道约50%过敏性紫癜患儿有链球菌呼吸道感染史,但随后研究发现有链球菌呼吸道感染史者在过敏性紫癜患儿和健康儿童之间并无差别。另有报道30%过敏性紫癜肾炎患儿肾小球系膜有A组溶血性链球菌抗原(肾炎相关性血浆素受体,NAPlr)沉积;而非过敏性紫癜肾炎的NAPlr沉积率仅为3%,表明A组溶血性链球菌感染是诱发过敏性紫癜的重要原因[8]。匹多莫德口服液能增强吞噬细胞的趋化和吞噬活性,激活自然杀伤细胞(NK),增强非特异性免疫功能,合用抗生素能有效治疗急性上下呼吸道感染。有效预防感染复发[9,10]。从而辅助治疗过敏性紫癜。
本研究观察到服用匹多莫德口服液后腹痛、关节痛天数,皮疹消退天数,住院日,皮疹退而复现次数较对照组明显降低,副作用小,偶见头痛、眩晕,腹泻胃肠道反应。故认为匹多莫德口服液为佐治过敏性紫癜安全、有效药物,值得临床推广使用。
[1]Roberts PF,Waller TA,Brinker TM,et al.Henoch-schonlein purpura:a review article.south med J,2007,100(8):821-824.
[2]Mills JA,michel BA,Bloch DA,et al.The American college of Rheumatology 1990 criteria for the classification of Henoch-schonlein purpura.Arthritis Rheum,1990,33(8):1114-1121.
[3]Horie R,Watanabe T.CD30:expression and function in health and disease.semin immunol,1998,10(6):457-458.
[4]金燕墚,周纬,徐玉珍,等.儿童过敏性紫癜与T细胞亚群研究.临床儿科杂志,2006,24(9):754-755.
[5]赵本胜,杨月亮,贾秀红.急性期过敏性紫癜患儿免疫功能的变化.。中国实用儿科杂志,1997,12(4):227.
[6]Burgio GR,Marseglia GL,Severi F,et al.Immunoaltivation by pidotimod in children with tecurrent respiratory infections.Arzneimittelforschung,1994,44(12A):1525-1529.
[7]刘恩梅,王莉佳,罗蓉,等.匹多莫德影响小儿辅助T细胞亚群功能的体外研究.儿科药学杂志,2004,10(5):1-2.
[8]沈晓明,王卫平.儿科学.第7版.北京:人民卫生出版社,2008:182.
[9]Garamia G,Clemente E,solli R,meiv,Leinfezzoni respiratory dell,infanzia:effetto cursive diprofilassldi untrattamento conpidotimod in press su:Arzneimittel-forschung.
[10]Arznein-Porsch∕ Drug Res.44(11).12a.1525-1579(1994).
