GDF-5诱导hADSCs分化为软骨样细胞
2012-12-01金长礼李德华李洪秀朴仁京
金长礼 李德华 李洪秀 朴仁京
软骨组织损伤及退变是常见疾病,由于其缺少血管和神经的支配,一旦损伤很难自身修复[1]。目前传统的手术切除或填充外源性假体,均无明显效果,而极易导致继发性骨软骨炎。随着组织工程学在修复和治疗领域的发展,为修复软骨组织损伤带来了新契机。种子细胞是组织工程学的首要因素,自体软骨细胞是目前惟一批准用于临床的种子细胞,但其存在来源受限、形成二次损伤、体外扩增困难、容易老化等缺点[2]。找到一种自体来源的软骨种子细胞意义重大。
2001年Zuk等[3]从人吸脂术的脂肪组织中分离出具有多向分化潜能的细胞群,命名为脂肪来源的间充质干细胞(human adipose derived stem cells,hADSCs),hADSCs可以自体取材,对机体损伤小、取材方便,单位体积组织内干细胞含量大,因此成为组织工程领域最具优势的种子细胞。但如何成功诱导hADSCs分化为软骨样细胞尚无定论,本研究旨在探索一种简单有效的诱导方案,使hADSCs成为软骨细胞的新来源。
1 材料与方法
1.1 组织来源 脂肪组织来自5例行腹部脂肪抽吸术的健康成年女性患者,年龄22~45岁,无传染病和内分泌疾病,并签署知情同意书,实验经医学伦理委员会批准。
1.2 主要试剂 低糖DMEM、高糖DMEM、胎牛血清、MTT、DMSO(Gibco);Ⅰ型胶原酶、胰蛋白酶、L-谷氨酰胺、L-脯氨酸、抗坏血酸、丙酮酸钠、地塞米松、胰岛素、甲苯胺蓝(Sigma);GDF-5(PeproTeeh Inc);兔多抗Ⅱ型胶原抗体、SABC试剂盒(博士德生物试剂公司)。
1.3 hADSCs的分离培养 取人抽脂术后的无菌脂肪组织,PBS浸泡冲洗以去除红细胞;加入2倍体积0.1%的Ⅰ型胶原酶,37℃水浴消化60 min,含10%胎牛血清的低糖-DMEM终止消化。4℃、2000 r/min离心10 min,低糖DMEM重悬沉淀,200目滤网过滤。4℃、2000r/min离心10 min,低糖DMEM重悬沉淀,移入培养瓶,37℃、5%CO2、饱和湿度条件下培养。24 h后首次换液,去除未贴壁细胞,之后每3 d换液1次,细胞达80%融合时传代培养。倒置相差显微镜下观察。
1.4 hADSCs的增殖活性检测 用MTT法检测细胞增殖活性。取P3、P5、P10的hADSCs,以1×104/ml的密度接种于96孔板,于37℃、5%CO2条件下培养。24 h后的连续5 d,每天同一时间,随机抽取一板,加入5 mg/ml的MTT(20 μl/孔),37℃孵育4 h,吸弃培养液,每孔加入150 μl的DMSO震荡10 min,酶标仪测定波长在570nm处的吸光值。以时间(d)为横轴,吸光值(OD)为纵轴,绘制生长曲线。
1.5 诱导hADSCs分化为软骨细胞 取P3的hADSCs,制成密度为106/ml的细胞悬液,接种于盖有玻片的6孔板,细胞达90%融合时更换软骨诱导培养液。按GDF浓度不同分3组:A,0 ng/mlGDF;B,50 ng/mlGDF;C,100 ng/mlGDF-5。另均含10-7mol/L地塞米松、37.5 mg/L抗坏血酸、1 μmol/L胰岛素,10%FBS 的 H-DMEM,37℃、5%CO2、饱和湿度条件下培养,每3 d换液,相差显微镜观察。
1.6 检测Ⅱ型胶原的表达 取诱导28 d的细胞爬片,4%多聚甲醛固定,0.1%Triton-100孵育,3%H2O2室温孵育,以消除内源性过氧化物酶活性。5%BSA封闭后加入兔多抗Ⅱ型胶原(1∶200),4℃过夜。滴加山羊抗兔的二抗37℃孵育30 min。滴加SABC试剂,37℃孵育30 min,DAB显色,苏木素复染,常规脱水,透明,封片,光镜下观察,以上步骤均用PBS冲洗。结果判定:细胞胞浆内可见不同程度的棕黄色颗粒为阳性表达。
1.7 甲苯胺蓝染色检测GAG 取诱导28 d细胞爬片,PBS漂洗2 min,4%多聚甲醛固定30 min。自来水冲洗15 min,蒸馏水洗5 min,加1%甲苯胺蓝2 h,95%乙醇去除多余染液。干燥后,中性树胶封片,光学显微镜下观察。
2 结果
2.1 hADSCs的形态学观察 原代培养的hADSCs接种24 h,可见少量细胞贴壁,细胞呈短梭形或多角形。3 d后细胞体积逐渐增大,呈长梭形,似成纤维细胞,呈涡轮状紧密排列。10 d左右细胞达到90%融合(图1)。传代细胞生长速度明显加快,3~5 d即达80%融合。10 d以后,增殖速度无明显减慢。

图1 原代培养10 d的hADSCs(100)
2.2 hADSCs的生长曲线 MTT结果显示hADSCs传代培养的第1~2天为潜伏期,2~4 d为指数增殖期细胞逐渐融合,第4天后进入平台期并达到峰值。P3,P5,P10细胞的生长曲线均呈“S”形(图2),统计分析数据表明3种不同代的hADSCs每天的OD值差异无统计学意义(P>0.05),表明多次传代的hADSCs增殖能力没有降低。
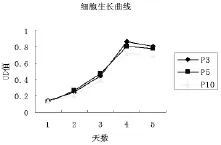
图2 细胞生长曲线
2.3 成软骨诱导后细胞的形态学观察 C组(100 ng/ml GDF-5)诱导7 d可见细胞由长梭形逐渐变为多角形,14 d大部分细胞变成圆形或者类圆形,21 d圆形细胞数量增加,在某些区域细胞聚集生长,形成软骨样结节(图3a)。而B组(50 ng/mlGDF-5)诱导10 d细胞逐渐变为多角形,21 d细胞形态逐步变为圆形或类圆形(图3b),形态改变相对滞后。
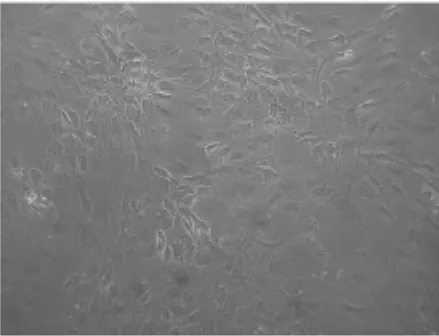
图3 a 诱导21 d细胞(C:100 ng/ml GDF-5组,100)
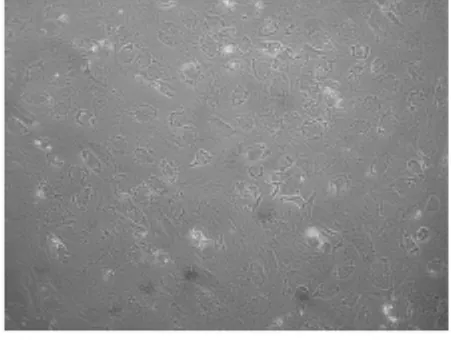
图3 b 诱导21 d细胞(C:100 ng/ml GDF-5组,100)
2.4 Ⅱ型胶原免疫细胞化学检测结果 诱导28 d的细胞行免疫细胞化学染色,可见细胞核蓝染,胞浆呈棕黄色,Ⅱ型胶原表达阳性。C组(100 ng/ml GDF-5)细胞着色深,表达阳性细胞数量多(图4a)。B组(50 ng/ml GDF-5)细胞着色浅,表达阳性细胞数量少(图4b)。

图4 a 免疫细胞化学染色(C:100 ng/ml GDF-5组,100)

图4 b 免疫细胞化学染色(B:50 ng/ml GDF-5组,100)
2.5 甲苯胺蓝染色检测GAG 诱导28 d细胞甲苯胺蓝染色,GAG表达阳性。C组(100 ng/ml GDF-5)蓝染细胞数量多,颜色深(图5a)。B组(50 ng/ml GDF-5)蓝染细胞数量少,颜色浅(图5b)。
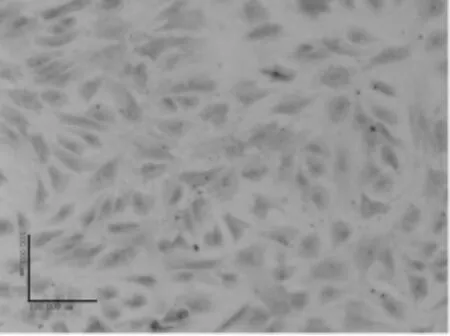
图5 a 甲苯胺蓝染色(C:100 ng/ml GDF-5组,100)

图5 b 甲苯胺蓝染色(B:50 ng/ml GDF-5组,100)
3 讨论
近年组织工程学为修复软骨组织损伤带来了新契机,种子细胞是组织工程学的首要因素,自体软骨细胞存在来源有限、二次损伤、体外扩增困难等缺点,无法广泛应用于临床,寻找新的软骨细胞来源尤为重要[4]。2001年Zuk等从人吸脂术的无菌脂肪组织中分离培养出hADSCs,其具有与BMSCs相似的多向分化潜能,可向骨、肌肉、脂肪、软骨和内皮等方向分化[3]。因其可以自身取材、分离培养简单方便、单位体积组织内干细胞含量大、分化表型可长期维持、衰老较为缓慢等优点,迅速成为组织工程学和再生医学等领域的研究热点,并取得了可喜的进展。本实验采用Ⅰ型胶原酶消化法分离培养hADSCs,接种24 h可见细胞贴壁,细胞呈短梭形或多角形。3 d后细胞体积增大,呈长梭形,可见核分裂相。7 d后细胞融合达到90%,细胞呈长梭形,形态、大小一致,呈涡轮状紧密排列。传代细胞生长形态均一,增殖能力强,P10代以后的增殖能力仅稍弱于P3代细胞。
在诱导hADSCs分化为软骨样细胞的诸多因素中,生长因子起到了决定性作用。常用于软骨诱导的生长因子有TGF-β、IGF-1、bFGF、BMP[5]等。其中 TGF-β 被公认为成软骨分化的特异性生长因子[6]。但hADSCs表面缺乏可以介导TGF-β信号传递的受体,无法被TGF-β诱导分化为软骨样细胞。生长分化因子5(growth differentiation factor 5,GDF-5)又称软骨形态发生蛋白-1(cartilage-derived morphogenetic protein-1,CDMP-1)或骨形态发生蛋白-14(bone morphogenetic protein,BMP-14),是TGF-β超家族中的一员,它可促进早期软骨和关节形成[7]。向大鼠损伤软骨组织内注射GDF-5的实验证明GDF-5可以促进软骨细胞分泌Ⅱ型胶原和细胞外基质中GAG的积累[8],本实验采用不同浓度的GDF-5来诱导hADSCs分化。其中诱导培养液中的地塞米松抑制hADSCs向脂肪样细胞分化,胰岛素是体外培养的细胞成活、有丝分裂、糖原合成必不可少的,色氨酸存在抑制有丝分裂的因子,BSA和脯氨酸作为细胞的营养成分,促进细胞合成胶原。丙酮酸钠是细胞培养中的替代碳源。谷胺酰胺可补充必需氨基酸,维生素C是抗氧化剂,可抑制或减少凋亡[9]。
通过3个诱导组的培养,观察发现C组的细胞由长梭形逐渐变为多角形甚至圆形或者类圆形的时间早于B组,而且圆形细胞数量也多,在某些区域细胞聚集生长,形成软骨样结节。而B组细胞的形态改变相对滞后。A组细胞形态无明显变化。GAG是软骨组织中含量最大的蛋白聚糖[10]。本实验对诱导28 d的细胞进行甲苯胺蓝染色,C组蓝染细胞数量多,颜色深。B组蓝染细胞数量少,颜色浅。Ⅱ型胶原是软骨细胞的特异性蛋白[11],经免疫细胞化学染色观察C组细胞胞浆呈棕黄色阳性表达,核蓝染,而且阳性表达的细胞数量多。B组细胞着色浅,阳性表达的细胞数量少。
综上所述,本实验从人抽脂术的无菌脂肪组织中成功分离培养hADSCs,获得细胞数量大、形态均一、体外增殖迅速,具有干细胞特性。50、100 ng/ml的 GDF-5可在体外诱导hADSCs分化为软骨样细胞,具有软骨细胞的形态,表达了软骨细胞特异性的蛋白和糖胺聚糖。而100 ng/ml GDF-5的诱导效果更显著。hADSCs可以作为软骨修复的种子细胞来源。此项研究为今后应用于软骨组织工程提供了种子细胞相关的参考依据。
[1]Maurizio Pacifici.Cellular and molecular mechanisms of synovial joint and articular cartilage formation.Ann N Y Acad Sci,2006,1068(4):74-86.
[2]Cindy Chung,Jason A,Burdick.Engineering cartilage tissue.Adv Drug Deliv Rev,2008,60(2):243-262.
[3]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies.Tissue Eng,2001,7(2):211-228.
[4]Steven B.Abramson,Mukundan Attur.Developments in the scientific understanding of osteoarthritis.Arthritis Research & Therapy,2009,11(9):227-35.
[5]Andre F,Steinert.Concepts in gene therapy for cartilage repair.Injury,2008,39(11):97-113.
[6]Benjamin D,Elder MS,Kyriacos A,et al.Assessment of growth factor treatment on.Biochemical and biomechanical properties of engineered articular cartilage constructs.Osteoarthritis Cartilage,2009,17(1):114-123.
[7]Gang Feng,Yuqing Wan.Adenovirus-mediated expression of growth and differentiationfactor-5 promotes chondrogenesis of adipose stem cells.Growth Factors,2008,26(3):132-142.
[8]Koichi Masuda.Biological repair of the degenerated intervertebral disc by the injection of growth factors.Eur Spine J,2008,17(4):441-451.
[9]Andrew J,Rosenbaum et al.The use of mesenchymal stem cells in tissue engineering.Organogenesis,2008,4(1):23-27.
[10]Tania Rozario,Douglas W,De Simone.The extracellular Matrix in development and morphogenesis:a dynamic view.Dev Biol,2010,341(1):126-140.
[11]Olsen AK,Sondergaard BC,Byrjalsen I,et al.Anabolic and catabolic function of chondrocyte exvivo is reflected by the metabolic processing of type II collagen.Osteoarthritis Cartilage,2007,15(9):335-342.
