医用镁合金仿生钝化技术研究进展
2012-11-30陶冶张永君
陶冶,张永君
(华南理工大学机械与汽车工程学院,广东 广州 510640)
医用镁合金仿生钝化技术研究进展
陶冶,张永君*
(华南理工大学机械与汽车工程学院,广东 广州 510640)
在医用镁合金功能化表面改性技术中,仿生钝化具有其他方法无可比拟的优越性。利用仿生钝化技术,可在镁合金表面原位制备兼具优异生物相容性、生物活性和降解控制功能的生物磷灰石膜层,全面满足镁合金生物医用对表面质量的苛刻要求。本文分别从前处理、钝化工艺、钝化后处理等方面,综述了医用镁合金仿生钝化技术的研究进展,并展望了医用镁合金仿生钝化技术的发展趋势。
医用镁合金;仿生钝化;羟基磷灰石
1 前言
与投入临床使用的各种金属植入材料相比,镁合金作为硬组织植入材料具有以下突出的优点[1-2]:优异的生物相容性、力学相容性和生物可降解性;密度与人体骨骼接近;比强度和比刚度高,可有效减小应力遮挡效应。但镁合金的耐蚀性较差,尤其在含Cl-离子的腐蚀介质中,其表面氧化膜会被破坏,导致腐蚀加剧[3]。因此,镁合金的表面改性处理对于镁合金的生物医用具有重要意义。羟基磷灰石[HA,Ca10(PO4)6(OH)2)]具有良好的化学稳定性和生物相容性,植入人体后与骨组织有较好的结合力[4]。但纯HA强度低、脆性大及抗疲劳性差等缺陷限制了其承重应用[5]。因此,在镁合金表面制备具有生物活性的 HA涂层,可集成镁合金的强度韧性和 HA的耐蚀及生物相容性,得到满足临床应用的人体硬组织修复替代材料。
目前,医用金属材料表面制备生物涂层的方法很多,主要有:仿生钝化[6-8]、微弧氧化[9]、电化学沉积[10]、等离子喷涂[11]、离子束辅助沉积[12]、溶胶–凝胶[13]等。与其他方法相比,仿生钝化法具有低温操作、工艺简单、生物相容性好[14]等优点,因此,越来越受关注。仿生钝化是模拟自然界中 HA的矿化过程,在自然温和的条件下于模拟体液(SBF)中自发沉积生物活性HA的方法[15]。该法首先使基片表面带上功能性基团,再浸入无机矿物溶液中使无机物在功能化表面上异相成核并受控生长[16]。其中,基片表面的预处理和浸泡溶液的成分对涂层生成的影响最为关键,这是因为预处理的效果直接决定了基片材料的表面异相形核能力;而浸泡溶液的pH、成分及浓度等直接影响磷灰石涂层的成分、结晶度和生长速率等[17]。
2 前处理工艺
2. 1 碱及碱热处理法
金属浸入碱溶液时,表面会形成水合凝胶层,该凝胶层包含许多不稳定的水和水合离子,经热处理可诱导形核。一旦形核,可吸收周围离子形成涂层[18]。
X. N. Xu等[19]将钙含量为1.4%的钙镁合金,分别用Na2HPO4、Na2CO3、NaHCO3处理24 h,再在空气气氛中500 °C处理12 h,最后将所有试样超声清洗并放入SBF溶液中测试。结果表明,3种试样的腐蚀速率顺序为:NaHCO3< Na2HPO4< Na2CO3。L. L. Tan等[20]先将AZ31镁合金用酒精浸泡10 min,再置于弱碱性的Na2HPO4溶液中60 °C处理,最后置于NaH2PO4·12H2O和Ca(NO3)2的混合溶液中70 °C下浸泡48 h,得到性能良好的钙磷涂层。
2. 2 酸碱二步处理法
龚沛[21]将纯镁置于1 mol/L HCl溶液中处理3 min后,再用0.5 mol/L NaOH溶液100 °C处理30 min,随后将试样进行预钙化处理,最后放入SBF中沉积。结果表明,酸碱处理后,纯镁表面变得粗糙多孔,同时多孔的表面有大量金属氧化物生成,有利于磷灰石的形成。
L. P. Xu等[22]先将Mg–Mn–Zn合金浸入63 °C的碱溶液中处理15 min,再用磷酸和硫酸的混合溶液活化5 ~ 10 s,最后将Mg–Mn–Zn合金放入磷化溶液中浸泡6 min,在表面获得一层具有生物活性的钙磷涂层。
2. 3 预钙化法
该法通过在金属基体表面引入大量的 Ca2+来加快磷酸钙晶核在表面的生长,从而缩短 HA涂层的生长周期。J. Hu等[23]以AZ91D镁合金为基体,先将试样放入0.17 mol/L Ca(NO3)2溶液中,随后向Ca(NO3)2溶液中滴加等量的0.1 mol/L K2HPO4溶液,滴加完后将试样置于混合液中浸泡3 h,最后将预钙化的试样放入37 °C的SBF溶液中分别浸泡不同时间,每24 h更换一次SBF溶液。结果表明,经预钙化处理的AZ91D表面生成一层磷酸氢钙水合物,该水合物不仅能在 SBF溶液中转化为HA,还可诱导HA在镁合金表面沉积。
2. 4 其他方法
G. Y. Liu等[24]先用微弧氧化(MAO)法在高纯镁表面得到MAO涂层,再放入27 °C的、由磁力搅拌的Ca(NO3)2和K2HPO4混合溶液中浸泡3 h,随后静置2 h,得到 HA和二水磷酸氢钙的混合涂层,此涂层表现出相当好的生物活性。郭洁等[25]的研究表明,经有机物热处理后,AZ91D镁合金在SBF及饱和钙磷溶液(CP)中时,HA的沉积速率和结晶度都优于碱热法处理。
3 钝化工艺
仿生钝化生成 HA涂层的原理及工艺虽然比较简单,但影响因素复杂。目前主要在钝化液成分、处理时间以及反应温度等方面控制涂层的生长。
3. 1 钝化液的pH
S. Hiromoto等[26]研究了pH对纯镁表面HA结晶度的影响。钝化液由浓度均为0.05 mol/L的Ca–EDTA和K2HPO4组成,用聚四氟乙烯容器装盛,钝化的工艺条件为95 °C、8 h,用1 mol/L NaOH溶液调节pH至5.4、6.3、7.3、11.3。结果表明,随着pH的升高,HA涂层的结晶度也相应增大。
3. 2 钝化液的成分
目前较常用的钝化液为SBF溶液,该溶液中各种离子的浓度与人体血浆中的离子浓度相近,但其配制必须按照一定的顺序,否则将会产生沉淀[27]。由于仿生钝化的目的是得到性能良好的HA涂层,为缩短制备时间及提高涂层性能,用于浸泡的模拟体液可与人体体液有较大的区别。表1为SBF、改性模拟体液(M-SBF)、CP 3种不同模拟体液的组成[27-29]。
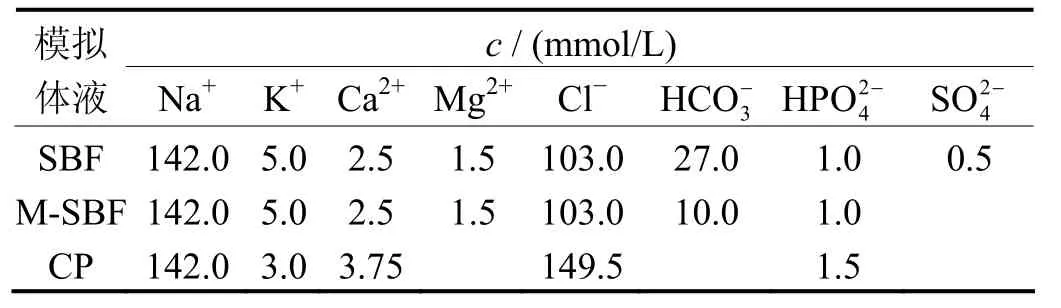
表1 不同模拟体液的离子浓度Table 1 Compositions of different simulated body fluids
C. Lorenz等[28]先将纯镁放入1 mol/L NaOH中处理24 h,随后放入M-SBF中浸泡5 d,最后进行细胞培养实验。结果表明,在M-SBF中浸泡后,纯镁表面生成一层粗糙的具有生物活性的无定形Ca/Mg磷酸盐涂层,经碱处理的纯镁能使细胞很好地附着在其表面。龚沛等[29]将预处理过的纯镁放入CP中,发现浸泡6 d后即可在纯镁基体表面制备均匀的HA涂层。
向钝化液中加入其他成分的离子,可生成含有该种成分的钙磷涂层,从而提高钙磷涂层的性能。S. S. Singh等[30]先用 3%的硝酸与酒精的混合溶液对 AZ31镁合金进行酸洗,随后在65 °C的50 g/L NaOH溶液中浸泡1 h并60 °C烘干,再置于钝化液中于37 °C下钝化2 h,最后60 °C下烘干得到含Ca、P、Si的涂层。细胞实验表明,含有硅酸盐的钙磷涂层使单纯钙磷涂层的生物相容性提高。钝化液组成为:CaCl23 mmol/L,硅酸盐0、0.3和0.6 mmol/L,NaH2PO41.8、1.5和1.2 mmol/L,n(Ca)/n(P+Si)恒为1.67。
另外,R. Štulajterová等[31]发现增大溶液中钙离子的浓度,可加快磷酸氢钙(DCPD)转化为羟基磷灰石的速率。
3. 3 处理时间及反应温度
M. Tomozawa等[32]研究了沉积时间对涂层耐蚀性的影响。首先用体积分数为8%的硝酸和1%的硫酸混合溶液对高纯镁进行抛光,然后在90 °C下钝化处理10 ~ 480 min,钝化液由浓度均为0.25 mol/L的Ca–EDTA和KH2PO4组成。结果表明,涂层的厚度随处理时间的延长而增大,耐蚀性也随之提高。文献[33]采用相同成分的钝化液,研究了Ca–EDTA浓度[n(Ca)/n(P+Si)恒为1∶1]和溶液温度对涂层的影响。结果表明,高于60 °C下处理所得涂层为HA,且Ca–EDTA浓度为0.25 mol/L时,在90 °C下处理2 h可得到均匀、致密且结晶度高的HA涂层。
4 后处理工艺
有时仿生钝化处理所得涂层成分为HA的前驱体,因此要通过后处理将其完全转化为 HA涂层。X. B. Chen等[34]先将高纯镁放入浓度均为 0.01 mol/L的Ca(NO3)2·4H2O和Na3PO4组成的混合溶液中65 °C处理2 min,再在80 °C下用10 g/L NaOH溶液浸泡60 min,在纯镁表面得到HA–Mg(OH)2涂层。另外,他们还通过软件计算出65 °C下Ca2+和pH对涂层成分影响的热力学图解。
5 发展趋势及展望
某些仿生钝化前处理方法存在一定的缺陷,如酸蚀会对医用镁合金的力学性能造成一定的破坏,这对人体硬组织植入材料来说十分不利。另外,不同的前处理对涂层沉积的影响也十分明显。因此,前处理的研究仍是一个重要的方向。
单纯使用仿生钝化法制得的生物涂层与合金之间的结合强度较低,且生长周期较慢。目前有些方法如电化学法,可快速制得 HA涂层,且涂层的结合强度也有所提高。因此,可考虑将仿生法作为前处理,结合其他生物涂层制备方法,从而得到结合强度高且生物活性好的涂层。
[1] 张佳, 宗阳, 付彭怀, 等. 镁合金在生物医用材料领域的应用及发展前景[J]. 中国组织工程研究与临床康复, 2009, 13 (29): 5747-5750.
[2] 黄晶晶, 任伊宾, 张炳春, 等. 镁及镁合金的生物相容性研究[J]. 稀有金属材料与工程, 2007, 36 (6): 1102-1105.
[3] 张永君, 严川伟, 王福会, 等. 镁的应用及其腐蚀与防护[J]. 材料保护, 2002, 35 (4): 4-6.
[4] 付涛, 徐可为. 仿生法沉积磷灰石层的研究进展[J]. 生物医学工程学杂志, 2001, 18 (1): 116-118.
[5] 崔忠波, 陈民芳. 医用金属材料表面仿生处理研究进展[J]. 天津理工大学学报, 2006, 22 (2): 18-22.
[6] IBASCO S, TAMIMI F, MESZAROS R, et al. Magnesium-sputtered titanium for the formation of bioactive coatings [J]. Acta Biomaterialia, 2009, 5 (6): 2338-2347.
[7] BARREREA F, BLITTERSWIJK C A V, GROOT K D, et al. Nucleation of biomimetic Ca–P coatings on Ti6Al4V from a SBF×5 solution: influence of magnesium [J]. Biomaterials, 2002, 23 (10): 2211-2220.
[8] TOMOZAWA M, HIROMOTO S. Microstructure of hydroxyapatite- and octacalcium phosphate-coatings formed on magnesium by a hydrothermal treatment at various pH values [J]. Acta Materialia, 2011, 59 (1): 355-363.
[9] 夏琦兴, 姚忠平, 张亚军, 等. 镁合金微弧氧化陶瓷膜的组织结构及耐腐蚀性能[J]. 材料保护, 2011, 44 (5): 14-16.
[10] WANG H X, GUAN S K, WANG X, et al. In vitro degradation and mechanical integrity of Mg–Zn–Ca alloy coated with Ca-deficient hydroxyapatite by the pulse electrodeposition process [J]. Acta Biomaterialia, 2010, 6 (5): 1743-1748.
[11] KWEH S W K, KHOR K A, CHEANG P. An in vitro investigation of plasma sprayed hydroxyapatite (HA) coatings produced with flamespheroidized feedstock [J]. Biomaterials, 2002, 23 (3): 775-785.
[12] RABIEI A, THOMAS B, NEVILLE B, et al. A novel technique for processing functionally graded HA coatings [J]. Materials Science and Engineering: C, 2007, 27 (3): 523-528.
[13] QI G C, ZHANG S, KHOR K A, et al. In vitro effect of magnesium inclusion in sol–gel derived apatite [J]. Thin Solid Films, 2008, 516 (16): 5176-5180.
[14] 刘通, 张永君. 医用镁合金降解控制技术的研究进展[J]. 材料导报, 2010, 24 (21): 86-89, 100.
[15] 李龙川. 纯镁表面改性与生物相容性的研究[D]. 重庆: 重庆大学, 2004.
[16] 付永昌, 刘强, 柳清菊. 基于生物矿化的仿生合成技术及其应用[J].材料导报, 2008, 22 (增刊3): 272-275.
[17] 郭洁. 通过仿生法在医用镁合金表面制备羟基磷灰石涂层的研究[D].湖北: 武汉理工大学, 2009.
[18] 宋云京, 李木森, 温树林. 仿生法制备生物陶瓷涂层的最新研究进展[J].材料导报, 2002, 16 (5): 33-35.
[19] GU X N, ZHENG W, CHENG Y, et al. A study on alkaline heat treated Mg–Ca alloy for the control of the biocorrosion rate [J]. Acta Biomaterialia, 2009, 5 (7): 2790-2799.
[20] TAN L L, WANG Q, GENG F, et al. Preparation and characterization of Ca–P coating on AZ31 magnesium alloy [J]. Transactions of Nonferrous Metals Society of China, 2010, 20 (2): s648-s654.
[21] 龚沛. 通过仿生法在纯镁表面制备磷灰石涂层的研究[D]. 湖北: 武汉理工大学, 2008: 19-26.
[22] XU L P, PAN F, YU G N, et al. In vitro and in vivo evaluation of the surface bioactivity of a calcium phosphate coated magnesium alloy [J]. Biomaterials, 2009, 30 (8): 1512-1523.
[23] HU J, WANG C, REN W C, et al. Microstructure evolution and corrosion mechanism of dicalcium phosphate dihydrate coating on magnesium alloy in simulated body fluid [J]. Materials Chemistry and Physics, 2010, 119 (1/2): 294-298.
[24] LIU G Y, HU J, DING Z K, et al. Bioactive calcium phosphate coating formed on micro-arc oxidized magnesium by chemical deposition [J]. Applied Surface Science, 2011, 257 (6): 2051-2057.
[25] 郭洁, 王欣宇, 唐舟, 等. 通过仿生法在镁合金表面制备羟基磷灰石涂层的研究[J]. 现代生物医学进展, 2009, 9 (12): 2267-2269.
[26] HIROMOTO S, YAMAMOTO A. High corrosion resistance of magnesium coated with hydroxyapatite directly synthesized in an aqueous solution [J]. Electrochimica Acta, 2009, 54 (27): 7085-7093.
[27] KOKUBO T, TAKADAMA H. How useful is SBF in predicting in vivo bone bioactivity? [J]. Biomaterials, 2006, 27 (15): 2907-2915.
[28] LORENZ C, BRUNNER J G, KOLLMANNSBERGER P, et al. Effect of surface pre-treatments on biocompatibility of magnesium [J]. Acta Biomaterialia, 2009, 5 (7): 2783-2789.
[29] 龚沛, 王欣宇, 郭洁. 通过仿生法在纯镁表面制备羟基磷灰石涂层的研究[J]. 化工中间体, 2008 (3): 17-20.
[30] SINGH S S, ROY A, LEE B, et al. Aqueous deposition of calcium phosphates and silicate substituted calcium phosphates on magnesium alloys [J]. Materials Science and Engineering: B, 2011, 176 (20): 1695-1702.
[31] ŠTULAJTEROVÁ R, MEDVECKÝ Ĺ. Effect of calcium ions on transformation brushite to hydroxyapatite in aqueous solutions [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2008, 316 (1/3): 104-109.
[32] TOMOZAWA M, HIROMOTO S. Growth mechanism of hydroxyapatitecoatings formed on pure magnesium and corrosion behavior of the coated magnesium [J]. Applied Surface Science, 2011, 257 (19): 8253-8257.
[33] TOMOZAWA M, HIROMOTO S, HARADA Y. Microstructure of hydroxyapatite-coated magnesium prepared in aqueous solution [J]. Surface and Coatings Technology, 2010, 204 (20): 3243-3247.
[34] CHEN X B, BIRBILIS N, ABBOTT T B. A simple route towards a hydroxyapatite–Mg(OH)2conversion coating for magnesium [J]. Corrosion Science, 2011, 53 (6): 2263-2268.
[ 编辑:周新莉 ]
Research progress of biomimetic passivation of magnesium alloys for biomedical applications //
TAO Ye, ZHANG Yong-jun*
Among the functionalization of surface modification techniques of medical magnesium alloy, biomimetic passivation has incomparable advantage over other methods. Biological apatite film which has excellent bioactivity, biocompatibility, and anticorrosion function can be formed on in-situ surface of magnesium alloy by biomimetic passivation, completely meeting the strict requirements of surface quality of magnesium alloy for biomedical use. The research progress of biomimetic passivation of magnesium alloys for biomedical applications was reviewed in aspects of pretreatment, passivation process, and post-treatment. The development trend of biomimetic passivation technology was prospected.
biomedical magnesium alloy; biomimetic passivation; hydroxyapatite
School of Mechanical and Automotive Engineering, South China University of Technology, Guangzhou 510640, China
R318.08; TG178
A
1004 – 227X (2012) 03 – 0039 – 04
2011–10–09
2011–10–31。
国家自然科学基金资助项目(30700179);中央高校基本科研业务费专项资金资助重点项目(2009ZZ0063)。
陶冶(1988–),男,湖北黄冈人,在读硕士研究生,主要研究方向为材料腐蚀与防护。
张永君,副教授,(E-mail) zhangyj@scut.edu.cn。
