木香肝毒性组分筛查与GC-MS分析研究
2012-11-29赵筱萍王书芳
赵筱萍,陆 琳,胡 斌,王书芳
(1.天津中医药大学,天津 300193;2.浙江中医药大学,浙江 杭州 310053;3.浙江大学药学院,浙江 杭州 310058)
木香是菊科植物木香(Aucklandia lappa Decne.)的干燥根,具有调节胃肠运动、抗消化性溃疡、抗炎、扩张血管及抗肿瘤等诸多药理活性[1-2]。中医认为,木香的功效是行气止痛、健脾消食等。有报道称,长期使用木香包合物可引起动物肝和肾毒性[3]。为此,有必要对中药材木香中潜在的毒性组分进行筛查,研究其可能含有的肝和肾毒性物质。本研究采用二乙酸荧光素荧光标记的细胞模型,对木香提取物中25个化学组分进行了肝毒性快速筛查,发现其中10个组分对人肝癌细胞(HepG2)具有明显的毒性;经气相色谱-质谱联用定性分析,C09组分的主要成分为去氢木香内酯、santamarine(或magnolialide)和 reynosin,而 C11组分的主要成分是α-木香醇和榄香醇。
1 材料与方法
1.1 仪器及材料 细胞荧光显微成像平台(浙江大学药物信息学研究所开发);酶标仪(Bio-Tek ELX800,美国宝特);Agilent 6890N/5973N气相色谱-质谱联用仪(美国Agilent公司),另配有 Agilent 7683自动进样器、NIST 2002质谱数据库和Agilent色谱工作站。
HepG2(上海细胞库);DMEM培养基、胎牛血清(Gibco公司);二甲基亚砜、胰蛋白酶(Sigma公司);二乙酸荧光素(Fluorescein diacetate,FDA,碧云天生物技术研究所);96孔细胞培养板(Corning公司);甲醇、无水乙醇、乙酸乙酯为分析醇(国药集团);甲醇为色谱纯(德国默克公司);高纯水来自Milli-Q超纯水系统(美国Millipore公司);去氢木香内酯(上海融禾医药科技发展有限公司)。
木香化学组分样品共25个(采用标准组分制备法提取分离获得)[4]。
1.2 方法
1.2.1 肝毒性组分的筛查 待测组分溶于DMSO中,得50 mg/ml储备液,与细胞孵育的终质量浓度为 50 μg/ml。取对数生长期的HepG2细胞,以3 000个/孔接种于96孔板中,贴壁生长24 h后加入待筛查组分,共孵育48 h后采用FDA荧光标记法检测细胞活力[4],计算细胞的存活率并判定待筛查组分的毒性[5],当细胞存活率低于20%时,表明该组分具有明显毒性。另设溶剂对照组(0.1%DMSO),各试验组平行3份。
1.2.2 GC-MS 分析 Agilent DB-5MS 毛细管柱(0.25 mm ×30 m ×0.25 μm);载气:高纯氦气,流速0.8 ml/min;升温程序:柱始温50℃,以10℃/min程序升温至150℃保持10 min,以5℃/min程序升温至 200℃ 保持 10 min,以10℃/min程序升温至300℃保持5 min;进样口温度300℃,不分流进样,进样量为2μL。质谱为EI(electron ionization)离子源,离子源温度为230℃;电离电压:70 eV;四级杆温度:150℃;扫描模式:全扫描,40 ~600 m/z。
2 结果
2.1 肝毒性组分的筛查 将木香药材中分离所得的25个组分分别加入HepG2细胞中孵育,采用FDA荧光标记法筛查其中的肝毒性组分。图1示A组分中有4个组分具有明显毒性,分别为 A01、A05、A08 及 A09,细胞存活率依次为 0.28% ± 0.11%、0.37% ± 0.37%、13.50% ±2.11%及0.29% ±0.08%;B 组分中B12组分具有明显毒性,细胞存活率为8.95%±1.61%;C组分中有5个组分具有明显毒性,分别为 C05、C06、C08、C09 及 C11,细胞存活率依次为 7.65% ± 1.27%、0.26% ± 0.04%、0.22% ±0.14%、0.51% ± 0.09% 及 0.02% ±0.01%。其中溶剂对照、C09及C11组分的细胞荧光显微图像见图2。
2.2 GC-MS分析 对木香肝毒性组分中低极性组分 C09、C11进行 GC-MS分析,其中 C09组分的总离子流图见图3。化合物Ⅰ的保留时间为35.39 min,经质谱数据库检索并与标准品对照,鉴定为去氢木香内酯(dehydrocostuslactone)。化合物Ⅱ、Ⅲ各主要碎片及相对丰度与文献[6]报道基本一致,推测化合物Ⅱ为santamarine(或 magnolialide),化合物 Ⅲ 为reynosin。化合物Ⅳ经质谱数据库检索,匹配度较低,有待进一步分析。采用面积归一化法确定化合物Ⅰ、Ⅱ和Ⅲ的相对百分含量分别为39.01%、11.76% 和 9.04%。C11 组分的总离子流图见图4,根据化合物Ⅴ、Ⅵ质谱图、质谱数据库检索结合文献推测化合物Ⅴ和Ⅵ分别为α-木香醇(α-costol)和榄香醇(elemol)[6-7],采用面积归一化法确定其相对百分含量分别为42.39%和 10.40%。
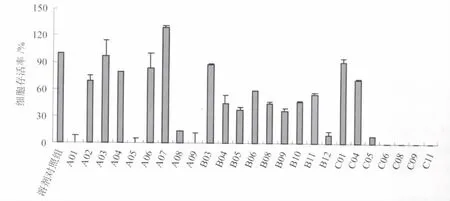
图1 木香中肝毒性组分筛查结果Fig.1 Screening hepatotoxic fractions from Aucklandiae Radix

图2 溶剂对照(A)、C09组分(B)和C11组分(C)的细胞荧光显微成像图Fig.2 Fluorescence images of cells treated by vehicle control(A),C09 fraction(B)and C11 fraction(C)

图3 C09组分和去氢木香内酯的总离子流图Fig.3 The total ion chromatogram of C09 fraction and dehydrocostuslactone
3 讨论
对筛查出的2个具有明显肝毒性的低极性组分作GC-MS分析,结果表明C09组分的主要成分为去氢木香内酯、santamarine(或magnolialide)和reynosin,而C11组分的主要成分是α-木香醇和榄香醇。这提示上述5个化学成分可能引起肝毒性。
去氢木香内酯、santamarine和 reynosin都属于倍半萜类化合物,木香中的此类成分对肿瘤细胞有较强的细胞毒作用,具有抗肿瘤的活性[8-9],Sun 等证实去氢木香内酯、santamarine和reynosin对HepG2细胞有杀伤作用,半数致死量分别为 3.5 μg/ml、7.5 μg/ml和 11.0 μg/ml[9]。构效关系研究认为,该类成分结构中存在α、β不饱和的γ-内酯环,能与巯基发生快速迈克尔加成反应,降低细胞内GSH含量,并对细胞内含巯基的蛋白产生氧化损伤作用[10-11]。这可以解释C09组分产生明显毒性的原因。而C11组分中的α-木香醇和榄香醇也是倍半萜类化合物,但不含有α、β不饱和的γ-内酯环样结构,其可能引起肝毒性的作用机制还有待进一步研究。
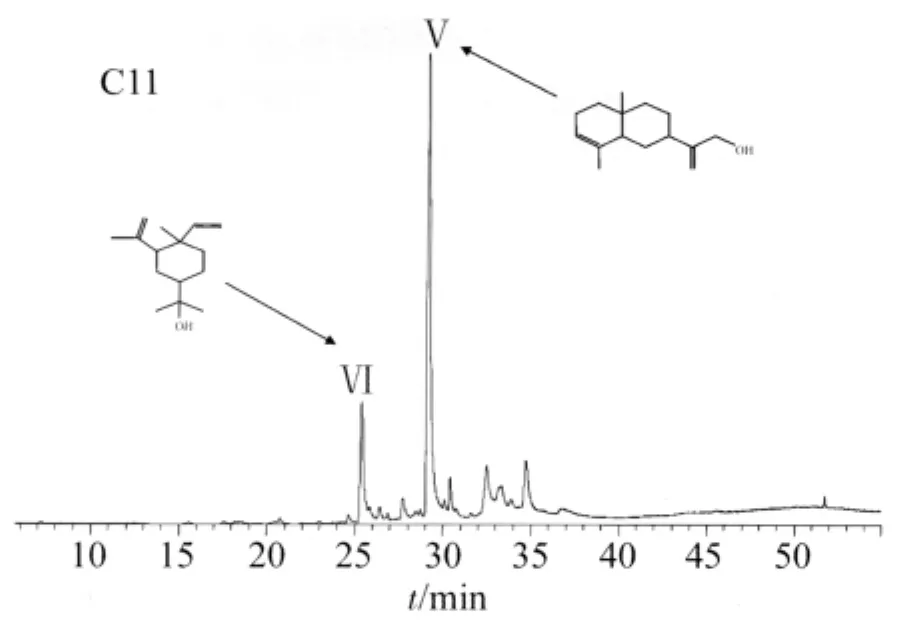
图4 C11组分的总离子流图Fig.4 The total ion chromatogram of C11 fraction
[1]LIN Ming-xia(林 明 侠).Pharmacological and clinical research survey on Radix Aucklandiae[J].(中医药信息),2005(3):18-19.(in Chinese)
[2]WANG Xu-ying,JIA Xiao-bin,CHEN Yan(王绪颖,贾晓斌,陈 彦).Research advances of the several muxiang raw materials[J].Journal of Chinese Medicinal Materials(中药材),2010,33(1):153-157.(in Chinese)
[3]FENG Guo-zheng,WANG Chun-hua,MA Xiu-jun,et al(封国峥,王春华,马秀军,等).Effects of CLA-ALD on long-term text in rats and beagle-dogs[J].(辽宁中医杂志),2007(6):847-850.(in Chinese)
[4]JINY C,ZHAO X P,ZHANG Y F,et al.A threestage-integrative approach for the identification of potential hepatotoxic compounds from botanical products[J].Int J Toxicol,2011,30(3):287-299.
[5]ZHAO Xiao-ping,LU Lin,ZHANG Yu-feng,et al(赵筱萍,陆 琳,张玉峰,等).Study on discriminating nephrotoxic components in zexie[J].China Journal of Chinese Materia Medica(中国中药杂志),2011,36(6):758-761.(in Chinese)
[6]YANG Hui,XIE Jin-lun,SUN Han-dong(杨 辉,谢金伦,孙汉董).Study on chemical constituents of saussurea lappa[J].(云南植物研究),1997,19(1):85-91.(in Chinese)
[7]YANG Hui,XIE Jin-lun,SUN Han-dong(杨 辉,谢金伦,孙汉董).Research progress on the medicinal plant-Saussurea lappa [J].Natural Product Research and Development(天然产物研究与开发),1998,10(2):90-98.(in Chinese)
[8]WANG Lu,ZHAO Feng,HE En-qi,et al(王 潞,赵 烽,何 恩 其).Effects of eighteen sesquiterpenes from Saussurea lappa on the proliferation of six human cancer cell lines[J].Nat Prod R es Dev(天然产物研究与开发),2008,20(5):808-812.
[9]SUN C M,SYU W J,DON M J,et al.Cytotoxic sesquiterpene lactones from the root of Saussurea lappa[J].J Nat Prod,2003,66(9):1175-1180.
[10]BUTTURINI E,CAVALIERI E,DE PRATI A C,et al. Two naturally occurring terpenes,dehydrocostuslactone and costunolide,decrease intracellular GSH content and inhibit STAT3 activation[J].PloS One,2011,6(5).:e20174.
[11]DEVDUTT C.Opportunity,challenge and scope of natural products in medicinal chemistry[M].India:Research Signpost,2011:313-334.
