雷洛昔芬对绝经期后乳腺癌VEGF、Ki-67、CD34抗原表达的影响
2012-11-28侍晓辰张卫东周仕萍
侍晓辰 张卫东 周仕萍
乳腺肿瘤的生长、转移与肿瘤细胞的增殖活性及肿瘤血管的形成密切相关[1]。雷洛昔芬是第2代选择性雌激素受体调节剂(selective estrogen recep⁃tor modulator,SERM),与第1代他莫昔芬相比,它们对降低高危女性乳腺癌的发病率效果相当[2];但雷洛昔芬可降低血脂、预防及治疗骨质疏松,在治疗剂量下不升高子宫内膜癌的发病率[3]。最近国外有文献报道,雷洛昔芬可降低乳腺肿瘤细胞的增殖活性[4],但关于雷洛昔芬抗血管形成作用的研究尚少见。本文旨在对采用雷洛昔芬治疗的绝经期后乳腺癌患者进行观察,探讨雷洛昔芬对乳腺癌血管内皮生长因子(VEGF)、Ki-67、CD34 抗原表达的影响。
1 资料与方法
1.1 一般资料 选取2008年1月—2010年12月于无锡市中医医院乳腺外科就诊且病理确诊的女性乳腺癌患者20例,年龄52~81岁,平均(63.6±9.3)岁;肿瘤直径3~5 cm,平均(3.4±0.5)cm。入选标准:绝经1年以上;既往无乳腺癌放、化疗史;根据国际抗癌联盟TNM分期法(2003)乳腺癌Ⅱ期;组织学类型为浸润性导管癌;雌激素受体(estrogen receptor,ER)阳性。
1.2 方法 对患者进行严格的病史询问、全身体检、B超及钼靶片检查;怀疑恶性肿瘤者采用脉默通活检系统(美国强生公司)行组织病理学检查及免疫组化检测,确诊为乳腺浸润性导管癌且ER阳性者,签署治疗知情同意书后,予雷洛昔芬60 mg/d,连续服药21 d后行乳腺癌改良根治术,术后再次行病理学检查及免疫组化检测。组织标本以10%福尔马林浸泡,石蜡包埋,5μm厚连续切片,免疫组化检测主要试剂为鼠抗人VEGF单抗(Da Ko公司);鼠抗人Ki-67、CD-34单抗(Santa Cruz公司);S-P试剂盒与DAB显色剂(福建迈新公司),染色程序按试剂盒说明进行。以PBS代替一抗设立阴性对照。
1.3 观察指标及结果判定 (1)VEGF阳性判定标准:VEGF阳性细胞以细胞质中出现特异性染色为标准,每张切片由2名病理医师双盲观测5个400倍镜视野,以染色强度计分,与阴性对照相同计0分,淡黄色、棕黄色、黄褐色分别计1、2及3分;再以阳性细胞比例计分,全部阴性0分,1%~25%,26%~75%,76%~100%细胞数阳性分别计1、2、3分,两项得分相加,≥3分判定为阳性。(2)Ki-67阳性细胞百分数判定:Ki-67阳性细胞以细胞核出现棕黄色染色为标准,每张切片由2名病理医师在400倍镜视野下双盲计数1 000个细胞,自Ki-67阳性表达最强区域开始计数,计算染色细胞百分比,取平均值。(3)微血管密度(microvessel density,MVD)判定:根据Weidner标准[5],被CD34单抗染成棕色或棕黄色的单个内皮细胞或内皮细胞群者,作为一个微血管单位,先在40倍镜观察全视野,选出5个血管丰富的“热区”,2名病理医师在400倍镜视野下双盲计数染色的微血管3次,取平均值。
1.4 统计学方法 采用SPSS13.0统计学软件进行数据处理,雷洛昔芬治疗前后的配对计数资料比较采用Mc Nemar’s检验,配对计量资料组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 雷洛昔芬对乳腺癌VEGF的表达的影响 3例治疗前VEGF阴性患者治疗后仍为阴性。17例(85%)治疗前VEGF阳性的患者中,11例治疗后VEGF转阴,6例(30%)仍为阳性。治疗前后阳性率比较差异有统计学意义(χ2=12.38,P<0.01)。雷洛昔芬治疗前组织标本中可见大量棕色的VEGF阳性细胞,见图1a;治疗后染色细胞明显减少,且染色变浅,见图1b。
2.2 雷洛昔芬对乳腺癌Ki-67表达的影响 雷洛昔芬治疗前Ki-67阳性细胞的百分数为(19.36±1.66)%,组织标本中可见大量棕黄色的Ki-67阳性细胞,见图2a;治疗后Ki-67阳性细胞的百分数下降至(12.24±1.42)%,组织标本中棕黄色的Ki-67阳性细胞明显减少,治疗前后阳性率比较差异有统计学意义(t=2.86,P<0.01),见图2b。
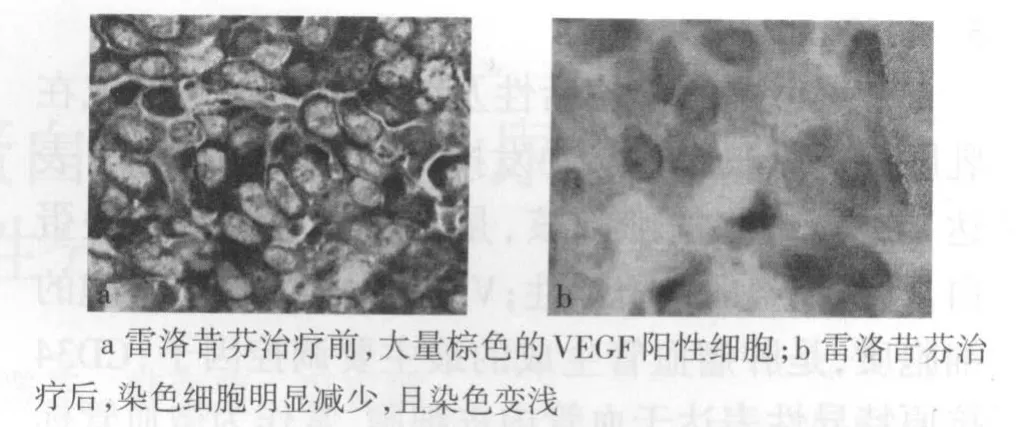
Figure1 Immunohistochemical expression VEGF(SP×400)图1 VEGF表达的免疫组化定位(SP×400)
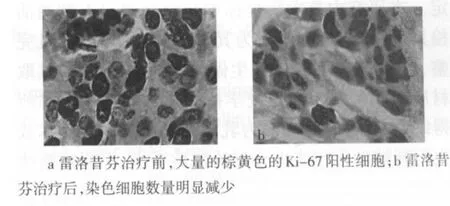
Figure2 Immunohistochemical expression of Ki-67(SP×400)图2 Ki-67表达的免疫组化定位(SP×400)
2.3 雷洛昔芬对乳腺癌CD34表达的影响 雷洛昔芬治疗前CD34抗原标记的肿瘤微血管数量为46.25±3.88;组织标本中可见较多棕黄色的血管内皮细胞或内皮细胞簇,见图3a;治疗后肿瘤微血管数量下降至23.64±1.53,组织标本中棕黄色的血管内皮细胞或内皮细胞簇明显减少,治疗前后肿瘤微血管数量差异有统计学意义(t=2.93,P<0.01),见图3b。
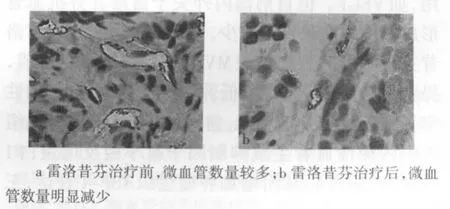
Figure3 Immunohistochemical expression of CD34(SP×400)图3 CD34表达的免疫组化定位(SP×400)
3 讨论
肿瘤细胞的增殖活性及肿瘤的微血管形成在乳腺癌的生长和转移中发挥核心作用[1]。Ki-67表达于肿瘤细胞的细胞核,是一种细胞增殖相关蛋白,反映细胞的增殖活性;VEGF表达于肿瘤细胞的细胞质,是肿瘤血管生成的最主要调控因子;CD34抗原特异性表达于血管内皮细胞,常作为微血管标记物。
雷洛昔芬可用于乳腺癌的内分泌治疗,也可作为乳腺癌高危人群的预防性用药,其常用剂量为60 mg/d[2]。国外2项关于雷洛昔芬对乳腺癌作用的临床试验中的用药时间分别为14 d和22 d[4,6]。本研究选择的用药时间为21 d,是根据我院门诊病理回报至患者住院检查并手术的等待时间为21 d所设定。本研究中首次病理标本获取是通过麦默通活检系统,主要考虑原因为其抽取的标本量大,且完整、连续,方便病理科医生做出组织学报告;对其取材所得病理诊断和免疫学指标与常规手术取样所得结论一致;且对确诊为乳腺癌的患者再行手术或先行新辅助化疗或内分泌治疗后手术,不影响整体疗效[7]。
Lopes-Costa等[4,6]报道雷洛昔芬可抑制乳腺癌细胞的增殖活性。本研究显示雷洛昔芬可降低乳腺癌组织Ki-67阳性细胞百分数,抑制肿瘤细胞增殖活性,与上述文献报道一致。此外,Dowsett等[6]研究显示,雷洛昔芬只抑制ER阳性的乳腺癌细胞增殖活性,因而本组研究选择对象均为ER阳性。Blackwell等[8]报道他莫昔芬具有抑制乳腺肿瘤组织血管形成的作用,他莫昔芬的抗血管形成效应在ER阴性的动物模型中依然存在,并且认为药物作用并非完全依赖ER,可能是对促血管形成因子的直接作用,如VEGF。但目前国内外关于雷洛昔芬抗血管形成作用的文献报道较少。本研究结果显示,雷洛昔芬可降低乳腺癌组织MVD,抑制肿瘤血管形成,提示雷洛昔芬可明显降低乳腺癌组织的VEGF阳性率。Mirkin等[9]研究显示,雷洛昔芬可上调乳腺癌组织中内源性血管生成抑制因子血小板反应蛋白1(TSP-1)mRNA,从而增加肿瘤组织TSP-1表达;王红超等[10]研究认为,肿瘤血管生成是促血管生成因子和血管生成抑制因子相互作用的结果,乳腺癌组织TSP-1表达增强,可影响VEGF的表达强度,降低肿瘤组织MVD,抑制肿瘤血管形成。
综上所述,雷洛昔芬60 mg/d治疗21 d可抑制乳腺癌细胞的增殖活性及微血管形成,降低肿瘤组织VEGF的阳性率,但其间的相互关系及机制仍需进一步研究加以论证。本研究结果也为进一步探讨肿瘤细胞的增殖与微血管形成间的相关性,以及VEGF的靶向治疗提供一定的参考。
[1]Shivakumar S,Prabhakar BT,Jayashree K,etal.Evaluation of se⁃rumvascular endothelial growth factor(VEGF)and microvessel den⁃sity(MVD)as prognostic indicators in carcinoma breast[J].JCancer Res Clin Oncol,2009,135(4):627-636.
[2]Cuzik J,DeCensi A,Arun B,etal.Preventivetherapy for breast can⁃cer:aconsensusstatement[J].Lancet Oncol,2011,12(5):496-503.
[3]Palacios S.Selective estrogen receptor modulators:the future in menopausal treatment[J].Minerva Ginecol,2011,63(3):275-286.
[4]Lopes-Costa PV,dos Santos AR,dos Santos LG,etal.Evaluation of Ki-67 and Bcl-2 antigen expression in breast carcinomas of women treated with raloxifene[J].Cell Proliferation,2010,43(2):124-129.
[5]Weidner N,Folkman J,Pozza F,etal.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma[J].JNatl Cancer Inst,1992,84(24):1875-1887.
[6]Dowsett M,Bundred NJ,Decensi A,etal.Effect of raloxifene on breast cancer cell Ki67 and apoptosis:a double-blind,place⁃bo-controlled,randomized clinical trial in postmenopausal patients[J].Cancer Epidemiol Biomarkers Prev,2001,10(9):961-966.
[7]顾军,于泽平,王少华,等.麦默通微创活检系统对乳腺肿块诊断的应用价值[J].医学研究生学报,2010,23(3):279-281.
[8]Blackwell KL,Haroon ZA,Shan S,etal.Dewhirst MW:Tamoxifen inhibits angiogenesis in estrogen receptor-negative animal model[J].Clin Cancer Res,2000,6(11):4359-4364.
[9]Mirkin S,Wong BC,Archer DF.Effects of 17beta-estradiol,proges⁃terone,synthetic progestins,tibolone,and raloxifene on vascular en⁃dothelial growth factor and Thrombospondin-1 messenger RNA in breast cancer cells[J].Int JGynecol Cancer,2006,16(2):560-563.
[10]王红超,李海平,范忠林,等.血小板反应蛋白1在乳腺癌中的表达及意义[J].天津医药,2009,37(10):826-827.
