光谱法研究顺铂与溶菌酶的相互作用
2012-11-28张洪峰魏亚超
陈 晨,张洪峰,王 乐,魏亚超,李 倩
(邯郸市中心医院药剂科,河北邯郸 056001)
光谱法研究顺铂与溶菌酶的相互作用
陈 晨*,张洪峰,王 乐,魏亚超,李 倩
(邯郸市中心医院药剂科,河北邯郸 056001)
目的:研究顺铂与溶菌酶相互作用的光谱学特征。方法:应用光谱法研究顺铂与溶菌酶的相互作用机制;计算其结合常数、结合位点数和结合距离;根据热力学参数判断作用力类型;考察二者的相互作用对溶菌酶构象的影响。结果:顺铂对溶菌酶的荧光淬灭过程为生成复合物的静态淬灭;供能体与受能体之间的距离小于7 nm,发生了非辐射能量转移;二者以氢键和范德华力结合为主;同步荧光光谱和三维荧光光谱表明结合反应影响了氨基酸残基所处的微环境。结论:顺铂能与溶菌酶结合并改变溶菌酶的构象。
顺铂;溶菌酶;荧光光谱法;紫外-可见光谱法;荧光淬灭
溶菌酶(Lysozyme,LYSO)是一种小分子碱性蛋白质,普遍存在于鸟类、家禽的蛋清和哺乳动物的眼泪、唾液、血液、尿液、乳汁和组织细胞中[1],能够和许多外源和内源性物质结合,运载多种药物。顺铂(Cisplatin)为细胞周期非特异性药物,具有细胞毒性,可抑制癌细胞的脱氧核糖核酸(DNA)复制过程,并损伤其细胞膜结构,有较强的广谱抗癌作用,临床上用于治疗卵巢癌、前列腺癌、睾丸癌、肺癌等[2];其副作用常常是限制该药剂量的重要因素,包括胃肠道反应、骨髓抑制、肾脏毒性和神经毒性等[3]。为了使抗癌药物能定位于肿瘤组织释放而减少对正常组织的毒副反应,选择蛋白质为药物载体的应用日益广泛[4,5]。作为生物体内重要的非特异性体液免疫因子,LYSO具有抗菌抗病毒、抗肿瘤、增强免疫力等多种药理作用[6],与抗肿瘤药物联用,可能会增强其靶向性及抗癌疗效。笔者采用荧光光谱法和紫外-可见光谱法研究了顺铂与LYSO的相互作用,建立结合的体外模型,探讨结合的紧密程度、结合模式、结合部位等问题,所得结果将为药物的联用以及抗肿瘤药物靶向载体的选择提供有利的信息。
1 材料
1.1 仪器
LS-50B型荧光光谱仪(英国珀金-埃尔默公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);PHSJ-5实验室pH计(上海精密科学仪器有限公司);CU600电热恒温水浴箱(上海益恒实验仪器有限公司)。
1.2 试药
0.05 mol·L-1三羟甲基氨基甲烷盐酸盐(Tris-HCl)缓冲溶液(内含0.1 mol·L-1氯化钠,pH=7.4);LYSO(国药集团化学试剂有限公司,浓度:1×10-5mol·L-1,批号:F20080526)、顺铂(昆明贵研药业有限公司,含量:1×10-3mol·L-1,批号:320080410,避光保存)均用上述缓冲溶液配制;其余试剂均为分析纯,试验用水为双重蒸馏水。
2 方法
2.1 荧光光谱法
在一系列10 mL容量瓶中,加入1×10-5mol·L-1LYSO溶液1 mL和不同量(0、10、20、30、40、50、60μL)的1.0×10-3mol·L-1顺铂溶液,用Tris-HCl缓冲溶液定容至刻度,摇匀、静置。
荧光发射光谱:准确移取3 mL含有不同浓度顺铂的LYSO溶液于石英比色皿中,在298 K和310 K条件下,分别扫描其荧光发射光谱。以280 nm为激发波长(λex),激发和发射狭缝均为7 nm,扫描范围为300~420 nm。
同步荧光光谱:Δλ=15 nm和Δλ=60 nm,扫描范围分别为270~310 nm和250~315 nm。
三维荧光光谱:发射波长(λem)250~420 nm,激发波长(λex)200~330 nm,扫描次数14次,步长10 nm,狭缝均为7 nm。
2.2 紫外-可见光谱法
扫描300~420 nm波长范围内,1.0×10-6mol·L-1顺铂溶液的紫外吸收光谱。
3 结果
3.1 荧光光谱特征
LYSO是由129个氨基酸残基组成的单链蛋白质,Trp62和Trp108是LYSO荧光的主要来源[7]。图1是含有不同浓度顺铂的LYSO溶液的荧光发射光谱,从图中可以看出,随着顺铂浓度的增加,LYSO在343 nm处的荧光发射峰强度逐渐降低,且峰位置发生了一定程度的蓝移,表明顺铂与LYSO发生了相互作用,LYSO的内源性荧光产生淬灭。顺铂与LYSO相互作用的荧光淬灭图见图1(图中,c(LYSO)=1.0×10-6mol·L-1,曲线1→7 c顺铂分别为(0、1、2、3、4、5、6)×10-6mol·L-1)。

图1 顺铂与LYSO相互作用的荧光淬灭图Fig 1 Fluorescence quenching spectra of interaction between cisplatin and LYSO
3.2 光淬灭机制的判断
荧光淬灭本质上就是与发光过程相互竞争而缩短发光分子激发态寿命的过程,根据淬灭机制不同分为动态淬灭和静态淬灭,分别遵循Stern-Volmer方程(见式1)和Lineweaver-Burk双倒数方程(见式2):
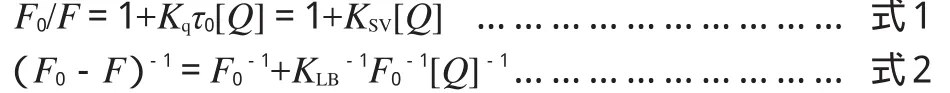
式中F0为未加入淬灭剂时LYSO的荧光强度;F为加入淬灭剂后LYSO的荧光强度;Kq为双分子淬灭过程的速率常数;τ0为不存在淬灭剂时荧光分子的平均寿命;KSV是动态淬灭常数;KLB是静态淬灭常数;[Q]为淬灭剂的浓度。
以F0/F对[Q]作图,得到不同温度下的KSV(表1)。动态淬灭主要依赖于分子扩散,温度越高,扩散系数越大,淬灭常数随着温度的升高而升高;相反,对于静态淬灭,温度越高,基态络合物的稳定性越差,淬灭常数越小[8]。从表中看出随着温度的升高,Ksv减小,可初步判断淬灭过程为静态淬灭。同时,各类淬灭剂对生物大分子的扩散碰撞淬灭常数最大不超过2×1010L·mol-1·s-1[9],而试验所得Kq均远大于此值,进一步证明顺铂与LYSO之间主要发生了静态淬灭反应。根据Lineweaver-Burk双倒数方程得到KLB(表1)。

表1 不同温度下的K sv和K LBTab 1 K sv and K LB at different temperatures
3.3 表观结合常数(Ka)和结合位点数(n)
药物与蛋白质的相互作用一般采用位点结合模型来描述,根据结合和自由的分子建立化学平衡方程:lg[(F0-F)/F]=lg Ka+n lg[Q][3],得出Ka和n,见表2。结果,298 K和310 K时,顺铂与LYSO的n均接近于1,表明二者近似以1∶1结合生成复合物。
3.4 辐射能量转移
根据Föster’s能量转移原理,如果供能体能够发荧光,其荧光发射光谱与受能体的吸收光谱有足够的重叠,并且供能体与受能体的最大距离小于7 nm,就可认为供能体与受能体之间发生了非能量辐射转移,导致供能体荧光淬灭。临界能量转移距离(R0)、结合距离(r)及能量转移效率(E)符合以下关系[10]:

表2 不同温度下的K a和nTab 2 Binding constants(K a)and binding sites(n)at different temperatures
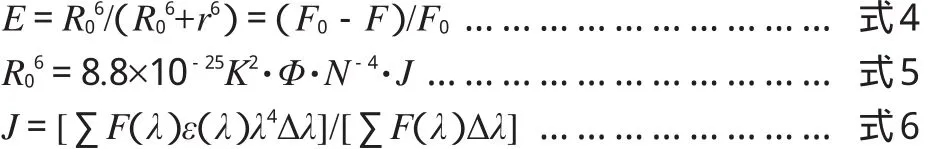
F(λ)为供能体在波长λ处的荧光强度,ε(λ)为受能体在λ处的摩尔吸光系数,J是供能体荧光发射光谱与受能体紫外吸收光谱的重叠积分。偶极空间取向因子K2=2/3,LYSO中色氨酸残基的量子产率Φ=0.15,介质折射指数n=1.36。计算得出r=3.83 nm,小于7 nm。由此推断顺铂与LYSO之间发生了非辐射能量转移,促使了LYSO的荧光淬灭。顺铂的紫外吸收光谱与LYSO荧光发射光谱叠加图,见图2(图中,c(KYSO))=c顺铂=1.0×10-6mol·L-1)。
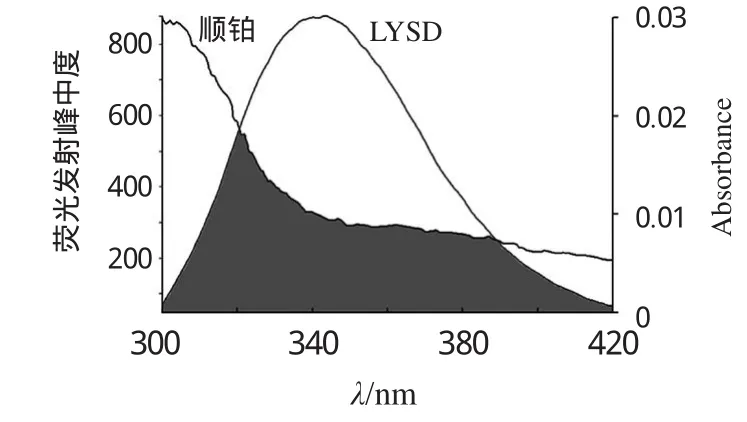
图2 顺铂的吸收光谱与LYSO的荧光发射光谱叠加图Fig 2 Overlap of the absorption spectrum of cisplatin with thefluorescencespectrum of LYSO
3.5 作用力类型的确定
有机小分子与蛋白质等生物大分子之间的作用力类型主要有疏水作用力、静电引力、氢键和范德华力等。当ΔH>0,ΔS>0时,分子间的作用力主要是疏水作用力;当ΔH<0,ΔS<0时,主要为氢键和范德华力;当ΔH<0,ΔS>0时,静电引力占主导[11]。当温度变化范围不大时,反应焓变ΔH和熵变ΔS可以近似看作常数。根据热力学方程:

求得不同温度下的热力学参数,见表3。

表3 不同温度下顺铂与LYSO作用的热力学参数Tab 3 Thermodynamic parameters of the reaction betweencisplatin and LYSO at different temperatures
可以看出,ΔG均小于0,即在298 K和310 K时顺铂与LYSO的相互作用过程都是自发进行的。ΔH<0,ΔS<0,说明顺铂与LYSO之间主要以氢键和范德华力相结合。
3.6 同步荧光光谱
固定激发波长与发射波长的间距Δλ,同步扫描激发和发射单色器即得同步荧光光谱。通过选择合适的波长差可将普通荧光光谱上相互重叠的荧光峰分开,Δλ=15 nm和Δλ=60 nm分别体现蛋白质酪氨酸和色氨酸残基的光谱特征。氨基酸残基的最大发射波长与所处环境极性密切相关[12],根据最大荧光发射波长的改变可判断蛋白质构象的变化。顺铂与LYSO相互作用的同步荧光光谱见图3(图中,温度为298 K,cLYSO=1×10-6mol·L-1;曲线1→7 c顺铂依次为(0、1、2、3、4、5、6)×10-6mol·L-1)。

图3 顺铂与LYSO相互作用的同步荧光光谱A.Δλ=15 nm;B.Δλ=60 nmFig 3 Synchronous fluorescence spectra of interaction between cisplatin and LYSOA.Δλ=15 nm;B.Δλ=60 nm
由图3可以看出,随着顺铂浓度的增大,LYSO色氨酸和酪氨酸残基的荧光发射峰均产生蓝移,说明微环境的疏水性增加,肽链的伸展程度可能有所减弱,氨基酸残基处于更“包埋”的状态中[13],从而引起了LYSO构象的变化。
3.7 三维荧光光谱
研究溶液状态下蛋白质-药物小分子相互作用中蛋白质的构象变化时,三维荧光光谱能提供比常规荧光光谱更完整的光谱信息,是一种有价值的光谱指纹技术。图4为LYSO及顺铂与LYSO的三维投影和等高线光谱图(图中,温度为298 K,cLYSO=1×10-6mol·L-1;曲线1→7 c顺铂依次为(0、1、2、3、4、5、6)×10-6mol·L-1)。峰1为瑞利散射峰(λex=λem),峰2为LYSO的荧光发射峰。LYSO空白溶液的峰2(λex/λem,F)为(280/344 nm,912);顺铂与LYSO相互作用后,荧光发射峰强度降低,等高线的疏密程度也发生改变,峰2为(280/342 nm,786),峰强度降低了126,峰位置蓝移了2 nm,说明结合反应使体系微环境的疏水性增强、极性降低,所得结果与同步荧光光谱一致。由此推断结合部位可能处于LYSO的疏水腔中,顺铂的引入导致疏水腔极性的改变,进而使LYSO的构象发生变化[14]。

图4 LYSO空白及顺铂与LYSO相互作用后的三维荧光投影和等高线光谱图Fig 4 Three-dimensional fluorescence spectra and contour spectra of LYSO and cisplatin-LYSO
4 讨论
LYSO是一种天然的、无毒、无副作用的蛋白质,顺铂能与其以氢键和范德华力结合生成复合物。选择LYSO作为顺铂的靶向载体,可能会减小其对正常组织的毒副作用,增强抗肿瘤疗效。同时,二者的结合常数较小,表明结合程度不是很大,顺铂较容易分布到靶组织并代谢。
[1] 李 敏.溶菌酶及其应用[J].生物学教学,2006,31(4):2.
[2] 林晓雯,张艳华.铂类抗肿瘤药的进展与临床评价[J].中国医院用药评价与分析,2011,11(1):4.
[3] 王利娟,李琳娜,何金花,等.溶菌酶与顺铂联合应用对肝癌SMMC-7721细胞的协同抑制效应[J].暨南大学学报(医学版),2008,29(2):130.
[4] 罗晓琴,朱颖杰,王成蹊.荧光光度法研究不同药物载体制成5-FU纳米粒的靶向性[J].中国执业药师,2010,7(6):27.
[5] 陈 辰,何 军,陆伟根,等.白蛋白作为注射用难溶性药物载体的研究进展[J].中国医药工业杂志,2010,41(1):51.
[6] 何金花,刘 誉,刘冠杰,等.溶菌酶在医药中的应用及其研究进展[J].药学进展,2008,18(2):16.
[7] Ghosh KS,Sahoo BK,Dasgupta S,et al.Spectrophotometric studies on the interaction between(-)-epigallocatechin gallate and lysozyme[J].Journal of Chemical Physics Letters,2008,452(1-3):193.
[8]Gao WH,Li NN,Chen GP,et al.Binding studies of costunolide and dehydrocostuslactone with HASby spectroscopy and atomic force microscopy[J].Journal of Luminescence,2011,131(10):2 063.
[9] Yu XY,Yang Y,Liu RH,et al.The investigation of the interaction between edaravone and bovine serum albumin by spectroscopic approaches[J].Journal of Luminescence,2011,131(7):1 510.
[10]Abdollahpour N,Asoode Ah,Saber MRi,et al.Separate and simultaneous binding effects of aspirin and amlodipine to human serum albumin based on fluorescence spectroscopic and molecular modeling characterizations:A mechanistic insight for determining usage drugs doses[J].Journal of Luminescence,2011,131(9):1 885.
[11] Xu M,Chen FJ,Huang L,et al.Binding of rare earth metal complexeswith an o fl oxacin derivativeto bovineserum albumin and its effect on the conformation of protein[J].Journal of Luminescence,2011,131(8):1 557.
[12]Li DJ,Wang Y,Chen JJ,et al.Characterization of the interaction between farrerol and bovine serum albumin by fluorescence and circular dichroism[J].Spectrochimica Acta Part A,2011,79(3):680.
[13] 田建袅,谢余寰,赵彦春,等.光谱法研究迷迭香酸和牛血清白蛋白的相互作用[J].化学试剂,2010,32(4):311.
[14]Zhang GW,Que QM,Pan JH,et al.Study of the interaction between icariin and human serum albumin by fluorescence spectroscopy[J].Journal of Molecular Structure,2008,881(1-3):132.
Spectroscopic Study on the Interaction of Cisplatin with Lysozyme
CHEN Chen,ZHANG Hong-feng,WANG Le,WEI Ya-chao,LI Qian
(Dept.of Pharmacy,Handan Central Hospital,Hebei Handan 056001,China)
OBJECTIVE:To study the spectroscopic characteristics of the interaction between cisplatin and lysozyme.METHODS:The interaction mechanism of cisplatin with lysozyme was investigated by spectroscopic method;the binding constants,binding sites and binding distance were calculated;the interaction force was estimated by thermodynamic parameters;the effects of their interactin on conformation change of lysozyme were investigated.RESULTS:The fluorescence quenching mechanism of cisplatin with lysozyme was due to the formation of cisplatin-lysozyme complex which resulted in static quenching procedure.The distance between donor and acceptor was less than 7 nm,which indicated that the energy nonradiative transfer occurred.Hydrogen bonds and van der Waals forces played a major role in the binding action.Synchronous and three-dimensional fluorescence spectra revealed that the interaction of cisplatin and lysozyme influenced the environments of amide acid residues.CONCLUSION:Cisplatin could bind with lysozyme and change the conformation of lysozyme.
Cisplatin;Lysozyme;Fluorescence spectrometry;UV-visible spectrum;Fluorescence quenching
R969.1;R979.1
A
1001-0408(2012)30-2847-03
DOI 10.6039/j.issn.1001-0408.2012.30.25
*药师,硕士。研究方向:临床药学。电话:0310-2118084。E-mail:1388097@163.com
2011-08-21
2012-05-14)
