老年女性2型糖尿病患者骨代谢标志物变化研究
2012-11-23史蕾庞东岳张弘弘陈小红唐梅胡吉董吉祥
史蕾 庞东岳 张弘弘 陈小红 唐梅 胡吉 董吉祥
2型糖尿病(T2DM)是一种全身代谢性疾病,其引起的并发症几乎累及机体各个组织,骨质疏松(osteoporosis,OP)是糖尿病在骨骼系统中出现的最常见的一种并发症。老年人和T2DM患者是OP的高危人群,已有报道指出老年男性T2DM合并OP的发生与骨形成能力不足有关[1],而老年女性患者由于自身生理特点,OP的发生率远高于同龄男性。由于OP易致骨折,致残性高,使患者治疗和康复更为困难,加重患者经济负担。国外研究表明糖尿病性骨质疏松(diabetic osteoporosis,DO)的发病率已经达到50% ~60%,而确诊需进行骨密度测定,但存在一定的限制。骨标志物不仅可以用来监测OP患者治疗的时效性和疗效,还可以用于预测骨折的风险[2]。Ⅰ型前胶原氨基末端(N端)前肽(PINP)、Ⅰ型前胶原氨基末端(C端)前肽(PICP)和25-羟维生素D3是反映骨形成的敏感指标,而抗酒石酸碱性磷酸酶(TrACP-5b)为反映骨质吸收的敏感指标。本试验通过对骨形成、骨吸收指标研究,分析绝经后女性T2DM患者骨代谢特点及相关因素,以进一步早期发现预测骨量减少和OP的发生。
1 对象与方法
1.1 对象 2011年3月至7月我院内分泌科住院女性中老年病人,符合下列要求:(1)按照1999年WHO糖尿病诊断及分型标准确诊为T2DM。(2)排除其他可引起继发性OP的疾病:甲状腺功能亢进症、甲状旁腺功能亢进症、风湿性关节炎、肾脏疾病等。(3)无长期卧床史,未服用糖皮质激素、维生素D3、钙剂等影响骨代谢药物。(4)排除40岁前绝经者、行卵巢切除术者。入选病例44例,年龄49~89岁,平均(66.0±10.8)岁。选取2011年3月我院50例女性体检健康者作为对照组,平均年龄(67.3±7.1)岁。
1.2 方法
1.2.1 生化指标检测:对入选患者记录年龄、病程,并于空腹8 h后抽取静脉血后运用全自动生化分析进行血钙、血磷、血肌酐等指标分析。采用美国biorad公司产糖化血红蛋白(HbA1c)分析系统及试剂检测HbA1c,ELISA 法测定 25-羟维生素 D3、TrACP-5b、PINP、PICP。25-羟维生素 D3、TrACP-5b 检测试剂盒均由英国IDS Ltd公司生产。PINP、PICP试剂盒由瑞士罗氏公司生产。
1.2.2 分组标准:根据是否患有糖尿病分为T2DM组及健康对照组。T2DM组按糖尿病病程分为<10年组(T2DM 1组)及≥10年组(T2DM 2组)。T2DM组按HbA1c水平分为 <8%组(T2DM 3组)及≥8%组(T2DM 4组)。目前临床上建议中老年HbA1c水平控制在<8%为宜。
1.2.3 统计学处理:各计量资料用均数±标准差表示,2组均数之间的比较用t检验,以P<0.05为有统计学意义。并对相关因素做相关分析。以上均通过SPSS 13.0统计软件进行统计学处理。
2 结果
2.1 生化指标比较 T2DM组25-羟维生素D3、PICP明显减低(P<0.05和P<0.01);而TrACP-5b升高(P<0.05),见表1。与T2DM 1组比较,T2DM 2组患者PINP、PICP水平明显减低,TrACP-5b明显升高(P均<0.05);与 T2DM组3组比较,T2DM 4组患者PINP、PICP明显减低(P<0.05或 P <0.01),TrACP-5b明显升高(P<0.05),见表2。
表1 T2DM组与对照组资料比较
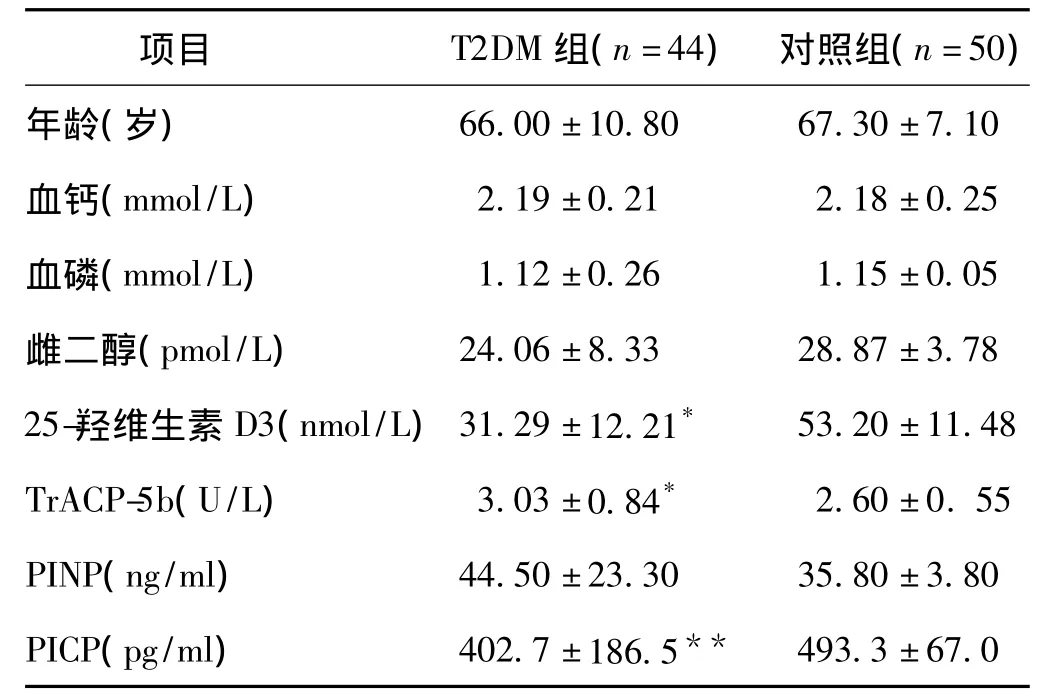
表1 T2DM组与对照组资料比较
注:与对照组比较,*P <0.05,**P <0.01
项目 T2DM组(n=44) 对照组(n=50)年龄(岁)66.00±10.80 67.30±7.10血钙(mmol/L) 2.19±0.21 2.18±0.25血磷(mmol/L) 1.12±0.26 1.15±0.05雌二醇(pmol/L) 24.06±8.33 28.87±3.78 25-羟维生素D3(nmol/L)31.29±12.21* 53.20±11.48 TrACP-5b(U/L) 3.03±0.84* 2.60±0.55 PINP(ng/ml) 44.50±23.30 35.80±3.80 PICP(pg/ml) 402.7±186.5**493.3±67.0
2.2 T2DM 组 HbA1c与 PINP、PICP、TrACP-5b 相关性分析 HbA1c与PINP、PICP、TrACP-5b存在显著相关性(P<0.05);而雌二醇与PINP、PICP、25-羟维生素D3、TrACP-5b无明显相关性,见表3。
3 讨论
DO是继发性OP,其患病率报道不一,国内外报道为9.8%~66.8%,其差异很大的原因可能与测定方法、纳入对象和诊断标准不同有关[3]。对于正常健康女性,绝经后年数越久,发生OP的风险性越大[4]。近来的研究显示PINP、PICP是骨形成更为特异和敏感的指标,不受激素影响[5]。TrACP-5b主要是由破骨细胞释放,检测血清中TrACP-5b的水平可以反映体内破骨细胞的活性和骨吸收状态。TrACP-5b由于其特异性高,结果不受昼夜变化,饮食,肝、肾等疾病的影响,已经成为第二代骨吸收的生化标志物,对早期的骨质检测和降低骨折的风险具有重要作用。Duarte等[6]研究证实糖尿病状态与骨转换相关,并最终导致OP。一些大型临床试验研究也明确显示了糖尿病与OP患病风险增加有关[7]。
表2 T2DM 1组/T2DM 2组、T2DM 3组/T2DM 4组各计量资料比较(珋)
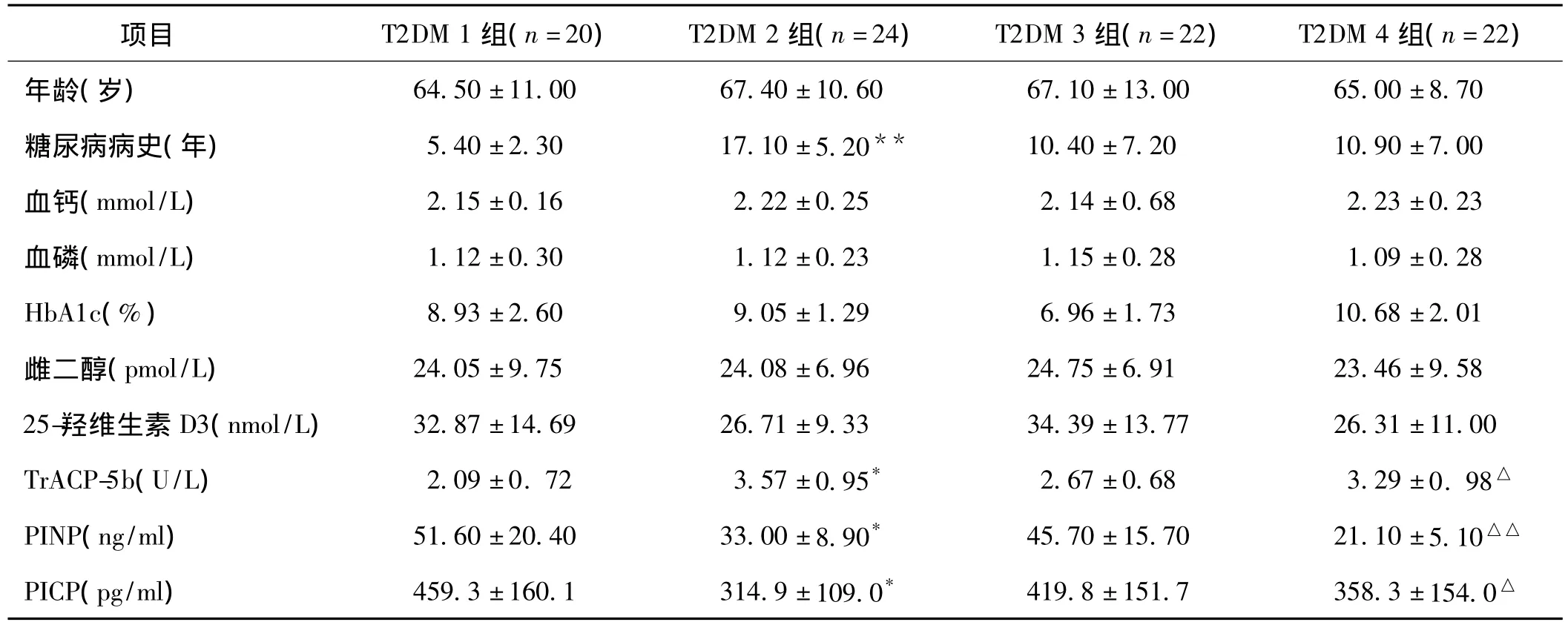
表2 T2DM 1组/T2DM 2组、T2DM 3组/T2DM 4组各计量资料比较(珋)
注:T2DM 2组与T2DM 1组比较,*P<0.05,**P<0.01;T2DM 4组与T2DM 3组比较,△P<0.05,△△P<0.01
项目 T2DM 1组(n=20) T2DM 2组(n=24) T2DM 3组(n=22) T2DM 4组(n=22)年龄(岁) 64.50±11.00 67.40±10.60 67.10±13.00 65.00±8.70糖尿病病史(年) 5.40±2.30 17.10±5.20** 10.40±7.20 10.90±7.00血钙(mmol/L) 2.15±0.16 2.22±0.25 2.14±0.68 2.23±0.23血磷(mmol/L) 1.12±0.30 1.12±0.23 1.15±0.28 1.09±0.28 HbA1c(%) 8.93±2.60 9.05±1.29 6.96±1.73 10.68±2.01雌二醇(pmol/L) 24.05±9.75 24.08±6.96 24.75±6.91 23.46±9.58 25-羟维生素D3(nmol/L) 32.87±14.69 26.71±9.33 34.39±13.77 26.31±11.00 TrACP-5b(U/L) 2.09±0.72 3.57±0.95* 2.67±0.68 3.29±0.98△PINP(ng/m l) 51.60±20.40 33.00±8.90* 45.70±15.70 21.10±5.10△△PICP(pg/m l) 459.3±160.1 314.9±109.0* 419.8±151.7 358.3±154.0△

表3 T2DM组HbA1c相关因素分析
本试验中亦发现T2DM组PICP、25-羟维生素D3等骨形成指标明显低于正常对照组,而TrACP-5b等反映破骨细胞活性的指标较对照组明显升高,且差异具有统计学意义(P<0.05),这些进一步明确了T2DM骨质改变的特点:骨形成下降、骨吸收增加。汪四虎等[8]对180例老年T2DM女性患者(其中OP患者65例,非OP患者115例)的OP相关危险因素进行logistic回归分析,研究结果发现:病程、体质量指数(BMI)是老年女性T2DM患者发生OP的独立危险因素,且随着糖尿病病程的增加,OP发生率增加。而本研究中T2DM 2组与1组患者在年龄、性激素、血钙、血磷、HbA1c、25-羟维生素D3上无明显统计学差异,PINP、PICP的水平则明显低于T2DM 1组,TrACP-5b则高于T2DM 1组,且差异均具有统计学意义(P<0.05或P<0.01),这提示随着糖尿病病程的加长,骨形成水平降低,骨吸收增加,且与病程呈现独立相关性,糖尿病本身对OP存在影响。T2DM 4组PINP、PICP明显低于3组,差异存在统计学意义(P<0.05或P<0.01),提示血糖控制不佳可降低骨质形成速率,这可能与高血糖会在细胞水平抑制成骨细胞的分化与增殖、在分子水平减少Ⅰ型胶原分子的表达有关[9],而25-羟维生素D3在2组间无统计学差异,考虑为后者敏感性不如前者,同时与样本量较小有关。T2DM 3、4组之间在血钙、血磷水平无明显统计学差异,而TrACP-5b存在统计学意义(P<0.05),考虑与继发性甲状旁腺功能亢进(甲旁亢)所致甲状旁腺激素(PTH)分泌增多产生的代偿有关,这进一步促进了骨吸收,影响了骨代谢水平。糖尿病病史越长对骨代谢的影响越大可能因为:长期的糖尿病会促使钙、磷代谢紊乱逐渐加重,而尿钙排泄增加致继发性甲旁亢,特别是患有糖尿病肾病时,肾功能减退,使维生素D3呈缺乏状态,造成肠钙吸收减少,血钙降低,刺激PTH分泌增加,使骨吸收增强。随着糖尿病病史的延长,胰岛功能越来越差导致胰岛素分泌不足,胰岛素分泌的不足又可通过多种途径影响骨代谢,可能有以下机制:(1)胰岛素在骨代谢过程中可通过成骨细胞表面存在的胰岛素受体,刺激成骨细胞核苷的合成,从而促进骨胶原的合成增加骨钙沉积[10]。胰岛素缺乏可导致骨基质成熟和转换下降,骨基质分解,钙盐丢失,引起OP;(2)持续高血糖可抑制成骨细胞的增殖,改变成骨细胞对PTH和25-羟维生素D3的反应性,糖尿病导致骨骼系统内的糖、蛋白质和I型胶原合成减少[11]。
我们在对老年T2DM患者的诊治中,应加强对糖尿病患者OP相关教育及检测力度,并争取严格控制血糖、提早使用PTH、维生素D等制剂促进钙沉积,以延缓DO发生,提高患者生活质量。
[1]冯缨缨,钟远,金俊.老年男性2型糖尿病合并骨质疏松症患者骨代谢生化指标分析[J].实用老年医学,2011,25(6):510-512.
[2]袁乐永,张吉才,谭莹,等.十堰地区健康人群骨代谢标志物参考范围的建立[J].实用老年医学,2011,25(5):400-403.
[3]Leidig-Bruckner G,Ziegler R.Diabetes mellitus a risk for osteoporosis[J].Exp Clin Endocrinol Diabetes,2001,109(Suppl 2):S493-S514.
[4]李慧林,朱汉民,程群,等.绝经妇女绝经后年限及年龄与骨量丢失率关系[J].中国骨质疏松杂志,2007,13(7):502-504.
[5]Hernandez MV,Guanabens N,Alvarez L,etal.Immunocytochemical evidence on the effects of glucocorticoids on type I collagen synthesis in human osteoblastic cells[J].Calcif Tissue Int,2004,74(3):284-293.
[6]Duarte VM,Ramos AM,Rezende LA,etal.Osteopenia:a bone disorder associated with diabetes mellitus[J].J Bone Miner Metab,2005,23(1):58-68.
[7]Raska I Jr,Broulik P.The impact of diabetes mellitus on skeletal health:an established phenomenon with inestablished causes[J].Prague Med Rep,2005,106(2):137-148.
[8]汪四虎,黄大祥,吴方来.老年女性2型糖尿病患者骨质疏松症的危险因素分析[J].安徽医药,2010,14(8):948-949.
[9]Lu H,Kraut D,Gerstenfeld LC,etal.Diabetes interferes with the bone formation by affecting the expression of transcription factors that regulate osteoblast differentiation[J].Endocrinology,2003,144(1):346-352.
[10]Isaia GC,Ardissone P,Di SM,etal.Bonemetabolism in type 2 diabetesmellitus[J].Acta Diabetol,1999,36(1/2):35-38.
[11]Kumeda Y,Inaba M,Nishizawa Y.Secondary osteoporosis and its treatment-diabetes mellitus[J].Nihon Rinsho,1998,56(6):1579-1586.
