Al-Zn-Sn-Ga阳极腐蚀过程的电化学阻抗谱
2012-11-23贺俊光文九巴李旭东郝庆国
贺俊光,文九巴,李旭东,郝庆国
(1. 兰州理工大学 材料科学与工程学院,兰州 730050;2. 河南科技大学 材料科学与工程学院,洛阳 471003)
Al-Zn-Sn-Ga阳极腐蚀过程的电化学阻抗谱
贺俊光1,2,文九巴2,李旭东1,郝庆国2
(1. 兰州理工大学 材料科学与工程学院,兰州 730050;2. 河南科技大学 材料科学与工程学院,洛阳 471003)
通过测定Al-Zn-Sn-Ga阳极在3.5% NaCl(质量分数)溶液中浸泡不同时间的电化学阻抗谱(EIS),研究该阳极的腐蚀发展过程和腐蚀特征。结果显示:当合金刚被浸入3.5% NaCl溶液时,EIS谱为反应电阻很大的容抗弧,表明此时合金处于钝化态;随着浸泡时间的延长,EIS谱中高频段的容抗弧明显减小且低频段出现感抗弧,合金进入点蚀期;继续延长浸泡时间,EIS谱中除高频段的容抗弧和中、低频段感抗弧外,在低频段出现另一容抗弧,合金处于点蚀扩展期;随着浸泡时间的继续增加,低频段感抗弧消失,EIS谱由两个容抗弧组成,合金达到均匀腐蚀期。因此,合金的腐蚀由钝化态开始,经点蚀期和点蚀扩展期,达到均匀腐蚀期。
铝合金;牺牲阳极;电化学阻抗谱;腐蚀行为
铝合金牺牲阳极材料中Al-Zn-In阳极合金由于具有电流效率高、腐蚀产物易脱落等优点而被广泛用于海水中钢构件的阴极保护[1]。但在使用过程中,人们逐渐认识到In对海洋环境的危害[2]。Al-Zn-Sn系阳极的电流效率较Al-Zn-In系的低,且腐蚀产物易粘附于合金表面使腐蚀形貌呈“海绵”状[3]。为了进一步提高Al-Zn-Sn阳极的电化学性能,本课题组在三元合金Al-Zn-Sn的基础上,开发了电流效率高达 96%的Al-Zn-Sn-Ga合金[4]。为了进一步研究Al-Zn-Sn-Ga阳极的腐蚀行为,本文作者通过测定Al-Zn-Sn-Ga阳极在浸泡不同时间的电化学阻抗谱(EIS),研究了其在3.5% NaCl中的腐蚀发展过程和腐蚀特征,以探讨该合金的腐蚀机理。
1 实验
1.1 试样的制备
将高纯Al和Zn锭(纯度高于99.9%)及分析纯Sn和 Ga按质量分数 Al-7Zn-0.1Sn-0.015Ga称取。在ZGJL0.01-4C-4真空感应炉中熔炼合金,于铸铁模具中浇注成d20 mm×140 mm的圆棒,自然冷却。将铸棒加工成 d16 mm×28 mm(用于电化学性能测试)和d11.3 mm×5 mm(用于电化学阻抗测试和腐蚀形貌观察)的试样。
1.2 电化学性能测试
根据GB/T 17848—1999[5]规定方法,采用恒电流法测试合金的电流效率。以面积为14 cm2的试样为测试阳极,低碳钢板为阴极,阴、阳极面积比为60:1,参比电极为饱和甘汞电极(SCE)。阳极工作电流密度为1 mA/cm2,试验时间为10 d,试验介质为人造海水。用浓硝酸清洗试样腐蚀产物,再用去离子水清洗、干燥、称取质量,根据质量损失计算实际电容量(Q)和电流效率(η)。
1.3 EIS测试
用 CHI660C型电化学工作站测试合金在3.5%NaCl溶液中浸泡不同时间的EIS。采用三电极体系,辅助阴极为石墨电极,参比电极为SCE。激励信号峰值为 5 mV,频率范围为 10-1~105Hz,采用ZSimpWin软件对EIS谱进行拟合分析。试样用环氧树脂密封,留出1 cm2工作面积,电极用铜导线引出。
1.4 腐蚀形貌分析
试样依次经砂纸打磨,金刚石研磨膏抛光,去离子水和丙酮清洗,电吹风吹干。将经过处理的试样在3.5%NaCl溶液中分别浸泡5 min、1 h及10 d,用80℃的2%CrO3+5%H3PO4溶液去除腐蚀产物,用乙醇洗后采用JSM-5610LV型SEM观察合金的腐蚀形貌。
2 结果与分析
2.1 电化学性能
Al-Zn-0.1Sn-0.015Ga合金在3.5% NaCl溶液中的电化学性能如表1所列。可以看出,该阳极电流效率为96.4%,实际电容量为2 729 A·h/kg,电流效率和实际电容量均较高。钢铁构件在海水中的保护电位为-0.8 V (vs SCE),一般要求驱动电压在0.25 V 左右,即阳极电位为-1.0~-1.1 V (vs SCE),这样钢铁构件能得到有效保护,且不会引起构件氢脆。由表1可以看出,该合金能起到保护钢铁构件的作用。

表1 Al-7Zn-0.1Sn-0.015Ga合金的电化学性能Table 1 Electrochemical performances of Al-7Zn-0.1Sn-0.015Ga alloy
2.2 EIS分析
图1(a)所示为试样在3.5%NaCl溶液中浸泡0 min(刚浸入)的EIS谱。其Nyquist图为一半径很大的容抗弧。这是由于在浸泡之前,合金表面覆盖一层保护性氧化膜,其反应电阻较大,表明此时合金还没有活化,仍处于钝化态。用Rs表示溶液电阻,由于偏析相的电阻和电容与基体的电阻和电容不同,因此,用 R1和Q1分别代表偏析相的电阻与电容,用R2和Q2分别代表基体的电阻和电容;Rt表示电化学反应电阻。Al-Zn-Sn-Ga合金在钝化期EIS的等效电路CDC代码为Rs((R1Q1)(R2Q2)Rt),等效电路如图1(b)所示。
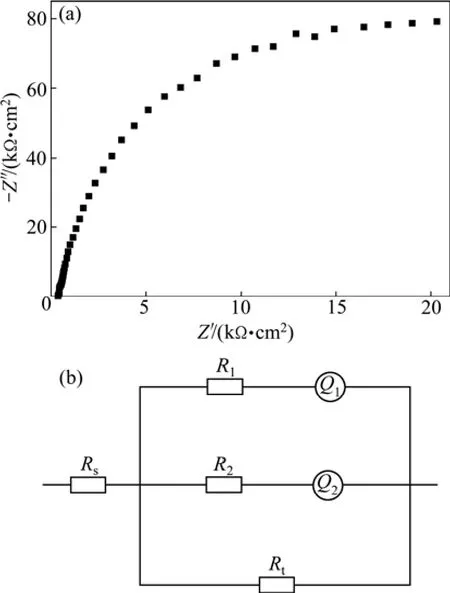
图1 Al-Zn-Sn-Ga合金钝化期的Nyquist图和等效电路Fig.1 Nyquist diagram (a) and equivalent circuit (b) of Al-Zn-Sn-Ga alloy at passivation
图 2(a)所示为试样在 3.5%NaCl溶液中浸泡初期的EIS。当浸泡2 min后,容抗弧半径明显减小,且在低频段开始出现感抗弧。随着浸泡时间进一步延长,容抗弧继续减小,低频感抗弧扩展到一个较大的频率范围。高频容抗弧反应合金溶解时的界面反应电阻。容抗弧模值大小代表反应阻力的大小,模值大,则反应阻力大,阳极的溶解速度慢[6]。随浸泡时间的增加,合金容抗弧半径减小,表明合金溶解时所需的阻抗变小,溶解速度加快,阳极产生活化。低频段感抗弧的出现说明合金表面发生了点蚀[7],感抗弧频率范围增加表明点蚀向深处发展。
由于Al和Zn容易先形成中间吸附离子,经水化作用产生中间产物吸附在反应表面。用R3、L1和R4、L2分别表示Zn2+和Al3+的中间产物吸附所产生的感抗及阻力,对应于EIS谱中低频段的感抗弧。根据以上分析确立点蚀期 EIS的等效电路 CDC代码为Rs((R1Q1)(R2Q2)(Rt(R3L1)(R4L2))),等效电路如图2(b)所示。

图2 Al-Zn-Sn-Ga合金点蚀期的Nyquist图和等效电路Fig.2 Nyquist diagrams (a) and equivalent circuit (b) of Al-Zn-Sn-Ga alloy at pitting
试样在3.5%NaCl溶液中浸泡1 h后,阻抗谱特征发生明显变化,虽然仍有高频段的容抗弧和中低频段的感抗弧出现,但在低频段又开始出现容抗弧,并且随着时间延长,容抗弧半径和感抗弧半径均逐渐增大,结果如图3(a)所示。
高频段容抗弧半径随浸泡时间的延长而逐渐增大,表明合金溶解所需阻抗增大,溶解速度减慢。由于腐蚀产物容易在含 Sn的合金氧化膜缺陷处形成,随着反应的进行,界面处生成腐蚀产物增多,阻碍了Zn2+、Sn4+和Ga3+在金属表面的回沉积及Cl-在合金表面的吸附,使反应界面电阻增大,合金溶解速度减慢;中频段的感抗弧半径继续增大,说明点蚀扩展速度减慢。低频段的容抗弧可能是由于反应产物在合金表面形成了一层表面膜[8-9]。这主要是合金溶解时,Zn、Sn和Ga等固溶在Al基体中的电位比Al的电位更正的元素以“溶解-再沉积”形式溶解时在钝化膜表面沉积引起的。与点蚀相比,在蚀坑界面腐蚀产物增多且活化元素在表面回沉积,因此,合金试样在此阶段的等效电路CDC代码为Rs((R1Q1)(R2Q2)(Rt(R3L1)(R4L2)(R5C1))),等效电路如图3(b)所示。
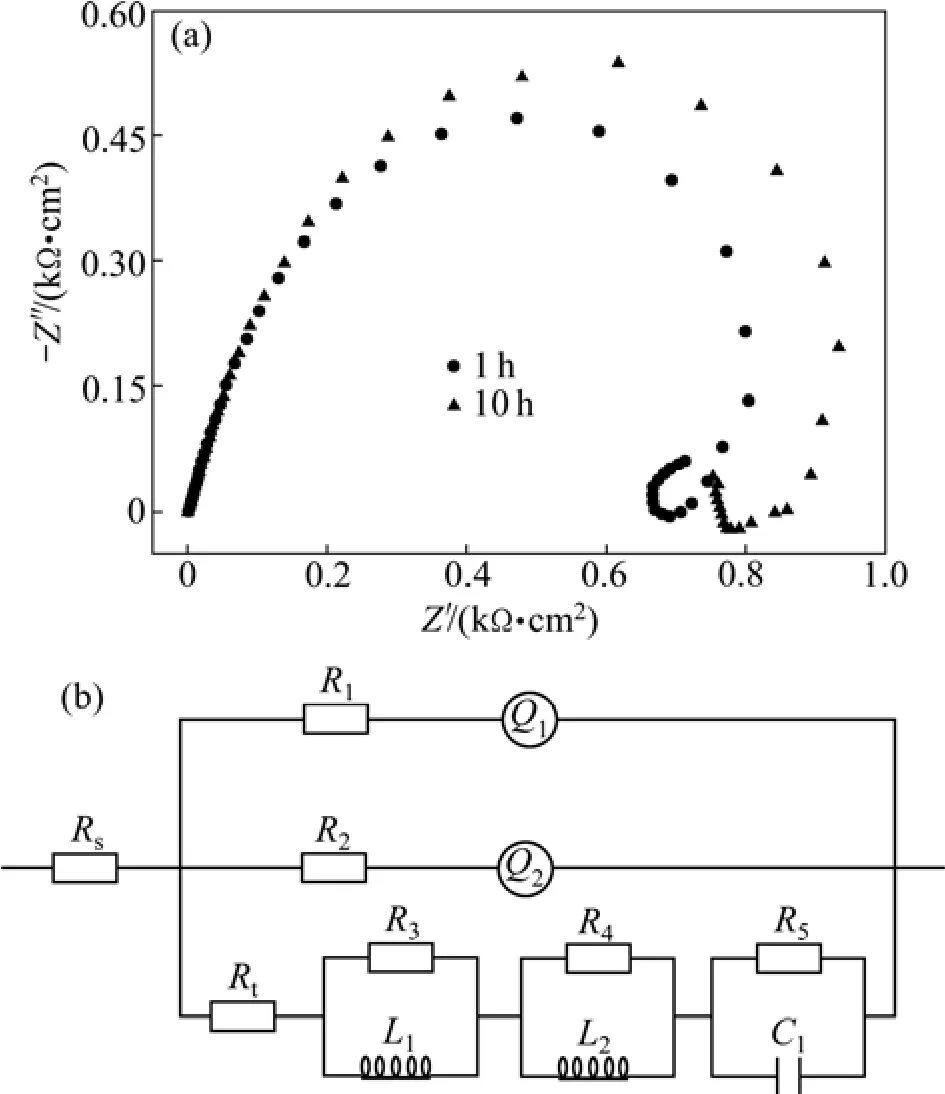
图3 Al-Zn-Sn-Ga合金点蚀扩展期的Nyquist图和等效电路Fig.3 Nyquist diagrams (a) and equivalent circuit (b) of Al-Zn-Sn-Ga alloy at pitting growth
试样在3.5%NaCl溶液中浸泡3 d后,低频段的感抗弧消失,电化学阻抗谱主要由两个容抗弧组成,但随浸泡时间延长,容抗弧逐渐减小。Niquist图如图4(a)所示。
随着浸泡时间的延长,容抗弧减小,可能是由于腐蚀产物膜增厚并部分脱落,Cl-则易侵入合金表面加速腐蚀,合金的阻抗减小。中低频段的感抗弧消失表明合金基体开始腐蚀[10-11]。
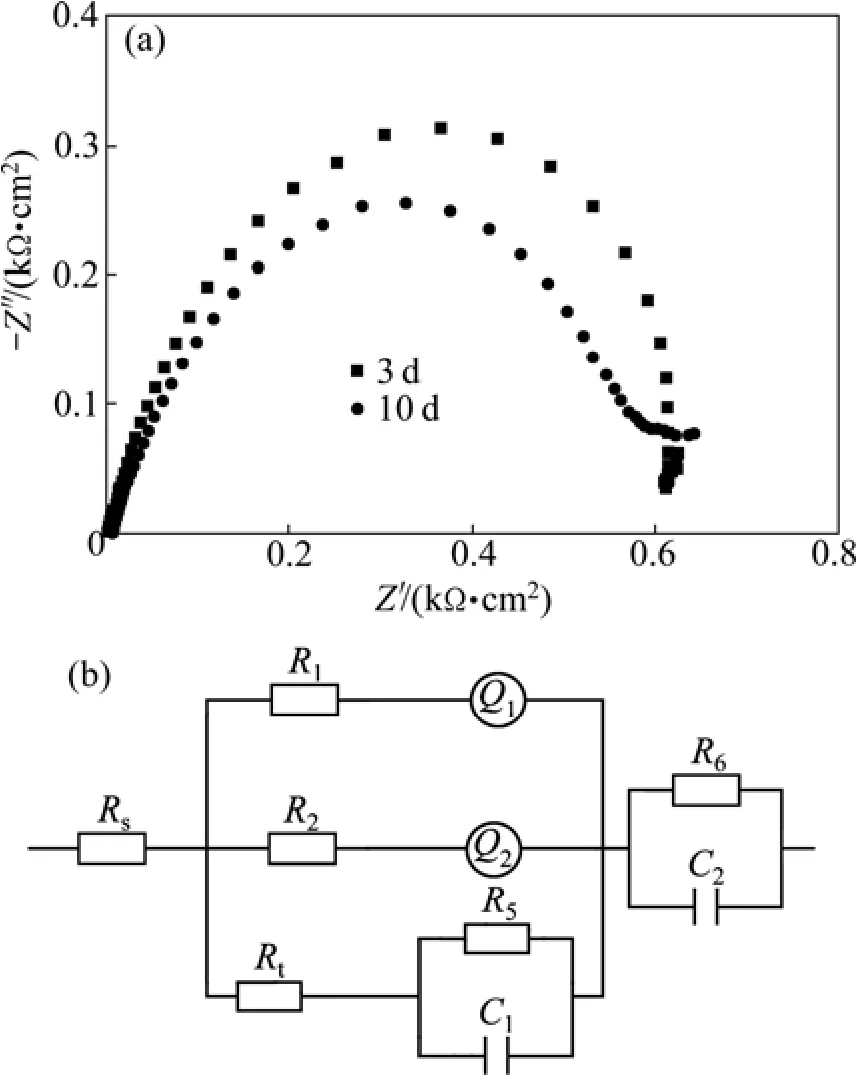
图4 Al-Zn-Sn-Ga合金均匀腐蚀期的Nyquist图和等效电路Fig.4 Nyquist diagrams (a) and equivalent circuit (b) of Al-Zn-Sn-Ga alloy in period of uniform corrosion
此阶段与前两个阶段相比,腐蚀产物更厚,未腐蚀区域更少,因此,腐蚀产物除了在腐蚀坑中粘附外,基本上在整个合金表面附着,因此,合金试样此阶段的等效电路为 Rs((R1Q1)(R2Q2)(Rt(R5C1)))(R6C2),等效电路图如图4(b)所示。
用上述等效电路对测得的阻抗谱用ZSimpWin软件进行拟合,拟合结果如表2所列。由表2可知,与电荷转移电阻相比,溶液电阻Rs很小,因此,腐蚀速率由电荷转移电阻Rt所决定。刚浸入3.5%NaCl溶液时,合金的电荷转移电阻很大,随浸泡时间逐渐延长,合金表面反应电阻Rt逐渐减小,表明合金表面活性逐渐增高,溶解加快,电容Q1和Q2随浸泡时间的延长逐渐增大。随着浸泡时间的延长,合金表面腐蚀加剧,腐蚀点增多,表面变粗糙,因此,电容Q1和Q2随之增大。表征点蚀的感抗 L1和 L2随浸泡时间的延长逐渐减小,表示蚀孔内反应加剧,钝化膜逐渐减薄。
2.3 腐蚀形貌
图5所示为腐蚀不同时间试样的典型SEM像。由图5(a)可知,铸态Al-Zn-Sn-Ga合金由α-Al基体、偏析相及晶界组成。腐蚀5 min后,试样表面有小点蚀坑分布于合金晶界,且偏析相已完全脱落,如图5(b)所示。当腐蚀1 h时,形成较大的圆形蚀坑,其水平方向的蚀坑比深度方向的大得多,而蚀坑中心有一小且深的圆孔(见图5(c))。随着浸蚀时间的延长,腐蚀坑逐渐扩大。腐蚀10 d的试样中腐蚀坑已连成一片,表面形成较均匀的腐蚀形貌,如图5(d)所示。

表2 Al-Zn-Sn-Ga合金电化学阻抗的拟合值Table2 Parameters of equivalent elements in equivalent circuit for different samples
2.4 讨论
对铸态Al-Zn-Sn-Ga合金的偏析相粒径进行统计分析,偏析相粒径一般为100~1 500 nm,而合金表面钝化膜的厚度一般为50~200 nm[12],因此,可以认为,试样中的偏析相可穿过氧化膜厚度[13]。根据以上分析,Al-Zn-Sn-Ga合金初始腐蚀发展过程大概可以分为如下3个阶段,其对应的腐蚀模型如图6所示。
1) 偏析相处诱发孔蚀。由于Ga元素在铝合金中的溶解度较大(20%左右),而添加Ga的含量较低,所以,Ga主要与铝合金形成固溶体;Zn在铝合金中的溶解度为 2%左右,Sn在铝合金中的溶解度小于0.01%,未固溶于基体的低熔点元素Zn和Sn在合金凝固时易在晶界和枝晶边界偏聚和析出,形成富 Zn相和 ZnSn相,这些偏析相相对于钝化膜表现为阳极相[14],二者构成腐蚀微电池,形成大阴极、小阳极,在侵蚀性溶液中优先溶解,形成点蚀;另外,由于合金受到溶液中Cl-的吸附作用,破坏了Al阳极表面的钝化膜,进一步促进合金发生点蚀,其腐蚀模型如图6(b)所示。
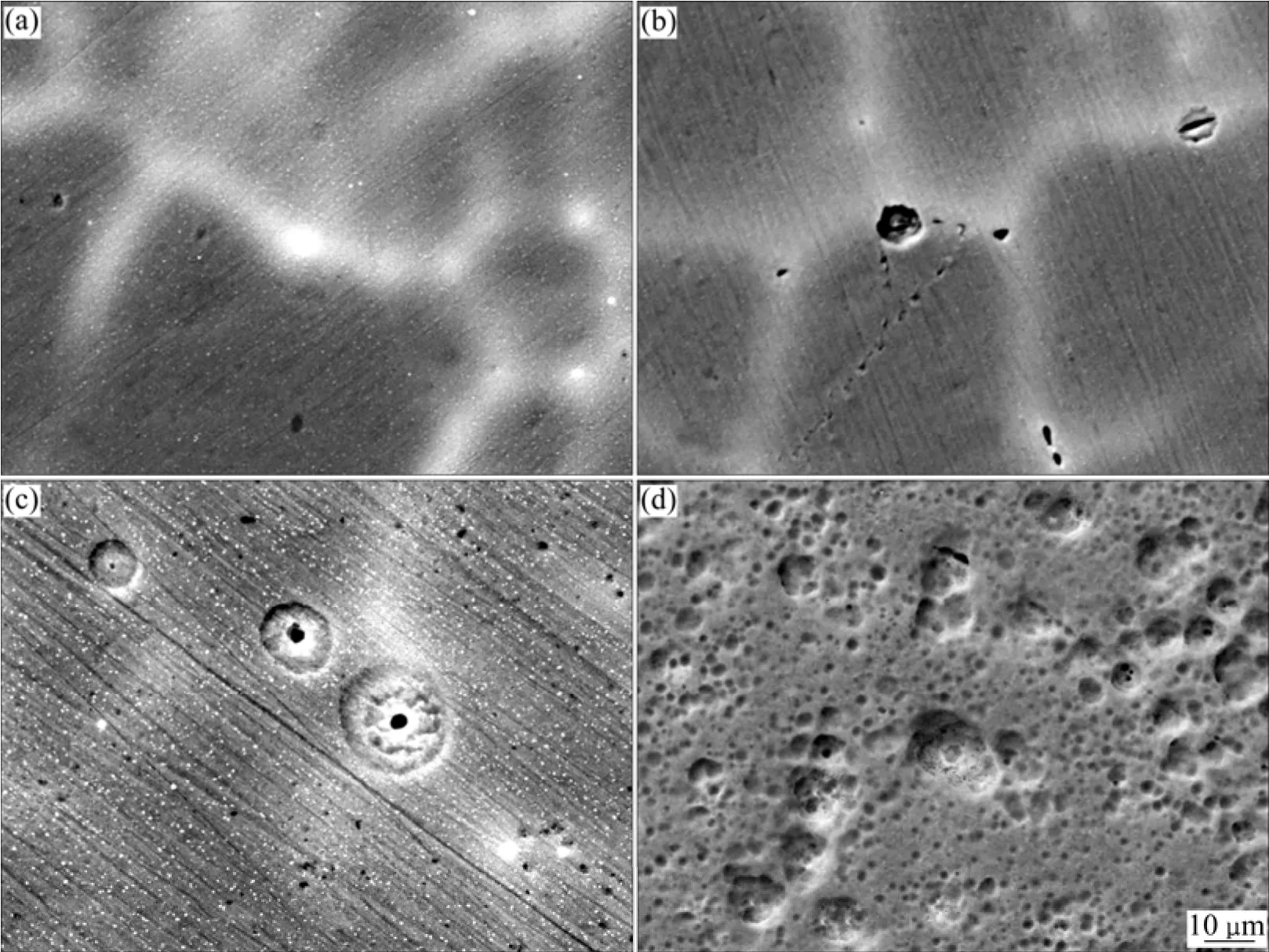
图5 在3.5% NaCl溶液中腐蚀不同时间后Al-Zn-Sn-Ga合金的SEM像Fig. 5 SEM images of Al-Zn-Sn-Ga alloy immersed in 3.5%NaCl solution for 0 mim (a), 5 min (b), 1 h (c) and 10 d (d)

图6 Al-Zn-Sn-Ga合金的腐蚀模型Fig. 6 Schematic models of Al-Zn-Sn-Ga alloy surface during corrosion: (a) Before immersion; (b) Corrosion pitting; (c) Pitting growth; (d) Uniform corrosion
2) 点蚀扩展阶段。由于阳极相较小,与合金表面氧化膜组成小阳极、大阴极腐蚀微电池体系,微阳极相迅速消耗。由于阳极相溶解,在活性点处会出现阳离子富集的现象,结果使 Cl-迁入以维持电中性。因此,蚀孔内会产生较高浓度的MCl,水解的结果使蚀孔内产生高浓度的H+和Cl-,进一步促进蚀坑内合金的溶解。随着偏析相的溶解及孔深的增加,金属离子的传质过程阻力增大,产生浓差极化,导致孔底部电位正移,纵向腐蚀速率减慢。阳极相消耗后形成的Ga3+、Zn2+和 Sn4+的还原电位比 Al3+的电位更正,所以,这些合金元素能回沉积到合金表面取代氧化膜中的铝,活化铝合金。由于Ga3+容易在Sn沉积的周围沉积[15],沉积在点蚀孔处Sn周围的Ga和Al易形成液态Ga-Al汞齐[16]。这些液态合金流动性较好,对氧化膜与基体起到机械分离作用,使新鲜表面不断暴露溶解[17],同时也使腐蚀产物不断脱落,维持点蚀坑长时间的横向活化扩展,横向腐蚀扩展速度很快。另一方面,Ga可使铝阳极表面电荷发生偏移,促进Cl-吸附[18],从而活化阳极,使蚀坑横向扩展进一步加快。其腐蚀模型如图6(c)所示。
3) 引发新的活性点使腐蚀过程继续。当试样表面偏析相溶解后,随着钝化膜的逐渐减薄,下层偏析相裸露出来,成为新的活性点,促进铝阳极的进一步溶解。随着活性元素的沉积,点蚀很快连成一片,发展成为均匀溶解。其腐蚀模型如图6(d)所示。
3 结论
1) 通过测试Al-Zn-Sn-Ga阳极在3.5%NaCl溶液中浸泡不同时间的EIS谱,研究了该阳极合金的腐蚀发展过程和腐蚀特征。
2) 合金在开始浸泡时处于钝化态,其 EIS 谱为反应电阻很大的容抗弧;在浸泡初始阶段, EIS 谱中高频段的容抗弧明显减小且在低频段出现感抗弧,合金进入点蚀期;随浸泡时间的延长,除高频段的容抗弧和中低频段的感抗弧外,低频段又出现一容抗弧,合金处于点蚀扩展期;随浸泡时间的进一步延长,EIS谱在低频段感抗弧消失,出现两个容抗弧,腐蚀达到均匀腐蚀期。因此,该合金的腐蚀分3个阶段:点蚀期,点蚀发展期和均匀腐蚀期。
RFERENCES
[1] 朱元良, 赵艳娜, 齐公台, 刘 斌. 热处理对铝合金牺牲阳极电化学性能的影响[J]. 中国有色金属学报, 2006, 16(7):1300-1306.ZHU Yuan-liang, ZHAO Yan-na, QI Gong-tai, LIU Bin. Effect of heat treatment on electrochemical performance of aluminium alloy sacrificial anode[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(7): 1300-1306.
[2] 王 璇. 铟职业病案凸显政策疏漏[J]. 劳动保护, 2008(9):34-37.WANG Xuan. Indium occupational disease case highlights the policy oversight[J]. Labor Protection, 2008(9): 34-38.
[3] SALINAS D R, GARCÍA S G, BESSONE J B. Influence of alloying elements and microstructure on aluminium sacrificial anode performance case of AlZn[J]. Journal of Applied Electrochemistry, 1999, 29(9): 1063-1071.
[4] 文九巴, 王国伟, 马景灵, 贺俊光, 史志红. Ga 对 Al-Zn-Sn系阳极合金电化学性能的影响[J]. 材料热处理学报, 2010,31(8): 30-34.WEN Jiu-ba, WANG Guo-wei, MA Jing-ling, HE Jun-guang,SHI Zhi-hong. Effect of Ga on electrochemical properties of Al-Zn-Sn series alloy anodes[J]. Transactions of Materials and Heat Treatment, 2010, 31(8): 30-34.
[5] GB/T 17848—1999. 牺牲阳极电化学性能试验方法 [S].
[6] MORLIDGE J R, SKELDON P, THOMPSON G E,HABAZAKI H, SHIMIZU K, WOOD G C. Gel formation and the efficiency of anodic film growth on aluminium[J].Electrochimica Acta, 1999, 44(14): 2423-2435.
[7] VENUGOPAL A, RAJA V S. AC impedance study on the activation mechanism of aluminium by indium and zinc in 3.5%NaCl medium[J]. Corrosion Science, 1997, 39(12): 2053-2065.
[8] LUO T J, YANG Y S, LI Y J, DONG X G. Influence of rare earth Y on the corrosion behavior of as-cast AZ91 alloy[J].Electrochimica Acta, 2009, 54(26): 6433-6437.
[9] 李 翔, 严 彪, 董 鹏, 王宇鑫, 杜春风. Fe基非晶合金的晶化及其在 NaCl 溶液中的电化学腐蚀行为[J]. 中国有色金属学报, 2010, 20(1): 156-162.LI Xiang, YAN Biao, DONG Peng, WANG Yu-xin, DU Chun-feng. Crystallization and electrochemical corrosion behaviors of amorphous Fe-based alloys in NaCl solution[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(1): 156-162.
[10] LI Jin-feng, ZHANG Zhao, CAO Fa-he, CHENG Ying-liang,ZHANG Jian-qing, CAO Chu-nan. Investigation of exfoliation corrosion of rolled AA8090 Al-Li alloy using electrochemical impedance spectroscopy[J]. Transactions of Nonferrous Metals Society of China, 2003, 13(2): 320-324.
[11] 董超芳, 安英辉, 李晓刚, 生 海, 肖 葵. 7A04 铝合金在海洋大气环境中初期腐蚀的电化学特性[J]. 中国有色金属学报, 2009, 19(2): 346-352.DONG Chao-fang, AN Ying-hui, LI Xiao-gang, SHENG Hai,XIAO Kui. Electrochemical performance of initial corrosion of 7A04 aluminium alloy in marine atmosphere[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(2): 346-352.
[12] 朱祖芳. 铝合金阳极氧化工艺技术应用手册[M]. 北京: 冶金工业出版社, 2007: 12-13.ZHU Zu-fang. Aluminum anodizing application manual[M].Beijing: Metallurgical Industry Press, 2007: 12-13.
[13] CABOT P L, GARRIDO J A, PEREZ E, PERÉZ A H. EIS study of heat-treated Al-Zn-Mg alloys in the passive and transpassive potential region[J]. Electrochimica Acta, 1995, 40(4): 447-454.
[14] 刘 斌, 齐公台, 冉 伟, 赵婷婷. 模拟偏析相 Al2Zn在 3%NaCl溶液中的电化学行为[J]. 中国腐蚀与防护学报, 2007,27(2): 93-96.LIU Bin, QI Gong-tai, RAN Wei, ZHAO Ting-ting.Electrochemical behavior of the simulated Al2Zn segregation in 3%NaCl solution[J]. Journal of Chinese Society for Corrosion and Protection, 2007, 27(2): 93-96.
[15] NESTORIDI M, PLETCHER D, WOOD R J K, WANG S C,JONE R L, STOKES K R, WILCOCK I. The study of aluminium anodes for high power density Al/air batteries with brine electrolytes[J]. Journal of Power Sources, 2008, 178(1):445-455.
[16] TUCK C D S, HUNTER J A, SCAMANS G M. Electrochemical behavior of Al-Ga alloys in alkaline and neutral electrolytes[J].Journal of the Electrochemical Society, 1987, 134(12):2970-2981.
[17] FLAMINI D O, SAIDMAN S B. Polarisation behaviour of Al-Zn-Ga alloy in chloride medium[J]. Journal of Applied Electrochemistry, 2008, 38(5): 663-668.
[18] BRESLIN C B, CARROLL W M. Electrochemical behaviour of aluminium activated by gallium in aqueous electrolytes[J].Corrosion Science, 1992, 33(11): 1735-1739.
Electrochemical impedance spectra of Al-Zn-Sn-Ga anode during corrosion process
HE Jun-guang1,2, WEN Jiu-ba2, LI Xu-dong1, HAO Qing-guo2
(1. School of Materials Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China;2. School of Materials Science and Engineering, Henan University of Science and Technology, Luoyang 471003, China)
The corrosion extension process and characteristics of Al-Zn-Sn-Ga anode in 3.5% NaCl (mass fraction)solution for different immersion times were investigated by electrochemical impedance spectroscopy (EIS). The results show that the EIS spectrum at the beginning of immersion consists of a large capacitive arc, indicating the passivation.With the increase of immersion time, the capacitive arc at high frequency is significantly reduced, and an inductive loop at low frequency appears, implying the pitting. With extending the immersion time, another capacitive arc at low frequency appears in EIS spectra, suggesting the pitting growth. With the further prolonging of immersion time, the inductive arc at low frequency disappears, and the EIS spectrum is composed of two capacitive arcs, hinting the uniform corrosion. So, the corrosion of Al-Zn-Sn-Ga alloy initiates from the passive film, and then the pitting, followed by the pitting growth, and finally the uniform corrosion.
aluminum alloy; sacrificial anode; electrochemical impedance spectroscopy; corrosion behavior
TG174.41
A
1004-0609(2012)1-0187-07
河南省科技创新杰出人才计划资助项目(094200510019);河南省自然科学基金资助项目(092300410132)
2010-12-07;
2011-03-27
贺俊光,博士研究生;电话:13525440285; E-mail: he.ellen@163.com
(编辑 陈卫萍)
