猪传染性胃肠炎病毒NC株的分离鉴定及生物学特性试验
2012-11-23牛晓芸王艳丽张显浩陈瑞爱贺东生
钟 望,田 野,牛晓芸,王艳丽,张显浩,陈瑞爱,,贺东生,
(1.华南农业大学兽医学院,广东 广州510642;2.广东省生物制品技术研究与应用企业重点实验室,广东 肇庆526238)
猪传染性胃肠炎病毒(TGEV)属冠状病毒属成员,只有一个血清型,是引起猪传染性胃肠炎(TGE)的病原。TGE是猪的一种急性高度接触性传染病,主要引起2周龄以内的仔猪严重呕吐、腹泻、脱水和高死亡率(可达100%)。1945年,美国的Doyle和HutChings首次报道TGE的存在,现在本病已广泛存在于欧洲、美洲、亚洲各国,20世纪60年代首次在我国猪群中发现该病,在我国该病主要以暴发性和地方流行性两种形式发生,2010年以来流行情况及危害程度日趋加深[1-2]。
TGEV主要编码的结构蛋白有纤突蛋白(S)、膜结合蛋白(M)、核蛋白(N)和小膜蛋白(sM)4种,其中N蛋白高度保守,这为以N蛋白作为该病的诊断提供了理论基础,N蛋白在TGEV的复制和转录过程中也发挥重大作用,同时影响病毒的致病性[3-4]。
本试验从华南地区某猪场疑似感染TGEV猪群中采集典型发病猪肛拭子,经处理后通过血凝(HA)及血凝抑制(HI)试验、中和试验、TCID50测定及RT-PCR检测和序列分析等方法进行鉴定。同时,本试验的TGEV血凝特性不同于国内一些专著中TGEV没有血凝性的报道[5],冉智光等(1997)报道,TGEV通过超速离心或红细胞与病毒-抗血清混合物在4℃孵育1h可产生26~28的凝集效价[6],而本试验发现,在不需要超速离心或4℃孵育的情况下,分离的TGEV NC株细胞毒通过3次冻融后3 000r/min离心3min后即能产生高达26的血凝价,这在国内属首次报道。本试验旨在分离猪传染性胃肠炎病毒华南株,并对其进行深入研究,以期为华南地区猪传染性胃肠炎的检测和防控提供依据。
1 材料与方法
1.1 病毒、细胞、菌株及主要试剂 疑似TGE病猪肛拭子采自华南地区某猪场典型发病仔猪,低温冻存后,送本实验室经无菌处理保存备用;TGEV标准阳性血清抗体,购自瑞士SVANORIR公司;TGEV标准株(Purdue株)、大肠杆菌DH5α由华南农业大学兽医学院传染病教研室保存;PK-15细胞由大华农生药研发中心赠送;细胞培养液(DMEM)、新生牛血清(FBS)为美国 GIBCO/BRL公司产品;质粒抽提试剂盒和凝胶纯化试剂盒为O-mega公司产品;病毒基因组RNA提取试剂盒,购自北京天根生物科技有限公司;ExTaqDNA聚合酶、核酸分子质量标准、pMD18-T Sample vector、M-MLV逆转录酶为TaKaRa公司产品。
1.2 病料处理 无菌采集疑似TGE感染发病仔猪肛拭子,于5mL灭菌生理盐水中混匀,-20℃反复冻融3次,12 000r/min离心10min后取上清经0.22μm微孔过滤器过滤,置-80℃保存备用。
1.3 病毒分离 取-80℃保存的病料上清液,1 mL接种于单层PK-15细胞,37℃吸附1h,弃上清后加入含2%新生牛血清的DMEM培养液,置37℃,5%CO2培养箱中培养3~4d,观察细胞病变(CPE)。若4d后没有CPE,则将培养细胞反复冻融3次,取冻融液1mL盲传进行病毒分离和细胞适应,传至出现较稳定的CPE后收毒,盲传6代未出现CPE则判为阴性。
1.4 病毒的鸡红细胞凝集特性试验 参考冉智光(1997)略作改动,使用分离毒株在PK-15细胞上传代3次后的毒液于-20℃反复冻融3次后离心取上清液按常规方法操作,同时以未接毒的正常PK-15细胞作对照。
1.5 病毒的血凝抑制试验鉴定 分离毒株若有血凝特性,则血凝抑制试验按常规方法操作,进行HI试验时将标准抗体作2倍系列稀释,配制4HA抗原固定不变,以正常PK-15细胞作对照,混合后37℃作用30min,加人0.5%红细胞于37℃作用30 min后判定。
1.6 病毒TCID50的测定 取分离毒株第3代细胞毒液在EP管中作连续10倍稀释,在96孔细胞培养微量板中每孔预先加入含8%小牛血清的培养液50μL,从10-1到10-10连续稀释的病毒液每个稀释度的毒液加一纵8孔,每孔加50μL,然后每孔加细胞悬液100μL(含细胞约4.0×105/mL),同时设细胞阴性对照,置37℃,5%CO2培养箱中培养5~7 d,每天观察记录细胞病变(CPE),按Reed-Muench法计算半数组织培养感染量(TCID50)。
1.7 病毒中和试验 将TGEV阳性抗体进行系列稀释(1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280),加到96孔反应板中,25μL/孔;将病毒稀释到200TCID50,加入到上述各反应孔中,25μL/孔,37℃作用1h;按常规方法制成细胞悬液,50μL/孔加到上述各孔中,37℃培养,逐日观察并记录CPE。同时设立正常细胞对照、不加抗体的病毒液对照、阴性血清对照。
1.8 病毒的RT-PCR鉴定 试验所用引物参照田小艳等(2009)报道,由上海生工生物工程技术服务有限公司合成。上游P1:5′-GATGGCGACCAGATAGAAGT-3′;下游 P2: 5′-GCAATAGGGTTGCTTGTACC-3′,扩增 N基因612bp的片段。然后按Trizol试剂盒说明的方法,直接从病料处理物中提取病毒基因组RNA,加入10μL进行反转录,RT-PCR反应参照试剂盒说明书进行,同时设立阴阳性对照。
1.9 病毒的基因序列分析 将RT-PCR扩增产物经1.0%琼脂糖凝胶电泳鉴定,将目的条带切胶纯化DNA,将纯化DNA与pMD-18TSample Vector于16℃过夜连接,随后转化大肠杆菌感受态细胞DH5α,挑取单个菌落并提取质粒进行电泳鉴定,每个克隆选取2个阳性样品送北京奥科生物技术有限责任公司测序。
2 结果与分析
2.1 病毒分离 病料接种PK-15细胞后24h后即出现典型CPE,36h左右出现明显CPE,CPE表现为细胞变圆,胞浆内形成空泡,融合缩小,细胞界限不清晰,有大片脱落区,没有脱落的细胞出现拉网现象,细胞变细长,胞浆相连(图1A)。当CPE达80%以上时,收毒并命名TGEV NC株,放-80℃冰箱保存备用。
2.2 病毒的鸡红细胞凝集特性试验 HA试验按常规方法进行,NC株的血凝价为26(表1),同时对照组PK-15细胞液均无血凝现象。
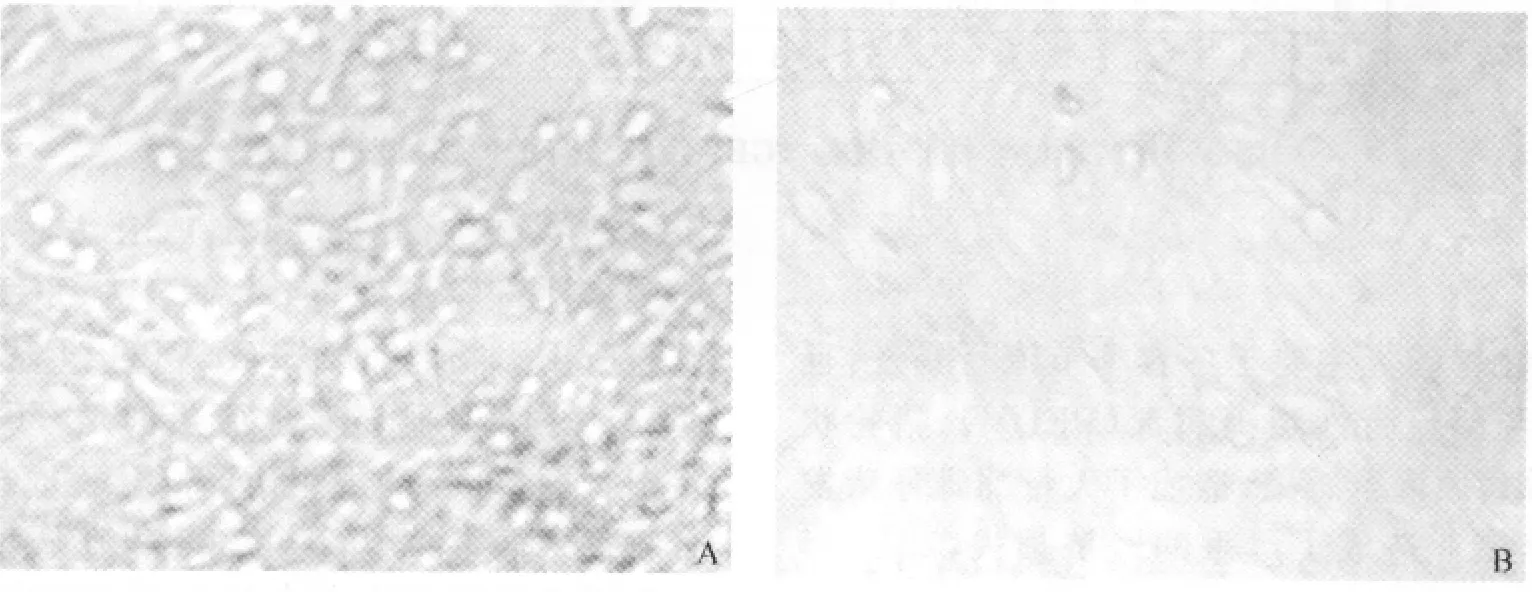
图1 TGEV NC株在PK-15细胞上的细胞病变(100×)

表1 TGEV NC株的HA试验
2.3 病毒的血凝抑制试验 按HA试验结果,配制4HA抗原做HI试验,结果显示,TGEV抗体能抑制分离毒株的血凝作用,且HI滴度为28,同时对照组正常PK-15细胞液全部凝集。
2.4 病毒TCID50的测定 经过7d的观察记录,按Reed-Muench法计算出分离的NC株第3代在PK-15细胞中的 TCID50为10-7.15/0.1mL。
2.5 病毒中和试验 利用固定病毒稀释阳性抗体法进行试验,能保护50%细胞的阳性抗体稀释度介于1∶320~1∶640之间。根据Reed-Muench法计算标准阳性抗体的中和效价为1∶381,而分离毒株与阴性血清作用后全部出现CPE,阳性抗体对细胞毒性试验以及空白试验细胞正常。
2.6 RT-PCR鉴定 分别提取TGEV NC株PK-15细胞传代3次后细胞液及阳性对照(Purdue株)的总RNA,参考说明书方法用M-MLV反转录为cDNA,摸索出特异性引物反应条件后,进行PCR扩增,以正常PK-15细胞液作对照,取5μLPCR产物进行1%琼脂糖凝胶电泳。结果显示,检测引物可以从NC株在PK-15细胞传3代的细胞液、阳性对照中扩增出约612bp的片段,而阴性对照组的正常PK-15细胞液没有扩增出特异性条带(图2)。

图2 TGEV NC株的RT-PCR检测
2.7 TGEV NC株的N基因序列分析 选取国内报道较多的7株TGEV N蛋白基因与分离株的测序结果进行核苷酸同源性分析,结果如图3。分离毒株(NC株)与P115 2007株、Purdue 2007株、SCY 2006株和WH-1 2010株核苷酸同源性最高,均达到99.8%。

3 讨论
猪传染性胃肠炎主要于冬春季节流行暴发,且在近些年多与猪流行性腹泻病毒(PEDV)、猪轮状病毒(RV)等病原混合感染,造成了大量哺乳仔猪发病死亡,给养猪业造成了严重的经济损失,2010年以来TGE在我国一些地区出现了扩大流行的趋势[7]。TGEV与PEDV、RV三种病毒临床表现差异不大,很难通过临床方法进行诊断,本试验对TGEV的分离与鉴定给华南地区的TGE流行情况和诊断方法都提供了一定的参考依据。
TGEV可在多种细胞系如猪睾丸细胞(ST细胞)、猪肾细胞(PK-15细胞、IBRS-2细胞)、猪甲状腺细胞等多种细胞上生长,本试验采取典型腹泻仔猪肛拭子,使用PK-15细胞分离培养,48h内出现了典型的CPE,再通过RT-PCR方法测序后确诊为猪传染性胃肠炎病毒,并命名为TGEV NC株,本试验所用引物是针对TGEV的N基因3′端设计,而N基因所编码的核衣壳蛋白是TGEV主要结构蛋白基因,可与基因组RNA组装成核糖核蛋白复合物掺入病毒粒子,N蛋白不仅在病毒致病性、转录和翻译及增强细胞免疫等方面起到重要作用,而且具有辅助增强病毒RNA复制的能力。比较分离株与其他毒株N基因序列,发现其高度保守,核苷酸同源性在97.2%~99.8%,表明此分离株N基因变异不大。
除了RT-PCR方法外,本试验还使用了HA/HI、病毒中和试验等方法进行鉴定,确定所分离的是TGEV毒株。关于TGEV的血凝性问题,学界内报道不尽相同,现已研究清楚的是IBV、HEV、BCV、HCV等冠状病毒的血凝素都位于病毒的纤突蛋白上[8],TGEV也属于冠状病毒,但不具有独立的血凝素[9],国内直到1997年才由冉智光等报道通过高速离心或4℃孵育后TGEV才会出现部分血凝性,而本试验所分离的TGEV NC株通过-20℃反复冻融3次后低速离心纯化即能有效凝集鸡红细胞,HA滴度为26,且此种血凝性能被TGEV抗体抑制,说明这种血凝性是该TGEV毒株特异的生物学特性,该研究为国内首次报道。
本试验所分离到的NC毒株接种细胞后很快产生典型的 CPE,TCID50高达 108.15/mL,血凝价为26,这些特性与之前国内报道有显著不同,该毒株是否发生了较大变异导致致病力增强及其与疫病暴发的关系等有待进一步的研究。冠状病毒的血凝性与其S基因有密切的关系,我们将开展对NC株S基因及其他基因的变异研究。
[1]宋振辉,郭万柱.猪传染性胃肠炎病毒的分离鉴定及全基因组序列分析[J].病毒学报,2008,24(5):364-368.
[2]王龙涛,葛晨霞,王翠瑜,等.猪传染性胃肠炎病毒吉林株的分离鉴定及S基因的克隆与序列分析[J].中国兽医学报,2010,30(10):1277-1281.
[3]Compton J R,Rogers D B,Holmes K V,etal.In vitro replication of mouse hepatitis virus strain A59[J].J Virol,1987,61(5):1814-1820.
[4]Baric R S,Nelson G W,Fleming J D,etal.In tereactions between coroavirus nueleocapsid protein and virol RNA s:Imp lications for virol tran scrip tion[J].J V irol,1988,62(11):4280-4287.
[5]殷震,刘景华.动物病毒学[M].北京:科学出版社,1985:630-636.
[6]冉智光,王玉春,刘晓滨,等.猪传染性胃肠炎病毒的血凝作用[J].中国兽医科技,1997,27(9):3-4.
[7]黄小波,曹三杰,文心田,等.猪传染性胃肠炎病毒SC-H株的分离与鉴定[J].黑龙江畜牧兽医,2008(8):58-61.
[8]Mockett A P A,Cavanagh D,Brown T D.Monoclonalantibodies to the S1spike and membrane proteins of avian infectious bronchitis coronavirus strain M assachusetts M41[J].J Gen Virol,1984,65:2281-2286.
[9]田志军,王玉春,周连华.猪传染性胃肠炎病毒的血凝位点的定位研究[J].中国预防兽医学报,2000,22(9):61-62.
