α-硫辛酸对镉致大鼠肝脏脂质过氧化损伤保护作用试验
2012-11-23朱道仙贺生中
陆 江,朱道仙,刘 静,卢 炜,贺生中
(江苏畜牧兽医职业技术学院,江苏 泰州225300)
镉作为一种重要的工业毒物和环境化学污染物,可通过多种途径进入人体和蓄积,产生多器官系统损害,其中肝是最主要的靶器官。有研究报道,肝细胞暴露于5μmol/L醋酸镉下24h可引起急性损伤[1],镉引起的脂质氧化反应(LPO)已被看作镉引起损伤的一个重要机制[2]。α-硫辛酸(α-LA)是一种在酵母、菠菜及肉类中发现的生物因子,具有强大的抗氧化作用,被称为“万能抗氧化剂”,更是自由基捕手,是机体细胞利用糖类等能源物质产生能量所需的一种限制性必需营养物质,广泛用于治疗和预防心脏病、糖尿病等多种疾病。其抗氧化能力比维生素E高20倍,并且可提高其他抗氧化剂效果,是已知惟一具备脂、水兼容性的抗氧化剂[3-4]。但尚未有其可拮抗重金属氧化损伤的报道。本研究应用α-LA对染镉大鼠进行干预,探讨α-LA对镉引起的肝氧化损伤的保护作用,为寻找有效防治镉中毒及相关疾病的发生提供新方法。
1 材料与方法
1.1 动物分组与处理 选用9周龄SPF级雄性SD大鼠25只(扬州大学比较医学中心提供),体重180~220g,按体重随机分成5组,每组5只,分别为对照组、单纯染镉组、低剂量α-LA干预组、中剂量α-LA干预组和高剂量α-LA干预组,试验前分笼适应性喂饲7d。
试验方法:对照组和单纯染镉组均先灌胃0.9%生理盐水,低剂量干预组、中剂量干预组和高剂量干预组分别灌胃α-LA(Sigma公司)25mg/kg、50mg/kg、100mg/kg体重,1h后,对照组腹腔注射0.9%生理盐水,其余4组按1.5mg/kg体重腹腔注射氯化镉[5](优级纯,上海试剂二厂),每天1次,连续染毒7d,试验期间大鼠自由进食和饮水,试验设计见表1。
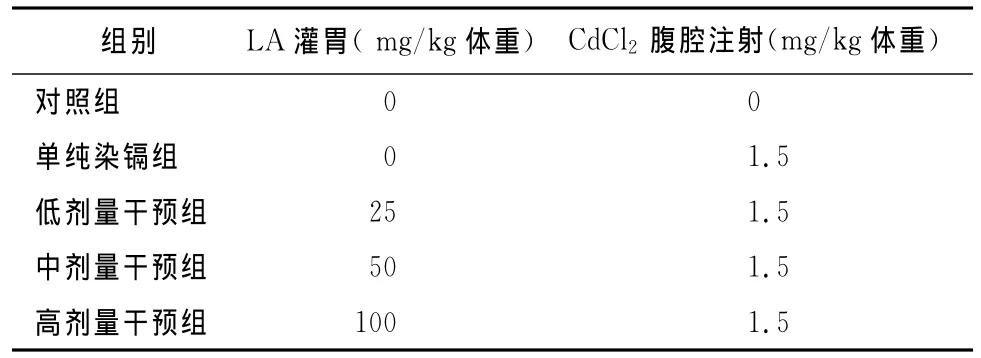
表1 试验设计方案
1.2 肝损伤标志酶测定 末次染毒后24h采血,测定血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和碱性磷酸酶(ALP)活性。用全自动血液生化分析仪(北京众磊生物科技发展有限公司)测定。
1.3 脂质过氧化指标测定 末次染毒后24h将大鼠股动脉放血后颈椎脱臼处死,迅速分离肝脏,制成10%组织匀浆,取上清液进行丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-Px)活性、过氧化氢酶(CAT)活性及蛋白质含量测定,以上均用722型光栅分光光度计(上海精密科学仪器有限公司)测定,试剂均由南京建成生物工程研究所提供。
1.4 统计分析 用SPSS17.0软件单因素分析方法进行组间差异统计学检验,结果用平均值±标准差表示。
2 结果
2.1 肝功能血清酶活性测定 试验大鼠血清肝功能3种酶活性的测定结果见表2。结果表明,与对照组相比,单纯染镉组血清ALT活性升高有极显著差异(P<0.01);与单纯染镉组相比,低剂量干预组血清ALT活性降低(P<0.05),中剂量干预组和高剂量干预组ALT活性降低极显著(P<0.01),高剂量干预组血清ALT活性与对照组无差异(P>0.05)。单纯染镉组血清AST活性极显著高于对照组(P<0.01),高剂量干预组极显著低于单纯染镉组(P<0.01),但与对照组无差异(P>0.05);低剂量干预组与中剂量干预组亦低于单纯染镉组(P<0.05),而高于对照组,差异分别为极显著(P<0.01)和显著(P<0.05)。与对照组比较,单纯染镉组血清ALP活性升高较大(P<0.01),低剂量干预组与中剂量干预组略高(P<0.05),高剂量干预组无差异(P>0.05);与单纯染镉组比较,低剂量干预组、中剂量干预组及高剂量干预组的血清ALP活性极显著降低(P<0.01)。这说明α-LA可以减少镉致大鼠肝脏的损伤,并且呈一定量效关系。

表2 大鼠血清肝功能酶的活性变化 (U/L)
2.2 肝脏组织脂质过氧化指标测定 大鼠肝组织脂质过氧化指标测定见表3。由表3可见:与对照组比较,单纯染镉组肝组织中MDA含量升高明显(P<0.01),α-LA 各剂量组与单纯染镉组比较MDA量降低,其中中、高剂量组差异极显著(P<0.01),但均高于对照组;单纯染镉组SOD活性明显低于对照组(P<0.01),α-LA低剂量组与中剂量组SOD低于对照组(P<0.01,P<0.05),但高于单纯染镉组,高剂量干预组SOD活性高于单纯染镉组(P<0.05),与对照组无明显差异(P>0.05);与对照组比较,单纯染镉组及低剂量干预组的GSH-Px活性降低明显(P<0.01),中剂量组GSH-Px活性亦降低(P<0.05),α-LA 低、中剂量干预组 GSHPx活性高于单纯染镉组,差异有统计学意义(P<0.05),高剂量组GSH-Px活性极显著高于单纯染镉组(P<0.01);单纯染镉组及低剂量干预组的CAT活性极显著低于对照组(P<0.01),中剂量干预组CAT活性高于单纯染镉组(P<0.05)但低于对照组(P<0.05),高剂量干预组与单纯染镉组比较,CAT活性显著升高(P<0.01)且与对照组无统计学差异(P>0.05)。结果表明:α-LA可以降低染镉大鼠肝组织中MDA的含量,并能提高肝组织中SOD、GSH-Px及CAT的活性,且呈一定的量效关系,以高剂量干预组效果最好,说明α-LA对镉致肝组织脂质过氧化损伤有一定的保护作用。
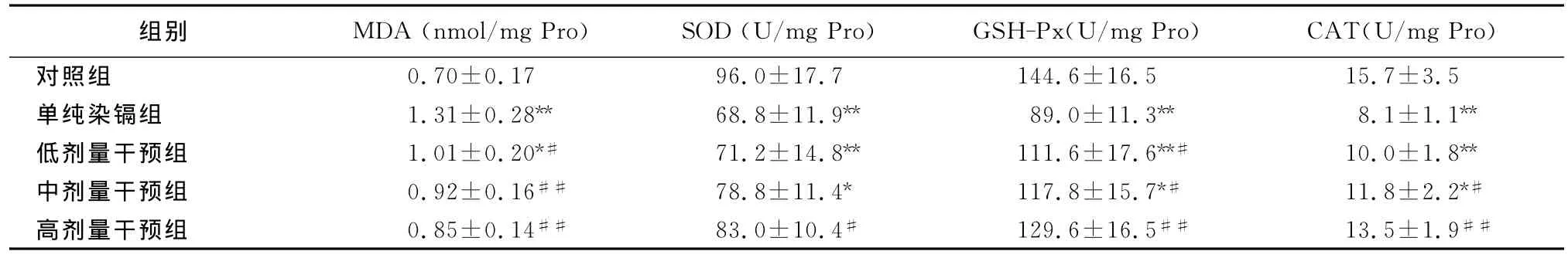
表3 α-LA对镉致大鼠肝组织脂质过氧化的影响
3 讨论
镉造成大鼠肝脏的结构和功能的损害,主要表现为血清天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)和碱性磷酸酶(ALP)活力升高[6]。本试验发现,单纯染镉组的AST、ALT及ALP活性升高(P<0.01),而α-LA各干预组的肝损伤标志性酶的活性低于单纯染镉组,以高剂量组最为明显(P<0.01),表明α-LA可拮抗镉致肝脏的损伤作用。
镉对肝脏的损伤作用主要与脂质过氧化有关[7-8]。镉是一种很强的脂质过氧化诱导剂,一定剂量的镉可引起一系列的脂质过氧化反应,使脂质过氧化产物MDA含量增加,而MDA可造成DNA分子链断裂或碱基缺失,破坏各种生物模结构的完整性,从而给机体细胞带来严重的损害,此外,镉还可抑制GSH-Px、SOD、CAT等抗氧化酶的活性,从而加剧脂质过氧化反应。而α-LA是一种代谢型抗氧化剂,其与在生物体内的还原型产物二氢硫辛酸(DHLA),能清除几乎所有的自由基和活性氧[9]。本试验表明,染镉引起大鼠肝组织MDA含量升高(P<0.01),α-LA 各剂量组 MDA 含量随α-LA 给药剂量增加而下降,中高剂量组MDA含量与对照组差异无统计学意义(P>0.05),说明α-LA可以阻断镉诱导的脂质过氧化进程,从而保护肝脏避免脂质过氧化。此外,α-LA各剂量干预组SOD、GSHPx、CAT等抗氧化酶的活性都有所增加,呈量效关系,这可能与α-LA的氧化还原激活了生物体内抗氧化酶的代谢循环,进而形成独特的生物抗氧化剂再生循环网络,维持了机体正常的抗氧化剂水平,共同发挥生物抗氧化作用有关[10]。综上所述,α-LA对重金属镉致肝脏的脂质过氧化损伤有一定的保护作用。
[1]汪纪仓,张英,裔传卉,等.镉对大鼠原代肝细胞的毒性损伤[J].中国兽医学报,2010,30(4):527-529.
[2]El-Demerdash F M,Yousef M I,Kedwany F S,etal.Cadmium in-duced changes in lipid peroxidation,blood hematology,biochemical pa-rameters and semen quality of male rats:protective role of vitamin Eand beta-carotene[J].Food Chem Toxicol,2004,42(10):1563-1571.
[3]Gokhan S,Okkes Y,Tulin G,etal.Effect of vitamin C and lipoicacid on streptoztocin-induced diabetes gene expression:mRNA andprotein expressions of Cu-Zn SOD and catalase[J].Mol Cell BioChem,2008,309:109-116.
[4]张瓅文,丁美会,杨喻晓,等.硫辛酸抗氧化性及其生理保健功能研究进展[J].科技通报,2009(4):432-436.
[5]陈美珠,苏洁贞,邹志方,等.枸杞多糖对镉致大鼠肝抗氧化酶损伤的保护作用[J].职业与健康,2010,11(22):2613-2614.
[6]陈敏,谢吉民,程晓农,等.镉对小鼠肝脏的毒性作用机理探讨[J].江苏大学学报:医学版,2002,12(4):321-323.
[7]汪纪仓.镉致大鼠肝细胞毒性机理研究[D].扬州:扬州大学,2010.
[8]朱善良,陈龙.镉毒性损伤及其机制的研究进展[J].生物学教学,2006(8):2-4.
[9]Paker L,Witt E T,Trirschler H J.Alpha lipoic acid as a biological antioxidant[J].Free Radical Biol Med,1995,19:227-235.
[10]马慧敏,周安国,王之盛,等.硫辛酸的抗氧化功能及其在动物生产上的应用现状[J].饲料工业,2006(22):9-11.
