谷胱甘肽巯基转移酶基因多态性在原发性肝细胞癌人群中的研究
2012-11-23唐耘天李辛平刘天奇杨建荣罗建强梁中骁
唐耘天,李辛平,刘天奇,杨建荣,罗建强,梁中骁
(广西壮族自治区人民医院 肝胆外科,广西 南宁530021)
原发性肝细胞癌(Hepatocellular carcinoma,HCC)是我国男性常见的恶性肿瘤,发病率呈逐年上升的趋势[1]。流行病学研究表明:黄曲霉毒素B1(Aflatoxin B1,AFB1)暴露和乙型肝炎病毒(Hepatitis B virus,HBV)感染是肝癌发生的高危因素。随着人类基因组计划的进展,肝癌与基因多态性的研究日益受到重视。AFB1的主要代谢解毒酶-谷胱 甘 肽 巯 基 转 移 酶 (Glutathione S-transferase,GSTs),其基因多态性与肿瘤的关系是目前研究的热点。本研究选取GSTs家族中的GSTM1、GSTT1、GST01、GSTP1,采 用 Multiplex-PCR 和PCR-RFLP技术检测肝癌患者和健康对照者的GSTM1、GSTT1缺失情况,及 GST01-Ala140Asp、GSTP1-Ile105Val位点的多态性,并加以比较研究,探寻GSTs基因多态性与肝癌发生发展的关系。
1 材料与方法
1.1 研究对象 肝癌组为本院2008年10月至2010年10月住院已经病理证实的男性原发性肝细胞癌患者150例,年龄23-62岁。对照组为男性体检健康者150例年龄25-65岁。两组年龄分布具有可比性(P>0.05)。
1.2 试剂和仪器 DNA抽提试剂盒(Qiagen公司)、PCR引物(上海捷瑞生物工程有限公司)、限制性内切酶(New England Biolabs公司)、聚合酶链式反应(PCR)仪(MJ Research公司)。
1.3 实验方法 采EDTA抗凝静脉血,离心分层获取中间层多核细胞。GSTM1和GSTT1采用多重PCR(Multiplex-PCR)检验,以β-珠蛋白(β-globin,268bp)为参照基因;GST01-Ala140Asp、GSTP1-Ile105Val位点采用 PCR-RFLP技术。受检各基因各位点检测参考文献方法[2-4]。PCR基本反应条件为95℃预变性2min、94℃变性15s、62℃退火30s、72℃延伸30s,共约35个循环,最后72℃延伸5min(各基因位点略有不同)。PCR反应体系容积为25μl:0.25μl Platinum Taq polymerase(1.25μ)、2.5μl 10×PCR buffer、0.8μl MgCl2(50mM)、0.5 μl deoxynucleotide triphosphate(dNTPs,10mM)、0.5μl引物(10pmol/μl)、1μl基因组DNA(50ng)、19.45μl去离子水。PCR产物及酶切产物行琼脂糖凝胶电泳,根据不同条带大小(bp)判定表型:GSTM1和 GSTT1(M1:215、268 bp;T1:268、480bp;M1T1:215、268、480bp;M1T1-null:268bp);GST01-Ala140Asp(Ala/Ala:127bp;Asp/Ala:68、59、127bp;Asp/Asp:68、59 bp);GSTP1-Ile105Val(Ile/Ile:176bp;Ile/Val:85、91、176bp;Val/Val:85、91bp)
1.3 统计学方法 采用SAS9.1统计软件分析。各基因多态性在两组间的差异采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 GSTs基因多态性结果分析 以GSTs基因位点多态性型别进行两组比较,显示各基因位点多态性在病例和对照两组间的差异无显著性,P>0.05;将基因多态型别中的杂合子与突变型合并后与野生型比较,多态性的比例在病例和对照两组间的差异也无显著性,P>0.05;见表1。
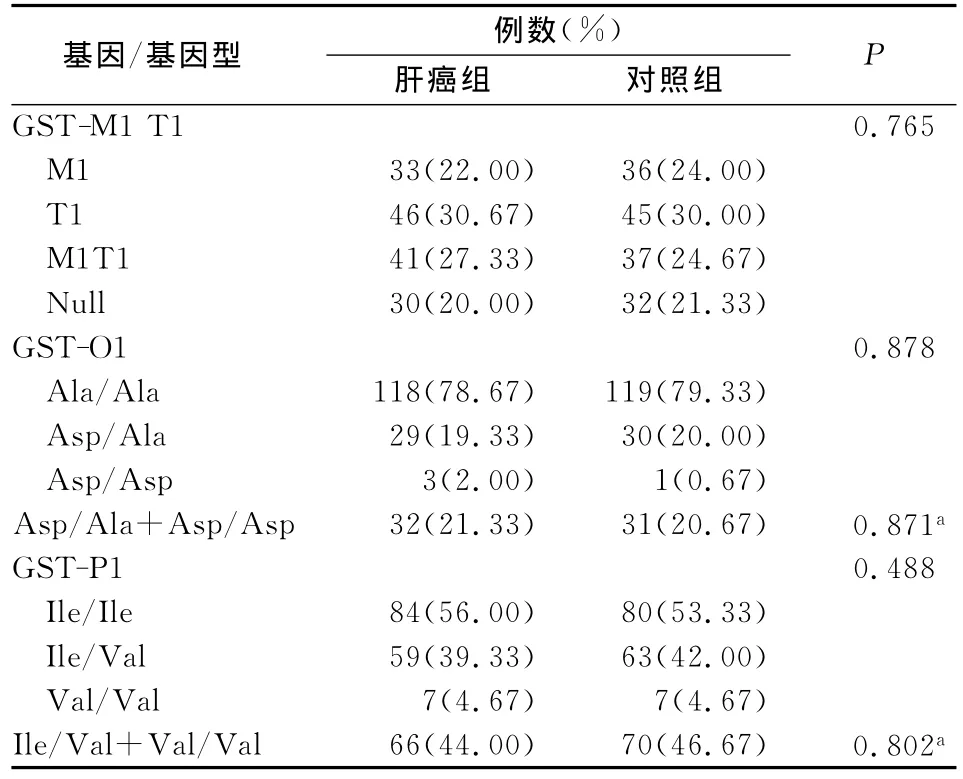
表1 GSTs基因多态性在两组研究对象中的比较
3 讨论
黄曲霉毒素是一种真菌代谢产物,已报道的有:B1、B2、G1、G2、M1、M2六型,以 AFB1毒性最强。由黄曲霉菌与寄生曲霉菌产生[5]。研究显示,黄曲霉毒素在代谢之前是无致癌性,摄入体内后经第一阶段代谢酶代谢后的产物可能是其致癌作用的关键[5],如:黄曲霉毒素 M1(AFM1)、黄曲霉毒素 Q1(AFQ1)、AFB1环氧化物(AFBO)等。这些亲电子的代谢产物与细胞内大分子物质,如脱氧核糖核酸(DNA)、核糖核酸(RNA)、蛋白质结合并造成损害。同时,体内的第二阶段代谢酶,特别是谷胱甘肽转移酶(glutathione S-transferase,GST),可以解毒代谢第一阶段的毒性代谢产物,最终形成不同的终末物质从尿液中排出。
GST基因家族已报道有7个亚族,其代谢解毒的主要机制为:将还原性谷胱甘肽(glutathione,GSH)与体内疏水性的毒性代谢产物结合,增加其亲水性以利于机体的代谢排出。在AFB1的代谢产物中,GSTs主要针对的是具有氧化活性的AFBO,其与细胞内的大分子物质形成共价加合物,特别是作用于DNA后形成的8-羟基脱氧鸟苷(8-OHdG),被认为是AFB1诱导HCC发生的点突变起源[6]。GST基因家族存在多态性,可以影响GST酶的解毒代谢活性,从而导致不同个体间黄曲霉毒素代谢水平的差异,其中GSTM1和GSTT1可表现为特殊的缺失型或空白型(GSTM1-null、GSTT1-null),具有此类基因型的个体在组织中不能表达GSTM1和GSTT1酶,因此也决定不同个体之间毒性物质代谢水平的高低,最终导致不同个体在肿瘤发生上的差异性。但是,已发表的研究结果对GSTM1和GSTT1缺失型是否为肝癌的危险因素仍存在争议[7]。不同种族和地区之间GSTM1和GSTTl基因缺失率波动范围也较大,在亚洲人群中GSTM1和GSTT1的缺失比例范围分别为17-75%和16-64%[7]。而本研究的实验对象中GSTM1-null和GSTT1-null的比例分别为病例组42.00%和50.67%;对照组为45.33%和51.33%。在GST01-Ala140Asp和GSTP1-Ile105Val基因位点中,变异等位基因的出现的频率分别为21.00%和45.33%。在肝癌病例和对照组间基因多态性类型出现频率基本一致,无显著性差别。这些结果与既往的广西和国内人群的结果接近或一致[8-10],但是并没有反映出GSTM1、GSTT1的缺失,及 GST01-Ala140Asp、GSTP1-Ile105Val位点的多态性在肝癌病例人群和健康人群间的差别。
我们认为这样的结果与目前肿瘤发生研究的主流共识是相一致的,即肿瘤的发生是由遗传基因和环境因素共同作用的结果。遗传基因只是其中的一部分,决定了个体是否具有肿瘤易感基因。而另一方面,环境中的多种致癌因素,如化学物质、物理因素、病毒等等都可作用于个体,并与内部的诸多因素相互作用,最终导致肿瘤的发生发展。另一方面,广西还是一个相对比较落后和蔽塞的农业地区,人口流动相对较少、外来人口比率偏低、具有比较稳定的人口组成,这也是造成该地区人权基因多态性结果较为稳定的主要原因。综上,广西地区肝癌的高发生率可能与该地区人群的遗传基因关系并不密切,而是与该地区人群的黄曲霉毒素高暴露率有关[11]。
[1]McGlynn KA,London WT.The global epidemiology of hepatocellular carcinoma:present and future[J].Clin Liver Dis,2011,15(2):223.
[2]Wang LD,Zheng S,Liu B,et al.CYP1A1,GSTs and mEH polymorphisms and susceptibility to esophageal carcinoma:study of population from a high-incidence area in north China[J].World J Gastroenterol,2003,9(7):1394.
[3]Yu L,Kalla K,Guthrie E,et al.Genetic variation in genes associated with arsenic metabolism:glutathione S-transferase omega 1-1and purine nucleoside phosphorylase polymorphisms in European and indigenous Americans[J].Environ Health Perspect,2003,111(11):1421.
[4]Chan QK,Khoo US,Ngan HY,et al.Single nucleotide polymorphism of pi-class glutathione s-transferase and susceptibility to endometrial carcinoma[J].Clin Cancer Res,2005,11(8):2981.
[5]Wogan GN,Hecht SS,Felton JS,et al.Environmental and chemical carcinogenesis[J].Semin Cancer Biol,2004,14(6):473.
[6]Boysen G,Pachkowski BF,Nakamura J,et al.The formation and biological significance of N7-guanine adducts[J].Mutat Res,2009,678(2):76.
[7]Nie F,Chen Z,Cao C,et al.Absence of Association Between GSTM1and GSTT1Polymorphisms and Melanoma Susceptibility:A Meta-Analysis[J].DNA Cell Biol,2011,30(10):783.
[8]Long XD,Ma Y,Wei YP,et al.The polymorphisms of GSTM1,GSTT1,HYL1*2,and XRCC1,and aflatoxin B1-related hepatocellular carcinoma in Guangxi population,China[J].Hepatol Res,2006,36(1):48.
[9]Fu S,Wu J,Chen F,et al.Polymorphisms of Glutathione S-transferases Omega-1among ethnic populations in China[J].BMC Genet,2008,10(9):29.
[10]Zhong SL,Zhou SF,Chen X,et al.Relationship between genotype and enzyme activity of glutathione S-transferases M1and P1in Chinese[J].Eur J Pharm Sci,2006,28(1-2):77.
[11]唐耘天,黄天壬,王加生.黄曲霉毒素暴露和谷胱甘肽转移酶基因多态性检测在原发性肝癌高危人群中的研究[J].广西医科大学学报,2008,25(5):694.
