移居高原地区青年男性细胞遗传学损伤的观察分析
2012-11-23崔建华张占平桂俊豪余伍忠
杨 柳,王 瑞,崔建华张占平,桂俊豪,高 亮,何 江,余伍忠*
(1.兰州军区乌鲁木齐总医院临床医学研究所,新疆 乌鲁木齐830000;2.解放军第18医院高山病研究所,新疆 叶城844000;3.解放军第12医院检验科,新疆 疏勒844000)
在生物学和医学领域,高原系指海拔3000m以上、能激发生物体(包括人、动植物以及微生物)能产生明显的生物效应环境和高度。高原环境是地球上一个特殊的生态环境系统,其独特的气候特征引发的连锁应激反应在系统、器官和分子细胞水平甚至基因水平均对机体具有深刻的影响[1]。目前高原医学的研究在高原生理、急性高原病、高原肺水肿、高原营养等方面进展很快,但有关高原环境暴露的细胞遗传学损伤影响的研究仍然有限。从细胞遗传学及人类健康保护的角度出发,客观评估高原恶劣环境对人体健康状况的影响,有助于科学制定相关防护措施,有重要的经济和国防建设意义。
本文利用外周血淋巴细胞培养技术、姐妹染色单体交换和微核生成分析技术,对移居高原地区青年男性的相关细胞遗传学指标进行观察分析。
1 对象与方法
1.1 研究对象 观察组选择驻守在海拔5000-5400米高原地区某部男性官兵67人,年龄18-25岁,分别在进入高原地区之前及一年后进行追踪调查,因各种原因失访16人,实际完成51人;对照组选择同期入伍驻守海拔800米左右地区某部男性官兵53人,年龄18-25岁之间。
所有研究对象在了解内容并签署了知情同意书后进行了相应的体格检查和病史调查,排除放射线接触史及其他明显致畸因素的影响。
1.2 研究方法
1.2.1 微量外周血淋巴细胞培养及淋巴细胞微核标本制作方法与分析 采用胞质分裂阻断微核法(Cytokinesis-block micronucleus method)检测微核细胞。具体方法如下:将肝素抗凝静脉血0.4ml注入含20%胎牛血清和PHA的RPMI1640培养基,37℃培养至44h,加入细胞松弛素B(Cyt-B),终浓度为4.Oμg/ml,继续培养至72h,收获细胞。1000 rpm离心10分钟;弃上清,加入0.044mol/L的KCl低渗液8ml,混匀,置37℃水浴5分钟;加入新鲜配置的Carnoy’s固定液0.3ml,混匀,静置2分钟;1000rpm离心10分钟后弃上清,弹指法混匀沉淀物,再加入8mlCarnoy’s固定液,混匀,固定5 min;1000rpm离心10分钟后弃上清,加入数滴固定液,混匀;气干法制片,晾干;以pH6.8的PBS配置1∶10的Giemsa染液对标本染色12min,蒸馏水冲洗、晾干;微核观察与分析:于油境下,选择胞核、胞质完整,着色清晰的淋巴细胞,盲法观察微核(微核的存在状态及判断方法:存在于胞质中、与主核完全脱离、呈圆形或椭圆形、边缘光滑、着色与主核一致 、大小为主核1/3以下的小核)出现频率。每一份样本分析1000个细胞核。微核率以千分率表示。
1.2.2 姐妹染色单体交换(SCE)标本制作步骤及分析 外周血淋巴细胞接种同上,培养一开始即加入BrdU液(终浓度至10μg/ml培养液),充分混匀;以不透光黑纸包裹培养物,于暗处继续培养50 h;加秋水仙液(终浓度至0.2μg/ml培养液)处理2 h;弃上清,加入0.044mol/L的 KCl低渗液8ml,混匀,置37℃水浴5分钟;加入新鲜配置的Carnoy’s固定液0.3ml,混匀,静置2分钟;1000rpm离心10分钟后弃上清,弹指法混匀沉淀物,再加入8ml-Carnoy’s固定液,混匀,固定5min;1000rpm离心10分钟后弃上清,加入数滴固定液,混匀;气干法制片,标本置室温放置2~3天;差异化染色前1天,将标本玻片置37℃恒温箱过夜;次日,以2×SSC液封片,水蒸气熏蒸及紫外线照射30min均按本室常规进行,蒸馏水冲洗,4%的Giemsa液染色10min后即可。
镜检:选择在加入BrdU后经过2个复制周期、姐妹染色单体差异化着色清晰、染色体分散良好、染色体数目完整且长短适宜的中期分裂相,计数发生SCE的次数。每一份标本分析40个中期分裂相,计算每个细胞的SCE平均数。SCE计数原则为:染色体末端的交换计为1次交换,短臂或长臂的中间发生的交换计为2次交换。
2 结果
结果显示,观察组驻守高原前微核细胞率和微核率分别为0.41±0.03和0.49±0.03,与对照组的0.43±0.06和0.53±0.07相比无显著差异(P>0.05);驻守高原一年后观察组的微核细胞率和微核率有明显升高,分别为0.60±0.05和0.76±0.07,与一年前相比有显著性差异(P<0.05),如表1示。
SCE频率观察组驻守高原前为6.25±1.24/细胞,分布范围为4.1~8.9/细胞;对照组为6.61±1.29/细胞,分布范围在4.2~8.7/细胞,两组间无显著性差异(P<0.05)。驻守高原一年后观察组SCE频率为8.93±1.52/细胞,分布范围为4.9~10.6/细胞,与一年前相比有显著性差异(P<0.05),如表2示。

表1 移居高原地区青年男性微核率的变化
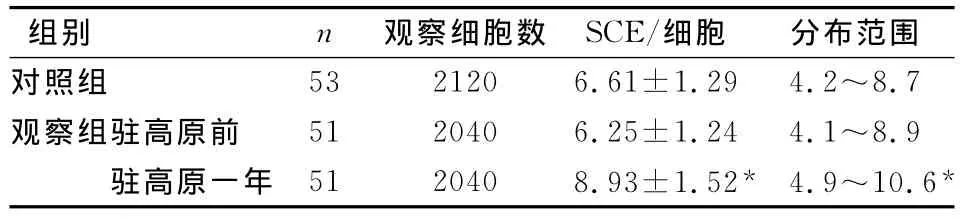
表2 移居高原地区青年男性SCE频率的变化
3 讨论
高原恶劣环境是人们进行高原作业或执行任务时不得不面临的自然因素,高原环境对人体健康影响的不利因素主要是由于其独特的气候特点如空气稀薄、氧分压低、日光辐射强、寒冷干燥风大等,人进入高原后所处的内外环境是导致组织结构和功能变化的最主要的因素。我国高原地域辽阔,边境线长,经济和国防战略地位十分重要,对移居高原人群的医学研究尤为重要。我们在以往的研究中发现:高原环境中移居人群的染色体畸变率明显高于低海拔地区和世居高原人群,提示高海拔地区的低氧和高本底辐射暴露是造成移居高原地区人群染色体畸变率增高的可能原因[2]。在本文中,我们采用自身前后对照的方法,选择驻守高原的某部官兵,对移居高原地区青年男性的细胞传学损伤指标进行观察分析,进一步证实了上述结果。
外周血淋巴细胞微核测定是评价群体辐射效应的一种简便而有价值的细胞遗传学指标[3],淋巴细胞微核是细胞内染色体断裂或纺锤丝受影响而在细胞有丝分裂后期滞留在细胞核外的染色物质。它来源于染色体断片或有丝分裂过程中丢失的整条染色体,在有丝分裂后期不能纳入子核而在细胞浆中形成单个或多个小核。微核实验能检测放射诱导产生的染色体完整性改变和染色体分离改变,微核率的大小直接反映染色体的损伤程度,与染色体畸变发生率呈正相关,也间接地代表受染色体损伤的状况[4]。
我们采用胞质分裂阻断微核法(cytokinesisblock micronucleus method)[5]对移居高原地区青年男性的微核率进行了检测分析,结果显示,观察组驻守高原前微核细胞率和微核率分别为0.41±0.03和0.49±0.03,与对照组的0.43±0.06和0.53±0.07相比无显著差异(P>0.05);驻守高原一年后观察组的微核细胞率和微核率有明显升高,分别为0.60±0.05和0.76±0.07,与一年前相比有显著性差异(P<0.05),提示高原环境对移居高原人体的微核率有明显的增加作用。
姐妹染色单体交换(sister chromatid exchange,SCE)是指两条姐妹染色单体在相同位置上发生的同等对称的片段交换。SCE主要在DNA复制期间形成,所代表的是同源位点复制产物间的交换,标志着染色体在DNA水平上存在不稳定性损伤。SCE频率是检测遗传不稳定性和早期染色体DNA损伤极为灵敏的指标,既可用于检测各种诱变因素和致癌因素对人体DNA的损伤,又可作为探讨染色体断裂和修复机制的良好手段。SCE频率增高表明染色体不稳定或修复能力低下,意味着DNA受损[6]。本文结果显示:观察组驻守高原前SCE频率为6.25±1.24/细胞,分布范围为4.1~8.9/细胞;对照组为6.61±1.29/细胞,分布范围在4.2~8.7/细胞,两组间无显著性差异(P<0.05);驻守高原一年后观察组SCE频率为8.93±1.52/细胞,分布范围为4.9~10.6/细胞,与一年前相比有显著性差异(P<0.05),提示高原环境可能存在引起人体DNA损伤的因素。
微核和SCE分析技术简便、易操作,灵敏度高,现已成为遗传毒理学中成熟的主要研究方法。本文利用可反映体内有无染色体损伤的微核试验和反映体内有无DNA损伤的姐妹染色单体交换(SCE)试验对移居高原的青年男性进行了细胞遗传学评价,结果提示高原环境对移居人群具有一定的遗传损伤作用,长期在高原环境作业可导致染色体断裂和DNA损伤,但其详细机制仍待进一步研究。
虽然高原医学的研究已经取得了长足的进步和发展,但多数研究侧重于高原生理、急性高原病、高原肺水肿、高原营养等方面,并且目前对高原环境所致人体损伤的生物学机理、阈值效应和健康危险度原则等尚未得到完全理解。随着分子生物学技术和危险度评价方法的完善,将可能最终对高原暴露环境中的各种有害因素进行全面科学地评估,全面、科学地阐明高原环境暴露对人体健康的影响及其机制,并寻求改善及防治方案,提高近、远期高原医学防护水平,为我国高原开发和建设服务。
[1]吕伟宏,田怀军.高原环境对男性生殖健康的影响[J].实用预防医学,2006,(4):1090.
[2]余良宽,胡 边,冯 静,等.新疆高原地区塔吉克族、汉族官兵细胞遗传学的比较分析[J].中国优生与遗传杂志,2006,(8):33.
[3]Cerqueira EM,Santoro CL,Donozo NF,et al.Genetic damage in exfoliated cells of the uterine cervix.Association and interaction between cigarette smoking and progression to malignant transformation[J].Acta Cytol,1998,42(3):639.
[4]Patino-Garcia B,Hoegel J,Varga D,et al.Scoring variability of micronuclei in binucleated human lymphocytes in a case-control study[J].Mutagenesis,2006,21(3):191.
[5]Fenech M.The cytokinesis-block micronucleus technique:a de-tailed description of the method and its application to genotoxicity studies in human populations[J].Mutat Res,1993,285(1):35.
[6]彭 伟,汤秀明.VDT作业女性外周血淋巴细胞姐妹染色单体互换、微核及绒毛微核的研究[J].现代妇产科进展,2001.(02):86.
