氯化甲基汞和甲氨蝶呤对Jurkat细胞凋亡的影响
2012-11-23赵玲玲李小翠刘秀花毕晓颖李志超袁长吉
赵玲玲,李小翠,刘秀花,毕晓颖,李志超,袁长吉*
(1.吉林大学白求恩第一医院肿瘤中心,吉林 长春130021;2.吉林大学公共卫生学院,吉林 长春130021)
MMC为烷基汞化合物,具有良好的脂溶性,极易透过血脑屏障;能够诱导自由基的产生、改变细胞内Ca2+环境、影响蛋白质的磷酸化、干扰线粒体功能以及DNA的复治[1],具有多靶点细胞毒效应,促进肿瘤细胞凋亡。考虑MMC理化结构特点以及多靶点抗肿瘤效应,研究者提出MMC治疗白血病的新策略。临床上常应用高剂量甲氨蝶呤(High-dosemethotrexate,HDMTX)治疗急性淋巴细胞白血病[2](Acute lymphoblastic leukemia,ALL)。本实验选择MTX作为阳性对照,通过体外细胞实验研究MMC诱导Jurkat细胞凋亡的情况,有望为白血病的治疗提供一种新的化疗药物。
1 材料与方法
1.1 试剂与仪器 Jurkat细胞(吉林大学第一医院肿瘤中心冻存);RPMI1640培养基(美国Gibco公司);胎牛血清(FBS)(美国 Gibco公司);MTT(北京鼎国生物技术有限公司);二甲基亚砜(DMSO)(Sigma);AnnexinⅤ-FITC/PI凋亡试剂盒(碧云天生物技术研究所);酶标仪(美国Bio-Rad Model 550);倒置相差显微镜(日本Olympus公司);流式细胞仪(美国BD公司)。
1.2 细胞培养 Jurkat细胞,在含10%胎牛血清的RPMI1640培养基中,置于37℃,5%CO2饱和湿度培养箱中培养。每2-3天换液传代1次,传至2-3代后取对数生长期细胞用于本实验。
1.3 MTT比色法检测MMC和MTX对Jurkat细胞增殖的抑制率 分别取对数期生长期Jurkat细胞,进行细胞计数调整细胞密度为1×105个·mL-1,每孔90μl接种于96孔板中。分别取1.25、2.5、5、10和20μmol·L-1的 MMC或 MTX 10μl加入到对数期生长的Jurkat细胞中,设3个平行复孔。药物作用24小时后,显微镜下观察细胞生长状态。每孔加入 MTT 20μl,37℃,5%CO2培养4小时,1 000r·min-1离心5min,弃上清,每孔加入DMSO 150μl,充分混匀后用用酶标仪570nm测定各孔吸光度值(A值),计算细胞增殖抑制率。细胞增殖抑制率=(1-(实验组A值-调零孔A值)/(对照组A值-调零孔A值))×100%。
1.4 细胞凋亡率检测 分组同上,常规收集细胞,应用2.50、5.00、10.00和20.00μmol·L-1MMC和MTX作用24h,细胞计数调整至1×105个·mL-1,各取1ml,1000r·min-1离心5min,弃上清,加入195μl Annexin V-FITC结合液轻轻重悬细胞;加入5μl Annexin V-FITC,混匀后室温避光孵育10分钟;1 000r·min-1离心5min,弃上清,加入190μl Annexin V-FITC结合液轻轻重悬细胞;加入10μl PI染色液,混匀后进行流式细胞仪检测。
1.5 统计学分析 细胞增殖抑制率以±s表示,采用SPSS17.0软件进行t检验。
2 结果
2.1 MMC和MTX对Jurkat细胞增殖抑制作用MTT结果显示不同剂量的MMC和MTX作用Jurkat细胞24h,随着剂量的增加,其对细胞增殖的抑制率逐渐上升,呈现明显的剂量依赖性。在10 μmol·L-1药物浓度下,MMC组较MTX组细胞增殖抑制率明显增加,两组差异比较有统计学意义(P<0.05)(见表1)。
表1 不同药物对Jurkat细胞增殖抑制率(24h,n=3,±s,η/%)
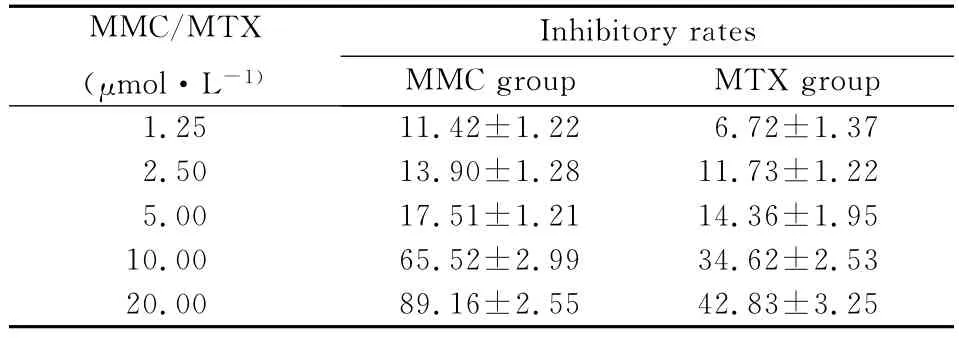
表1 不同药物对Jurkat细胞增殖抑制率(24h,n=3,±s,η/%)
* 与MTX组对比P<0.05
MMC/MTX(μmol·L-1)rates MMC group MTX group Inhibitory 1.25 11.42±1.22 6.72±1.37 2.50 13.90±1.28 11.73±1.22 5.00 17.51±1.21 14.36±1.95 10.00 65.52±2.99 34.62±2.53 20.00 89.16±2.55 42.83±3.25
2.2 MMC和MTX对Jurkat细胞凋亡的影响 应用AnnexinⅤ/PI双染法进行流式细胞学检测,结果显示,对照组凋亡率(0.15±0.03)%,10μmol·L-1的MMC和MTX诱导Jurkat细胞的凋亡率分别为(54.65±3.15)%,(26.32±2.64)%;实验组较对照组相比差异有统计学意义(P<0.05),且MMC组与 MTX组相比较差异有显著性(P<0.05)(见图1)。
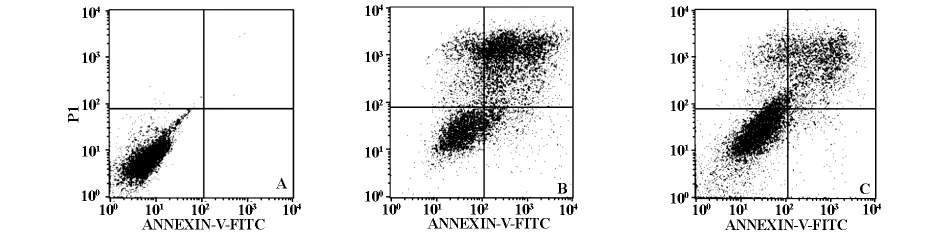
图1 不同药物诱导Jurkat细胞凋亡的流式细胞仪检测结果
3 讨论
本实验结果显示,不同浓度MMC和MTX均可抑制Jurkat细胞增殖,且抑制率与浓度正相关;Jurkat细胞接触10μmol·L-1的 MMC凋亡率开始明显增加,且与同浓度MTX作用相比较差异有显著性。可见MMC有促进白血病细胞凋亡的作用,与MTX相比其诱导凋亡作用更为显著。
ALL是儿童恶性肿瘤中最常见的疾病,占小儿恶性肿瘤的50%左右[3]。因其极易发生神经系统浸润,死亡率较高。因此寻找一种新的能够有效诱导肿瘤细胞凋亡并容易透过血脑屏障的药物是目前淋巴细胞白血病治疗亟待解决的问题。临床上常用甲氨蝶呤进行治疗,使用常规剂量的MTX很难通过人体内的“血脑屏障”,“血睾屏障”等,极易导致中枢浸润或疾病复发。HDMTX能够透过上述屏障,达到治疗的目的。但是随着药物剂量的加大其毒副作用也随之增加,临床上很多病人往往很难承受化疗药物带来的这一不良作用[4,5]。MMC属于烷基汞化合物,具有良好的脂溶性,极易透过血脑屏障。具有多靶点细胞毒效应,可引起DNA断裂,其烷基结构能与DNA碱基相互作用形成双链内及链间交联,影响 DNA 复制[6],诱导自由基的生成[7];同时影响细胞内Ca2+环境,升高细胞内 Ca2+负载[8];并影响线粒体膜电位,改变其膜通透性,使细胞色素C释放至胞浆并与Apaf-1结合,引起Caspase级联反应,诱导细胞凋亡[1]。本实验证实 MMC能够有效诱导Jurkat细胞凋亡,且较MTX作用显著;同时MMC为脂溶性化合物,极易透过血脑屏障,能够起到预防和治疗中枢神经系统白血病的作用。有望为白血病的临床治疗提供一种新的化疗药物。
MMC对各种蛋白质和氨基酸的巯基有极高的亲和力。而调控细胞凋亡和增殖的许多酶都含有巯基,巯基是其作用的触发器,MMC与巯基结合后可干扰酶的活性,并影响线粒体的功能,影响细胞呼吸和氧化磷酸化过程,继而发生一系列抗癌的分子生物学事件[9,10]。MMC抑制Jurkat细胞的增殖,促进其凋亡可能与上述机制存在密切的关联。我们会在后续的实验中进一步验证其诱导细胞凋亡的确切机制。
[1]Ou YC,Thompson SA,Kirchner SC,et al.Induction of growth arrest and DNA damage-inducible genes Gadd45and Gadd153in primary rodent embryonic cells following exposure to methylmercury[J].Toxicol Appl Pharmacol,1997,147(1):31.
[2]Li XH,Yin D,Yang L.High-dose methortrexate therapy in children with acute lymphoblastic leukemia in blood concentration analysis[J].China Pediatr Blood Cancer,2009,14(6):253.
[3]张 颜,何明生.急性淋巴细胞白血病靶向基因治疗的研究进展[J].当代医学,2010,16(2):36-6,47.
[4]Sukhotnik I,Shteinberg D,Ben LS,et al.Effect of transforming growth factor-alpha on enterocyte apoptosis is correlated with EGF receptor expression along the villus-crypt axis during methotrexate-induced intestinal mucositis in a rat[J].Apoptosis,2008,13(11):1344.
[5]Stewart DJ.Tumor and host factors that may limit efficacy of chemotherapy in non-small cell and small cell lung cancer[J].Crit Rev Oncol Hematol,2010.
[6]Al-shahrislani H,shihab KM.Varitations of biological half–life of methylmercury in man.[J].Arch Environ Health,1974,28(6):342.
[7]Hunter AM,Brown DL.Effects of microtubule-associated protein(MAP)expression on methylmercury-induced microtubule disassembly.[J].Toxicol Appl Pharmacol.2000,166(3):203.
[8]Ou YC,Thompson SA,Ponce RA,et al.Induction of the cell cycle regulatory gene p21 (Waf1,Cip1)following methylmercury exposure in vitro and in vivo[J].Toxicol Appl Pharmacol,1999,157(3):203.
[9]卢香兰,王萍萍,李 霞.三氧化二砷对人白血病细胞株NB4和K562及 MOLt4的增殖、周期及凋亡的影响[J].肿瘤防治杂志,2004,6(11):586.
[10]Chen GQ,Zhu J,Shi XG,et al.In vitro studies on cellular and molecular mechanisms of arsenic trioxide(As2O3)in the treatment of acute promyelocytic leukemia:induces NB4cell apoptosis with down regulation of Bcl-2-express and modulation of PML-RARa/PML1p rotema[J].Blood,1996,3:1052.
