吗啡对乳腺癌MCF-7细胞生存素及livin表达的影响
2012-11-22钱宁孙灿林姜琳赵国军蒋小芹于鸿
钱宁,孙灿林,姜琳,赵国军,蒋小芹,于鸿
(1.姜堰市人民医院麻醉科,江苏 姜堰225500;2.泰州市人民医院麻醉科,江苏泰州225300;3.泰州市人民医院病理科,江苏泰州225300)
吗啡作为一种临床常用的阿片类药物,广泛应用于终末期癌症疼痛及各种中重度非癌症疼痛治疗,其镇痛作用及机制已被深入研究。近年来的研究表明,吗啡可促进肿瘤细胞的凋亡并抑制肿瘤细胞的增殖,但具体机制并不十分明了。本研究通过观察不同浓度吗啡对体外培养的人乳腺癌MCF-7细胞生存素(survivin)和livin表达的影响,探讨其促进细胞凋亡及抑制细胞增殖的机制。
1 材料与方法
1.1 主要材料
人乳腺癌细胞株MCF-7(中国科学院上海细胞生物研究所),DMEM、胎牛血清、RT-PCR试剂盒(Gibco公司,美国),二甲基亚砜(DMSO)、四氮噻唑盐(MTT)、Annexin V-FITC试剂盒(Sigma公司,美国),兔抗人survivin多克隆抗体、兔抗人livin多克隆抗体(Santa Cruz公司,美国),ABC试剂盒(Vector公司,美国),吗啡(批号:110120-2,东北制药集团公司沈阳第一制药厂),PCR引物由上海英骏生物技术有限公司合成。
1.2 细胞培养及分组
人乳腺癌细胞株MCF-7培养于含10%胎牛血清、100 μg/ml链霉素、100 U/ml青霉素的 DMEM 培养液,37℃,5%CO2培养箱培养。取对数生长期细胞重悬,以1×103个/ml接种在6孔板内,培养24 h,采用随机数字表法,将MCF-7细胞随机分为3组:对照组,不作任何处理;0.1μmol/L吗啡组,加入终浓度0.1 μmol/L 吗啡;1.0 μmol/L 吗啡组,加入终浓度1.0 μmol/L 吗啡。每组18 孔。
1.3 RT-PCR法检测生存素和livin mRNA表达
于吗啡孵育24 h时,每组各取18孔细胞,用Trizol抽提总RNA,逆转录成cDNA,等量cDNA依照本实验室常规方法[1]进行PCR。PCR引物序列:内参照GAPDH上游5'-ACCACAGTCCATGCCATGCCATCAC-3';下游 5'-CCACCACCCTGTTGCTGTAG-3',预计扩增片段长度为450 bp。生存素上游5'-GGACCACCGCATCTCTACAT-3';下游 5'-GCACTTTCTTCGCAGTTTCC-3',预计扩增片段长度为338 bp。Survivin反应条件:50℃逆转录30 min,95℃灭活逆转录酶15 min,94 ℃ 变性2 min,60 ℃ 复性1 min,72 ℃ 延伸 1 min,共35个循环。livin上游5'-GTCCCTGCCTCTGGGTAC-3';下游 5'-CAGGGAGCCCACTCTGCA-3',预计扩增片段长度为368 bp。内参照及livin反应条件同上。
1.4 蛋白质印迹法检测生存素和livin蛋白表达
于吗啡孵育24 h时,每组各取18孔细胞,经本实验室常规方法[2]使用细胞裂解液提取细胞总蛋白,用BCA法进行蛋白含量测定,依标准方法进行8%SDS-PAGE变性电泳,转移至PVDF膜。PVDF膜用10%羊血清37℃封闭10 min。一抗为兔抗人survivin多克隆抗体(1∶100),兔抗人livin多克隆抗体(1∶100),二抗为生物素化山羊抗兔多克隆抗体(1∶500,ABC 试剂盒)。
1.5 MTT法检测细胞增殖水平
分别于吗啡孵育24,48及72 h时,每组各取18孔细胞,将各组细胞以1×103个/ml细胞数接种于96 孔板中,每孔加入 MTT(5 mg/ml)20 μl,继续培养 4 h,每孔加入 150 μl DMSO,震荡 10 min,置酶标仪上检测490 nm波长处光密度(D)值。取18孔D值的平均值表示细胞增殖水平。
1.6 流式细胞仪检测细胞凋亡
于吗啡孵育24 h时,每组各取6孔细胞,重悬细胞,离心后弃上清,取细胞沉淀,采用Annexin VFITC试剂盒进行测定,以FACSCalibur流式细胞仪(BD公司,美国)分析,每孔重复测定3次,取平均值,计算细胞凋亡率。
1.7 定量和统计分析
凝胶电泳用凝胶成像仪进行拍照记录,Kodak Digital Science 1D扫描分析系统测定条带的积分光密度(ID)。采用SPSS 13.0统计软件分析,计量资料以均数±标准差(±s)表示,组间比较采用成组t检验。
2 结果
2.1 生存素mRNA和蛋白表达的改变
RT-PCR 结果显示,与对照组相比,0.1 μmol/L吗啡组生存素 mRNA表达显著降低(t=18.375,P <0.01),1.0 μmol/L 吗啡组生存素 mRNA 表达亦显著降低(t=16.241,P < 0.01),0.1 μmol/L 吗啡组与1.0 μmol/L吗啡组间差异无统计学意义(t=1.946,P >0.05),见图 1。蛋白质印迹结果显示相对分子质量16 500蛋白条带(图2)。与对照组相比,0.1 μmol/L 吗啡组与 1.0 μmol/L 吗啡组生存素蛋白表达均显著降低(t分别为12.497和15.536,P 均 <0.01),0.1 μmol/L 吗啡组与 1.0 μmol/L 吗啡组间差异无统计学意义(t=2.183,P >0.05),见表1。

表1 各组细胞生存素mRNA及蛋白表达的改变x ± s,n=18Tab 1 The expression of survivin mRNA and protein in different groups

图1 RT-PCR法检测生存素mRNA的表达Fig 1 RT-PCR analysis for detecting Survivin mRNA

图2 蛋白质印迹法检测Survivin蛋白的表达Fig 2 Western blot analysis for detecting Survivin protein
2.2 Livin mRNA和蛋白表达的改变
RT-PCR 结果显示,与对照组相比,0.1 μmol/L吗啡组livin mRNA表达显著降低(t=12.458,P <0.01),1.0 μmol/L 吗啡组 livin mRNA 表达亦显著降低(t=14.539,P <0.01),0.1 μmol/L 吗啡组与1.0 μmol/L吗啡组间差异无统计学意义(t=2.844,P >0.05),见图3。蛋白质印迹结果显示相对分子质量31 000蛋白条带(图4)。与对照组相比,0.1 μmol/L 吗啡组与 1.0 μmol/L 吗啡组livin蛋白表达均显著降低(t分别为11.227和9.675,P 均 < 0.01),0.1 μmol/L 吗啡组与 1.0 μmol/L吗啡组间差异无统计学意义(t=1.837,P >0.05),见表2。
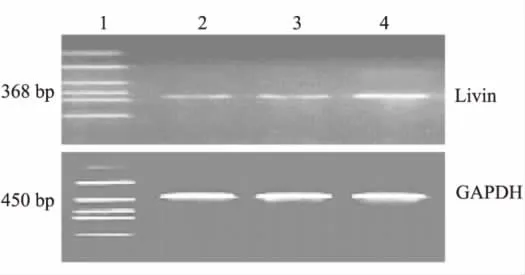
图3 RT-PCR法检测livin mRNA的表达Fig 3 RT-PCR analysis for detecting livin mRNA

图4 蛋白质印迹法检测Livin蛋白的表达Fig 4 Western blot analysis for detecting Livin protein
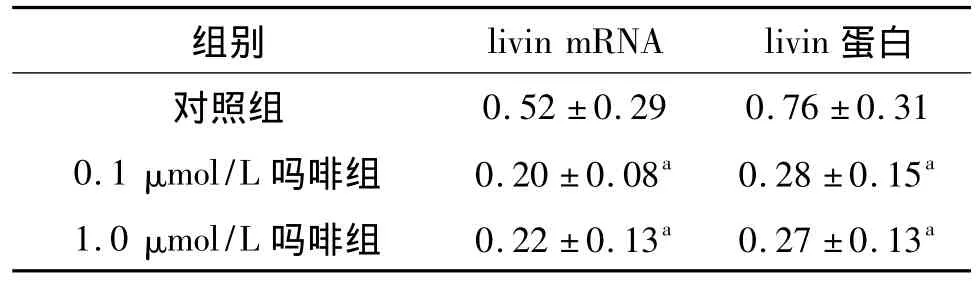
表2 各组细胞livin mRNA及蛋白表达的改变x ± s,n=18Tab 2 The expression of livin mRNA and protein in different groups
2.3 MCF-7细胞增殖活性的改变
MTT 结果显示,在吗啡孵育 24 h 时,0.1 μmol/L吗啡组和1.0 μmol/L吗啡组D值比对照组均显著降低,细胞增殖受到抑制,差异具有统计学意义(t分别为13.874 和15.367,P 均 <0.01),0.1 μmol/L吗啡组与1.0 μmol/L吗啡组间差异无统计学意义(t=2.984,P >0.05)。在吗啡孵育 48 h 及72 h 时各组间差异均无统计学意义(P>0.05)。见表3。

表3 MTT检测各组细胞的D值x ± s,n=18Tab 3 MTT analysis for detecting D value in different groups
2.4 MCF-7细胞凋亡的改变
流式细胞仪凋亡检测结果显示,吗啡孵育24 h 时,对照组、0.1 μmol/L 吗啡组及1.0 μmol/L 吗啡组凋亡率分别为(6.09±1.34)%、(12.98±3.15)%、(12.92 ±3.27)%。与对照组相比,0.1 μmol/L吗啡组凋亡率显著增加(t=18.375,P<0.01),1.0 μmol/L吗啡组凋亡率亦显著高于对照组(t=16.294,P < 0.01),0.1 μmol/L 吗啡组与1.0 μmol/L吗啡组凋亡率比较差异无统计学意义(t=2.638,P >0.05)。见图 5。
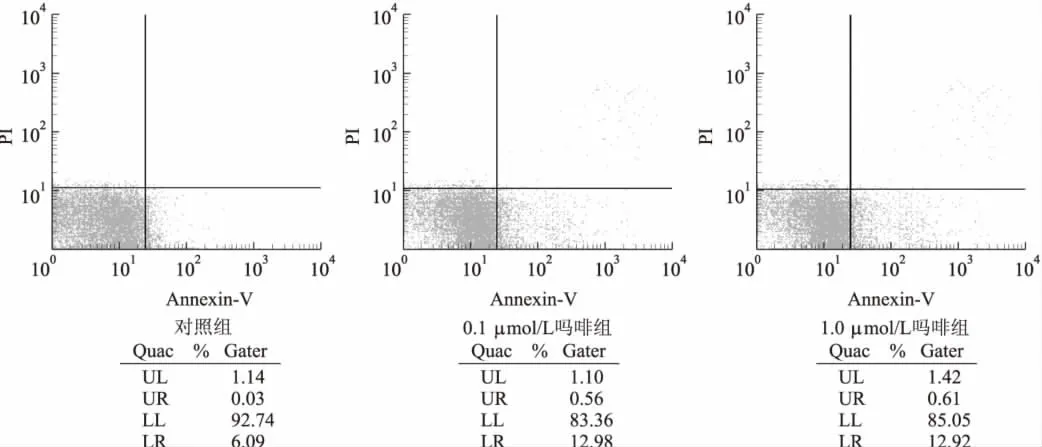
图5 流式细胞仪检测各组细胞凋亡率Fig 5 Flow cytomertry for detecting cell apoptosis ratio
3 讨论
Maneckjee 等[3]研究表明,0.1 ~1.0 μmol/L 吗啡可抑制人肺腺癌细胞增殖,并促进细胞出现DNA碎裂、凋亡小体形成等凋亡的特征性变化。覃怡等[4]报道,10 μmol/L 吗啡可抑制胃腺癌 MGC-803细胞增殖、促进细胞凋亡。Ecimovic等[5]报道,吗啡血浆浓度0.1 mol/L即可缓解乳腺癌患者疼痛,但用于癌痛治疗时,个体差异较大,因此本研究中吗啡浓度选择为0.1 μmol/L 及1.0 μmol/L,在上述浓度吗啡孵育乳腺癌MCF-7细胞后,结果发现,MCF-7细胞凋亡率显著升高,而细胞增殖显著降低,提示吗啡可促进乳腺癌MCF-7细胞凋亡并抑制其细胞增殖,这与Maneckjee及覃怡等报道结果基本一致。
生存素和livin是凋亡抑制因子(inhibitor of apoptosis protein,IAP)家族中近年来新发现的成员,在多种肿瘤细胞中高表达,参与抑制细胞凋亡,与肿瘤发生、发展密切相关,可作为肿瘤的早期诊断及预后评估的新靶点[6]。生存素还促进细胞转化,参与细胞有丝分裂、血管生成和肿瘤细胞耐药性的产生[7]。研究表明,生存素和 livin主要通过抑制Caspase的活性,阻断其级联反应,从而抑制凋亡的进程,另外也可通过激活TAKI/JNK1信号传导途径或参与TNF/NF-κB信号通路而发挥抗细胞凋亡作用[8]。本实验发现,用 0.1 μmol/L 及 1.0 μmol/L吗啡孵育后,MCF-7细胞生存素和livin蛋白及mRNA表达均比对照组显著减少,该结果提示吗啡可能通过下调生存素和livin的表达而抑制乳腺癌细胞增殖、促进乳腺癌细胞凋亡。然而,对于吗啡参与抑制恶性肿瘤的细胞增殖、促进细胞凋亡的作用机制还远未阐明。研究表明,吗啡除可与细胞表面Fas受体结合,通过FADD/P53信号通路促进细胞凋亡,还与TNF/NF-κB细胞凋亡信号通路存在相互作用或相互串话(cross talk)[9]。这些实验结果提示我们,在今后进一步研究吗啡在乳腺癌细胞增殖及凋亡中所起作用时,还必须加强Fas信号通路与其他信号通路之间的相互关系的实验研究,才能从本质上阐明其发生机制。
[1]刘庆宏,于鸿,黄俊星,等.Smad4基因对胰腺癌细胞E-cadherin、β-catenin表达及增殖的影响[J].中华全科医学,2011,9(12):1831 -1832.
[2]许斌,肖蔚,焦霞,等.生存素反义寡核苷酸对乳腺癌MCF-7细胞株MMP-2及MMP-9表达的影响[J].江苏大学学报:医学版,2011,21(3):203 -207.
[3]Maneckjee R,Minna JD.Opioids induce while nicotine suppresses apoptosis in human lung cancer cells[J].Cell Growth Differ,1994,5(10):1033 -1040.
[4]覃怡,唐小曼,廖淳杰,等.吗啡对人胃癌MGC-803细胞p53 mRNA和E2F-1 mRNA表达的影响[J].中华麻醉学杂志,2010,30(7):840 -842.
[5]Ecimovic P,Murray D,Doran P,et al.Direct effect of morphine on breast cancer cell function in vitro:role of the NET1 gene[J].Br J Anaesth,2011,107(6):916 -923.
[6]Xi RC,Biao WS,Gang ZZ.Significant elevation of survivin and livin expression in human colorectal cancer:inverse correlation between expression and overall survival[J].Onkologie,2011,34(8/9):428 -432.
[7]Kita A,Nakahara T,Takeuchi M,et al.Survivin suppressant:a promising target for cancer therapy and pharmacological profiles of YM155[J].Nippon Yakurigaku Zasshi,2010,136(4):198 -203.
[8]Yan B.Research progress on livin protein:an inhibitor of apoptosis[J].Mol Cell Biochem,2011,357(1/2):39 -45.
[9]Lin X,Li Q,Wang YJ,et al.Morphine inhibits doxorubicin-incuced reactive oxygen species generation and nuclear factor kappaB transcriptional activation in neuroblastoma SH-SY5Y cells[J].Biochem J,2007,406(2):215-221.
