一株拮抗细菌所产抑菌物质的特性分析及初步鉴定
2012-11-22贾翠英张玉辉马晓况
贾翠英,张玉辉,马晓况
(河南科技学院生命科学与技术学院,河南 新乡 453003)
自1945年Johnson等报道枯草芽孢杆菌产生拮抗物质以来,人们已从枯草芽孢杆菌的不同菌株中分离出几十种抗菌物质,并弄清了这些抗菌物质是一类从简单分子到复杂化合物即从杆菌肽(bacitracin)[1],大环脂(eyeleopetite)[2-3],到类似噬菌体颗粒等[4]不同成分组成的物质,此外,其中一部分是低分子量的抗菌素,也有一些蛋白性的抗菌物质[5].目前研究较多的拮抗物质是细菌素和抗生素以及细菌的次生代谢产物.
1954年,Abo-El-Dahabll[6]发现青枯菌间有拮抗作用,有些菌株具有产生抑菌物质的能力,后来Cupples[7]对这种物质进行分析,证明它是含蛋白质的细菌素(Bactericin).1979年,Echandi[8]深入研究细菌素的特性,认为carotovoricin和chrysonothemicin为蛋白质大分子细菌素.王金生等[9]从来自水稻的菊欧氏杆菌(E.chrysanthemi)分离提取一种细菌素,通过试验研究证明,细菌素是一种细菌产生的对不同细菌系或亲缘种的细菌有拮抗作用的抗菌物质,其成分主要为蛋白质、多肽、核苷酸、生物碱类.任欣正等[10]从青枯假单胞杆菌(Pseudomonassolanacearum)菌株提纯出具有生物活性的细菌素,分子量为19 ku,具有蛋白质性质,含16种氨基酸.目前产生细菌素的细菌主要种类有:土壤放射杆菌(A.radiobacter)、丁香假单胞菌(P.syringae)、密执安棒形杆菌(Clavibactermichiganesis)、菊欧氏杆菌(E.chrysanthemi)、甘蓝黑腐黄单胞菌(Xanthomonascampestris).这些产细菌素的细菌进行生防时,可以直接用于大田防治,如对细菌性冠瘿病和青枯病的防治[11].据研究报道,细菌素的主要作用是抑菌而不是溶菌作用或杀菌.
拮抗细菌的抑菌机制主要有4种.1.拮抗作用:拮抗细菌的同化作用产生能抑制病原菌的抗菌物质,一般在低浓度下就能对病原菌的生长和代谢产生抑制,引起细胞内溶现象[12].2.竞争作用:就是营养物质的竞争、物理位点、生态位点的抢占以及氧气的竞争.3.寄生作用:就是侵入到病原菌体内获得营养籍以生存和发展,常以吸附生长、缠绕、侵入、消解等多种形式抑制病原菌.4.诱导系统抗性(ISR):就是采用非亲和性的病原物或其他因素诱导植物产生抗性.植物因诱导所激发的系统抗性与植物所产生的抵抗挑战菌的代谢产物有关.国外,利用无毒青枯菌突变体处理番茄幼苗和马铃薯块茎表现一定程度的抗病性[13],研究认为青枯菌细胞壁表层脂多糖中的脂质是引起保卫反应的诱导体.大量研究结果表明[14-15],拮抗细菌的抑菌结果主要造成病原菌畸形、产生泡状物、破坏病原菌的细胞壁、引起细胞内含物外溢,有的造成菌丝扭曲、原生质凝聚、生长点膨大、细胞壁破裂、菌丝崩溃,对孢子萌发有一定抑制作用.
本实验通过对一株拮抗细菌发酵产生的拮抗物质的一些理化性质的研究分析并进一步对拮抗物质进行分析鉴定,为进一步提高拮抗细菌拮抗性能提供一定参考数据,同时也为拮抗细菌更好地应用提供必要的理论依据.
1 材料与方法
1.1材料拮抗细菌(Enterobactersp.)由河南科技学院分离工程教研室提供;指示菌为大肠杆菌、枯草芽孢杆菌、地衣芽孢杆菌、苏云金芽孢杆菌、炭疽杆菌,由河南科技学院微生物教研室提供.
1.2试剂莫式试剂[16]:称取α-萘酚5 g,溶于95%乙醇并稀释至100 mL.此试剂需新鲜配制,并储于棕色试剂瓶中.菲林试剂[16](临时用时将试剂A和B等体积混合),试剂A:称取硫酸铜34.5 g,溶于蒸馏水并稀释至500 mL;试剂B:称取氢氧化钠125 g,酒石酸钾钠137 g,溶于蒸馏水并稀释至500 mL.0.1%茚三酮溶液[16]:称取0.1 g茚三酮溶液溶于95%乙醇并稀释至100 mL.pH 8.0磷酸缓冲液:将0.2 mol/L磷酸氢二钠94.5 mL和0.2 mol/L磷酸二氢钠5.3 mL混匀.
1.3仪器回转式恒温调速摇瓶柜:型号YPN-I(上海通特电讯设备厂);电热式蒸汽消毒器:型号Q602(山东新华医疗仪器厂);单人双面净化工作台:型号SW-CJ-1F(苏州净化设备有限公司);电子天平:型号JA5002(上海精天电子仪器有限公司);台式离心机:型号TD2-40B(上海安亭科学仪器厂);隔水式电热恒温培养箱:型号PYX-DHS-50X65-B5(上海跃进医疗器械厂);电热恒温水浴锅:型号HH.SY21-Ni(北京市长风仪器仪表公司);电热鼓风干燥箱:型号101-2(上海市实验仪器总厂);快速混匀器:型号SK-1(江苏金坛市医疗仪器厂).
1.4 菌种活化及发酵培养
1.4.1 菌种活化 将4 ℃冰箱内保存的拮抗细菌(Enterobactersp.)和指示菌:大肠杆菌、枯草芽孢杆菌、地衣芽孢杆菌、苏云金芽孢杆菌、炭疽杆菌分别转接到斜面培养基(组成为牛肉膏5 g/L,蛋白胨10 g/L, 葡萄糖10 g/L,氯化钠5 g/L,琼脂18 g/L, pH 7.2),28 ℃培养24 h,备用.
1.4.2 种子液的制备和指示菌的培养 拮抗菌种子液的制备:取2~3 环活化的拮抗细菌菌种, 接入内盛50 mL 种子培养基(淀粉3 g/L,蛋白胨12 g/L,无水氯化钙3 g/L, pH 8.0)的250 mL 三角瓶中, 28 ℃,160 r/min 培养24 h.指示菌的培养:取2~3 环活化的菌种, 接入内盛100 mL 种子培养基(牛肉膏5 g/L,蛋白胨10 g/L, 葡萄糖10 g/L,氯化钠5 g/L, pH 7.2)的250 mL 三角瓶中,28 ℃,160 r/min 培养24 h,备用.
1.4.3 拮抗菌的发酵培养 取4 mL拮抗菌种子液,移入内盛50 mL发酵培养基的250 mL三角瓶中(接种量为8%,体积分数),置于摇床上,28 ℃,160 r/min 培养36 h.
1.5抑菌活性的测定方法待灭完菌的的牛肉膏蛋白胨琼脂培养基冷却至40~50 ℃时倒平板,冷却至凝固,用移液枪取200 μL指示菌菌悬液于平板上,用涂布棒涂匀.然后用内径为8 mm 的打孔器在平板上打孔,用移液枪吸取150 μL 拮抗细菌发酵液注入孔内, 于28 ℃恒温箱内培养24 h,用十字交叉法测量抑菌圈大小,抑菌圈直径越大表示抑菌活性越大[17-18].
1.6 抑菌物质的分离与抑菌活性检测
1.6.1 硫酸铵沉淀法 取拮抗细菌抑菌物质的粗提液(即拮抗菌发酵液经3 500 r/min离心去菌体的上清液)1 mL分别进行硫酸铵饱和度为40%、50%、60%、70%、80%的沉淀,4 ℃静止过夜,以硫酸铵饱和度达到80%的空白培养液作为对照.12 000 r/min,4 ℃下离心20 min,分别收集上清和沉淀,并将沉淀溶于pH 8.0, 0.2 mol/L磷酸缓冲液中[19].按照1.5的方法分别测定上清和沉淀的抑菌活性大小.
1.6.2 低温乙醇沉淀法 无水乙醇置于冰箱内进行预冷处理.在抑菌物质上清液中缓慢加入乙醇使其在溶液中的终浓度分别达到40%,50%,60%,70%,80%,此反应在冰浴中进行.于4 ℃下静置过夜, 以含80%乙醇的空白培养液为对照.12 000 r/min, 4 ℃下离心20 min,分别收集上清和沉淀,将沉淀溶于pH 8.0, 0.2 mol/L磷酸缓冲液中[19].按照1.5的方法分别测定上清和沉淀的抑菌活性大小.
1.7 抑菌物质化学性质分析
1.7.1 茚三酮反应 取拮抗细菌抑菌物质的粗提液1 mL置于试管中,加2滴茚三酮试剂,加热至沸(此反应必须在pH 5~7进行)[16],观察颜色变化,以蒸馏水为对照.
1.7.2 双缩脲反应 取2支试管,分别加拮抗菌抑菌物质的粗提液1 mL和蛋白胨水溶液1 mL,再加入10%氢氧化钠溶液10滴及1%硫酸铜溶液2滴,混匀,观察是否有紫玫瑰色出现[16].以蒸馏水为对照.
1.7.3 莫氏实验 取5支试管,分别加1 mL 1%葡萄糖溶液,1%淀粉溶液,少许纤维素(棉花浸在1 mL水中),抑菌物质的粗提液,无水乙醇沉淀物,然后分别加入莫氏试剂2滴,摇匀,将试管倾斜,沿管壁慢慢加入浓硫酸1.5 mL,硫酸层沉于试管底部与糖液分成两层,观察液面交界处有无紫红色环出现[16][注意:莫氏试剂应直接滴入试液中,勿使试剂接触试管壁,否则试剂会与硫酸接触生成绿色而掩盖紫色环].
1.7.4 糖的还原反应 于3支试管中加入菲林试剂A和B各1 mL,混匀,分别加入抑菌物质的粗提液,1%葡萄糖溶液,1%淀粉溶液1 mL,置沸水浴中加热数分钟,取出,冷却,观察各管的颜色变化[16].
2 结果与分析
2.1抑菌活性的测定采用1.5的抑菌活性测定方法,对5种指示菌的抑菌效果测定如表1.由表中数据可知,该拮抗细菌对革兰氏阳性菌和革兰氏阴性菌都具有抑菌作用,说明这株菌具有广谱抗菌性.图1~5分别显示的是该拮抗细菌对大肠杆菌、炭疽杆菌、地衣芽孢杆菌、苏云金芽孢杆菌和枯草芽孢杆菌的抑菌效果.此外,由表1还可知,该拮抗细菌对大肠杆菌抑菌作用最强,因此,以下的实验均以大肠杆菌作为指示菌.

表1 抑菌活性测定结果

图1 拮抗细菌对大肠杆菌抑菌效果
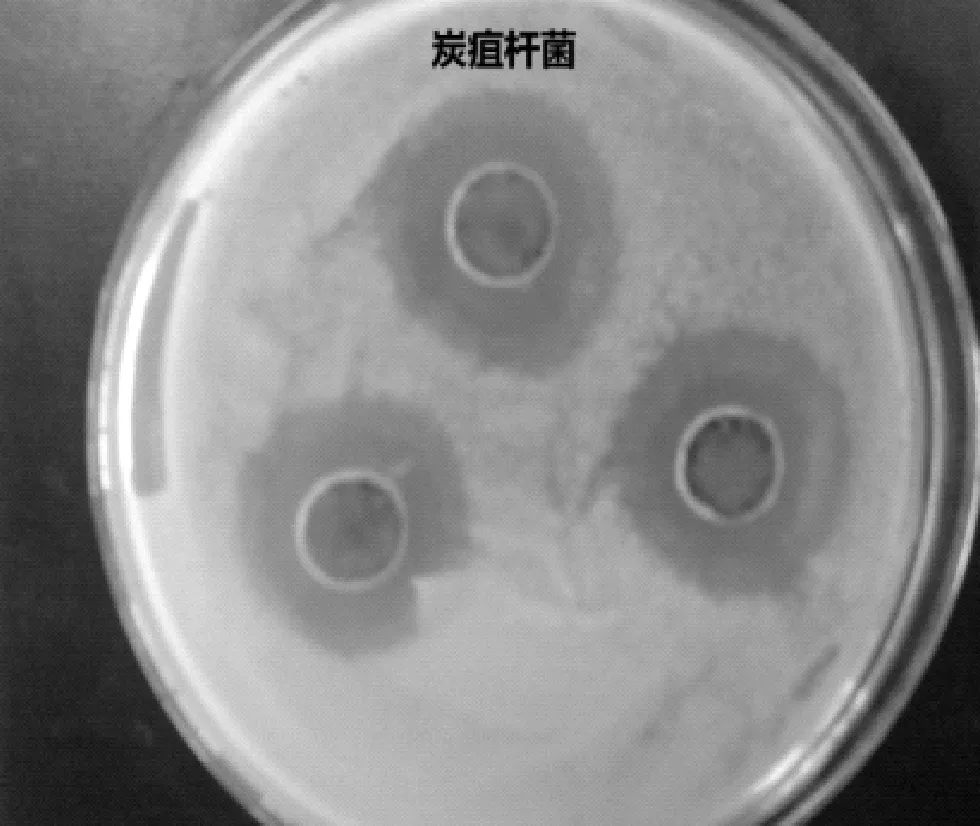
图2 拮抗细菌对炭疽杆菌抑菌效果

图3 拮抗细菌对地衣芽孢杆菌抑菌效果

图4 拮抗细菌对苏云金芽孢杆菌抑菌效果

图5 拮抗细菌对枯草芽孢杆菌抑菌效果
2.2 抑菌物质的初步分离
2.2.1 硫酸铵沉淀法 拮抗细菌经不同浓度硫酸铵沉淀后,发现硫酸铵质量分数在70%时离心后沉淀物抑菌圈最大即抑菌活性最大(如表2、图6),进而可以初步推断该拮抗物质是一种蛋白质类物质.此外,实验过程中发现硫酸铵质量分数为40%、50%、60%、70%、80%离心后的上清液均没有抑菌圈,但离心后的沉淀均有抑菌圈,且根据抑菌圈大小,建议以70%为最适沉淀浓度.
2.2.2 低温乙醇沉淀 利用不同浓度的乙醇处理抑菌物质的粗提液,结果显示不同乙醇浓度处理后的离心上清液都有明显的抑菌圈(表3、图7),而离心后的沉淀物都没有抑菌圈,表明其没有抑菌活性,同时实验说明低温乙醇沉淀法不适于提取这种抑菌物质.
表2硫酸铵沉淀物与上清液的抑菌结果

硫酸铵浓度抑菌圈直径/cm平均值/cm40%1.351.351.171.2950%1.451.271.471.3960%1.451.431.421.4370%1.451.571.351.4680%1.401.421.451.42硫酸铵沉淀离心后的上清液 ----除菌体后的发酵液1.351.351.401.36
表3不同浓度乙醇沉淀后上清液抑菌结果

乙醇浓度抑菌圈直径/cm平均值/cm40%1.601.721.701.6750%1.801.901.851.8560%1.921.701.811.8170%1.701.651.601.6580%1.501.551.451.50乙醇处理、离心后的沉淀物----除菌体后的发酵液1.751.851.801.80

图6 不同浓度硫酸铵沉淀物的抑菌活性

图7 乙醇沉淀后离心上清液的抑菌活性
2.3 生理生化反应结果
2.3.1 茚三酮反应 拮抗菌抑菌物质的粗提液茚三酮反应成阳性即有蓝紫色出现(图8),表明粗提液里含有游离α-氨基的蛋白质类物质.
2.3.2 双缩脲反应 拮抗菌抑菌物质的粗提液的双缩脲反应为阳性,溶液出现紫玫瑰色(图9).这表明拮抗菌抑菌物质的粗提液中含有蛋白质或多肽.结合上述茚三酮反应可推断抑菌物质的粗提液中不含环肽类蛋白质.

图8 茚三酮反应左边是粗提液,右边是蒸馏水.

图9 双缩脲反应结果从左到右依次是抑菌物质的粗提液、蛋白胨水溶液、蒸馏水.
2.3.3 莫氏实验 拮抗菌抑菌物质的粗提液、低温乙醇离心后的沉淀物与莫氏试剂反应成阳性,浓硫酸与溶液的交界处有紫红色环出现(图10).表明抑菌物质的粗提液和沉淀物中含有糖类物质.
2.3.4 糖的还原反应 拮抗菌抑菌物质的粗提液与菲林试剂反应成阴性,无砖红色沉淀生成(图11).说明拮抗菌抑菌物质的粗提液中不含单糖,可能含有多糖.

图10 莫氏实验结果从左到右依次是1%葡萄糖溶液、1%淀粉溶液、脱脂棉、抑菌物质的粗提液、低温乙醇离心后的沉淀物.

图11 糖的还原反应结果从左到右依次是抑菌物质的粗提液、1%葡萄糖溶液、1%淀粉溶液.
3 讨论
通过用抑菌圈法研究这株拮抗细菌抑菌物质粗提液对温度的稳定性、pH稳定性、紫外线的稳定性,为进一步提高拮抗细菌拮抗性能提供一定参考数据,同时也为拮抗细菌更好地应用提供必要的理论依据.通过对抑菌物质粗提液进行低温乙醇沉淀、硫酸铵沉淀和化学性质的研究,发现采用硫酸铵沉淀法得到的沉淀物有抑菌活性,可以初步判定这种物质是蛋白质类物质,而采用低温乙醇沉淀法所得的沉淀物含有多糖类物质,但这种沉淀物并没有抑菌活性,所以可以初步推断这株拮抗细菌所产的抑菌活性成分不是多糖类物质,综合颜色反应试验结果,初步判定拮抗物质很可能是一种糖蛋白类物质.
由于该拮抗细菌所产抑菌物质具有很好的广谱性,因此该研究也为更好地利用拮抗细菌进行生防研究提供一定的理论参考价值.
致谢:感谢河南省科技厅对本项目的资助和支持.
[1] 王岳,方金瑞.抗生素[M].北京:科学出版社,1988:8-10.
[2] Zimmerman S B,Schwartz C D,Richard L,et a1.Difficidin and oxydificidin:novel broad spectrum[J].J Antibiotics,1987,40(12):1677-1681.
[3] Peypoux F,Pommier M T,Ptak M,et a1.Revised structure of mycosubtilin,a peptidiolipid antibiotic fromBacillussubtilis.Antibiotics,1986,39(5):636-641.
[4] Tagg J R.Bacteriocins of gram-positive bacteria[J].Bacteriol Rev,1976,40(3):722-756.
[5] Michael A,Torsch V,Bryce C.Bacteriocin fromBacillusmegateriumATCC 19213:comparative studies with megacin A-216[J].Bacteriol,1983,155(2):866-871.
[6] Abo-El-Dohab M K.Antagonism among strains ofPselutomonassolanacearum[J].Phytopathol,1969,59(7):1005-1007.
[7] Cupples D,Sen J.Isolation and characterization of a bacterocin produced byPseudomonassolanacearum[J].Journal of General Micrology,1978,109(2):293-303.
[8] Eehandi E.Production propertia and morphology of bacteriocin fromErwiniachrysanthemi[J].Phytopathol,1979,69(10):1204-1207.
[9] 王金生.细菌素在植物细菌病害生防中的应用[J].生物防治通报,1985,1(2):36-48.
[10] 任欣正,章健.青枯假单胞菌细菌素的研究[J].南京农业大学学报,1993,16(30):63-67.
[11] Ellis J G,Kerr A.Agrobacterium:genetic studies on agracin 84 production and biological control of crown gall[J].Physiol Plant Pathol, 1979,15:311-319.
[12] Fravel D R.Role of antibiosis in the bio-control of plant diseases[J].Annu Rev Phytopathol,1988, 26(1):75-91.
[13] Fulton R W.Practices and precautions in the use of cross-protection for plant virus disease control[J].Annu Rev Phyto-pathol, 24(1):67-81.
[14] 崔云龙,刘训理.枯草芽孢杆菌B-912菌株对数种病原菌的抗生作用[J].生物防治通报,1993,9(1):29-32.
[15] 赵白鸽.枯草芽孢杆菌的抑菌作用及其防治棉苗病害的研究[J].植物保护,1993,19(3):17-18.
[16] 陈钧辉,张太平,张冬梅,等.生物化学实验[M].4版.北京:科学出版社,2008:65-70.
[17] 何红,沈兆昌,邱思鑫,等.内生拮抗枯草芽孢杆菌BS-2菌株的发酵条件[J].中国生物防治,2004,20(1):38-41.
[18] 任争光,张志勇,李丹,等.芽孢杆菌BJ-6产拮抗物质发酵条件初探[J].中国农学通报,2007,23(5):321-325.
[19] 郝晓娟,刘波, 谢关林, 等.短短芽孢杆菌JK-2菌株抑菌物质特性的研究[J].浙江大学学报:农业与生命科学版,2007,33(5):484-489.
