阿折地平固体分散体的制备及溶出度的考察
2012-11-22王成港王杏林
王 悦 刘 欢 王成港 王杏林
1.天津中医药大学,天津 300193;2.天津药物研究院 释药技术与药代动力学国家重点实验室,天津 300193
阿折地平固体分散体的制备及溶出度的考察
王 悦1刘 欢2王成港2王杏林2
1.天津中医药大学,天津 300193;2.天津药物研究院 释药技术与药代动力学国家重点实验室,天津 300193
目的 利用固体分散技术制备阿折地平固体分散体,并检测其体外溶出度。 方法 分别以聚乙二醇4000、聚乙二醇6000、泊洛沙姆188等为载体,用熔融法、溶剂法制备不同比例的阿折地平固体分散体。通过X射线粉末衍射法分析药物在固体分散体中的存在状态。采用紫外分光光度法测定阿折地平固体分散体的溶出度,根据测定结果筛选出两种方法制备的固体分散体进行压片,并比较阿折地平固体分散片的体外溶出特性。 结果 各种方法制备的阿折地平固体分散体均能加快药物溶出,且载体比例愈大,药物溶出越快。最优制备方法为以泊洛沙姆188为载体、药物与载体比例为1∶6,采用熔融法制备。 结论 采用固体分散技术可有效增加阿折地平的体外溶出度。
阿折地平;固体分散体;溶出度
阿折地平(Azelnidipine,AZ)为抗高血压的新药,属于二氢吡啶类钙通道阻滞剂[1]。与其他同类药物相比,AZ的降压作用缓慢且持久,少有反射性心率加快。因此在临床上是一个很有优势的长效抗高血压药物[2]。而AZ属于水难溶性药物,服药后药物很难在体液中溶解而被机体充分吸收,导致在体内的生物利用度较低。为了解决上述问题,本文采用固体分散技术改变其存在状态,提高其溶解性能,改善其生物利用度,这对于提高药物临床疗效、降低毒副作用具有重大的意义。本实验以溶出度为主要的质量评价指标,对AZ固体分散体的载体、载体与药物比例及制备工艺等进行考察,从而筛选出最佳制备方法。
1 仪器与试药
1.1 仪器
Lambda 12紫外分光光度计(日本岛津),YB-Z真空恒温干燥箱(天津药典标准仪器厂),RE52CS旋转蒸发器(上海亚荣生化仪器厂),D/max-2500 X射线粉末衍射仪(日本理学),ZRS-8G智能溶出试验仪(天津大学无线电厂)。
1.2 试药
AZ原料(天津药物研究院合成室,批号:20110201)、聚乙二醇4000(天津大学科威公司,PEG 4000)、聚乙二醇6000(天津大学科威公司,PEG 6000)、泊洛沙姆 188(德国 BASF,Poloxamer 188)、PVP K30(天津大学科威公司)、PVP K90(天津大学科威公司)。
2 方法与结果
2.1 AZ固体分散体的制备
分别以 PEG 4000、PEG 6000、Poloxamer 188、PVP K30、PVP K90为载体,采用不同的固体分散体成型技术制备药物与载体质量比分别为 1∶1、1∶3、1∶6、1∶9 的固体分散体,并对其进行溶出度的研究和比较[3]。
2.1.1 熔融法
称取处方量的药物与载体,先将载体于130℃水浴加热(alpha晶型 AZ 熔点:121~123°C),待完全熔融后加入药物搅拌至完全熔融,倒入预冷的蒸发皿中,置冰浴中剧烈搅拌至完全固化。固化物放置-10℃1 h后取出,25℃真空干燥12 h,待脆化取出粉碎后过80目筛,置干燥器避光保存[4-5]。
2.1.2 溶剂法
称取处方量的药物与载体加入无水乙醇溶解,搅拌至药物和载体均溶解于乙醇而形成澄明溶液,50℃条件下蒸发乙醇至黏稠状态,在25℃真空干燥箱中彻底除去溶剂,研细过80目筛,置干燥器避光保存[6]。
2.2 AZ物理混合物的制备
按固体分散体中药物与载体的比例分别称取药物与载体,研磨混匀,过80目筛即得。
2.3体外溶出度试验
溶出度的测定方法参照 《中国药典》2010年版附录XC第二法操作。精密称取固体分散体适量,参照上述药典中的溶出度桨法进行测定,以500 mL pH 1.0盐酸介质为溶出介质,75 r/min,介质温度(37.0±1.0)℃,依法操作。 在 5、10、15、20、30、45、60 min分别取溶液5 mL,同时补充5 mL溶出介质,分别精密量取滤液1 mL置10 mL量瓶中,用溶出介质稀释到刻度摇匀,作为供试品溶液。在270 nm的波长处[7]分别测定吸光度值,绘制溶出曲线。
2.4 制备方法的优化
2.4.1 熔融法中处方的筛选
2.4.1.1 载体种类的筛选 分别以PEG 4000、PEG 6000、Poloxamer 188为载体,采用熔融法,制备同一质量比(1∶6)的AZ固体分散体。溶出度曲线见图1。结果用熔融法制备的固体分散体溶出速率大小顺序为:Poloxamer 188固体分散体>PEG 6000固体分散体>PEG 4000固体分散体,其中Poloxamer 188增溶效果最好。

图1 溶融法中不同载体AZ溶出曲线图
2.4.1.2 载体比例的筛选 药物与载体的比例对药物从固体分散体中的溶出速率有很大影响,为此,本文设计并制备了AZ∶Poloxamer 188 从 1∶1 到 1∶9 的不同比例搭配的固体分散体,并对其溶出度曲线图进行了研究和比较。具体试验方法为准备四组试验,每组AZ均为1 g,各组配比为A组:AZ∶PVP为 1∶1;B 组:AZ∶PVP 为 1∶3;C 组:AZ∶PVP 为 1∶6;D 组:AZ∶PVP为1∶9。上述各组均按熔融法制备工艺操作,溶出度曲线见图2。结果Poloxamer 188比例越高,药物溶出越快,特别是药物与载体比例从1∶1变至1∶6时,随着Poloxamer 188的含量变大,溶出度提高尤为明显;但AZ∶Poloxamer 188从1∶6变到1∶9时,溶出度并无明显提高。所以选择AZ∶Poloxamer 188为1∶6作为最佳载体比例。
2.4.2 溶剂法中处方筛选

图2 熔融法中不同药物比例的AZ溶出曲线图
2.4.2.1 载体种类的筛选 分别以PVP K30,PVP K90为载体,采用溶剂法,制备同一质量比(1∶6)的AZ固体分散体。固体分散体与AZ原料药溶出曲线见图3。结果采用溶剂法制备的固体分散体溶出速率大小顺序为PVP K30固体分散体>PVP K90固体分散体。
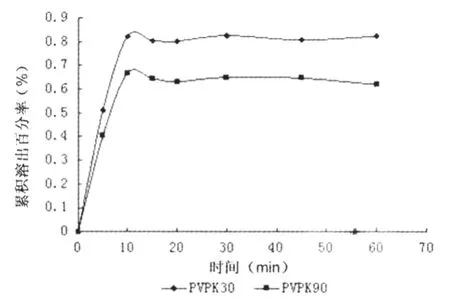
图3 熔剂法中不同载体AZ溶出曲线图
2.4.2.2 载体比例的筛选 本文设计了 AZ∶PVP K30 为 1∶1、1∶3、1∶6和1∶9的不同固体分散体,并对其溶解度进行了研究和比较。具体试验方法为准备四组试验,每组AZ均为1 g,各组配比为 A 组:AZ∶PVP K30 为 1∶1;B 组:AZ∶PVP K30 为 1∶3;C组:AZ∶PVP K30 为 1∶6;D 组:AZ∶PVP K30 为 1∶9。 上述各组均按溶剂法制备工艺操作,溶出度曲线见图4。结果PVP比例越高,药物溶出速度越大,特别是载体与药物比例从1∶1变至1∶6时,随着载体的含量的增加,溶出度提高尤为明显。

图4 溶剂法中不同药物比例的AZ溶出曲线图
2.4.3 AZ固体分散体片剂制备
经过对以上辅料的考察,发现辅料PVP K30和辅料Poloxamer 188得到固体分散体的溶出度都有所提高,但是通过对溶出曲线的观察,PVP K30作为载体,溶出度在上升到最大值时会出现轻微下降,因此对以上两种固体分散体进行进一步研究。利用直接压片法进行片剂制备,以微晶纤维素、预胶化淀粉、羧甲基淀粉钠、滑石粉、硬脂酸镁为辅料,制备规格为120 mg的AZ片,每片的含药量为8 mg。将两种AZ固体分散片各取6片进行溶出度的测定并绘制溶出曲线。见图5、6。结果以PVP K30作为载体的固体分散体60 min内的溶出度从82.0%降至62.3%,溶出度明显降低。而Poloxamer 188作为载体的固体分散体的溶出度从84.1%降至80.2%,但依然保持较高的溶出度。
2.5 X射线粉末衍射实验
分别取 AZ、Poloxamer 188、AZ与 Poloxamer 188物理混合物(质量比 1∶6)、AZ 与 Poloxamer 188 固体分散体(质量比1∶6)适量,进行X-射线粉末衍射分析。工作条件为铜靶;管

图5 PVP K30为载体的溶出曲线

图6 Poloxamer 188为载体的溶出曲线

图7 AZ X-ray衍射图

图8 Poloxamer 188X-ray衍射图
由图 7~10 可以看出,AZ 在 4.70°、10.88°、13.48°、16.70°有特征衍射峰。Poloxamer 188在19.20°、23.40°有特征衍射峰。AZ 与Poloxamer 188 的物理混合物在 4.70°、19.18°、23.34°有明显衍射峰。其物理混合物除显示AZ的衍射峰外,还显示Poloxamer 188的衍射峰。而固体分散体在19.08°、23.34°有明显衍射峰,未见AZ的衍射峰,只有Poloxamer 188的衍射峰,且峰强度较物理混合物中Poloxamer 188小,AZ的衍射峰消失表明AZ以无定形态分散于Poloxamer 188固体分散体中。

图9 AZ、Poloxamer 188物理混合物X-ray图
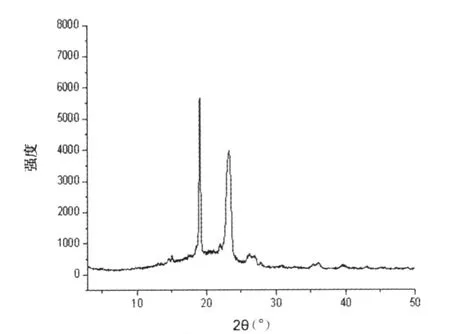
图10 AZ、Poloxamer 188固体分散体X-ray图
3 讨论
本实验通过对不同载体、不同制备方法的固体分散体溶出度结果的比较,分别选择PVP K30、Poloxamer 188为载体进行AZ固体分散片的制备并对溶出度结果进行比较,发现在常温下,PVP容易吸潮,使分散物呈胶状存在,不易压片。而以Poloxamer 188为载体的固体分散体始终保持疏松的固体状态,易于粉碎,压片。且AZ-PVP固体分散片的溶出度比AZ-Poloxamer 188固体分散片的溶出度显著降低。故最终选取以Poloxamer 188为载体,熔融法制备AZ固体分散体,药物∶Poloxamer 188 比例为 1∶6。
[1]肖艳萍,孙忠实.钙通道阻滞剂的临床应用评价[J].中国医院用药评价与分析杂志,2003,3(1):11-14.
[2]Yuji N,Makoto S,Hikori M,et al.Azelnidipine,a new calcium channel blocker,inhibits endothdial inflammatory response by reducing intracellular levels of reactive oxygen species[J].European Journal of Pharmacology,2006,546:11.
[3]朱盛山.药物新剂型[M].北京:化学工业出版社,2003:26-28.
[4]王展,韩立炜,任天池.葛根素-聚乙二醇6000固体分散体的制备及其溶解性能的研究[J].北京中医药大学学报,2009,30(5):346-349.
[5]侯永利,杨建彬.卡维地洛固体分散体的初步研制[J].中国药房,2007,18(16):1239-1240.
[6]杜光玲,赵燕燕,韩媛媛.洛伐他汀固体分散体的制备及体外溶出特性比较[J].中国医院药学杂志,2008,28(12):970-972.
[7]黄阿农.阿折地平片溶出测定方法研究[J].现代中西医结合杂志,2009,18(15):1756-1757.
Investigation on preparation and dissolution of Azelnidipine Solid Dispersions
WANG Yue1LIU Huan2WANG Chenggang2WANG Xinglin2
1.Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Tianjin Institute of Pharmaceutical Research Tianjin State Key Laboratory of Drug Delivery Technology and Pharmacokinetics,Tianjin 300193,China
ObjectiveTo prepare Azelnidipine Solid Dispersions by the technology of solid dispersion and determine the dissolution of Azelnidipine.MethodsAzelnidipine Solid Dispersions were prepared with different proportion by melting method and solvent method which used PEG 4000,PEG 6000,Poloxamer 188 as carriers.The distribution condition by using X-ray diffraction was analyzed.The dissolution of the solid dispersions was detected by UV spectrophotometry,solid dispersions were to be pieces according to the measuring results of the two methods,and the characteristics of dissolution of solid dispersions in vitro were compared.ResultsThe dissolution was significantly improved by Azelnidipine Solid Disper sions with every method in vitro,and the higher carrier of Azelnidipine ratio,the faster drug dissoluted.Using the Poloxamer 188 as the carrier,the ratio of Azelnidipine and carrier of 1∶6,and utilizing fusion method was the best preparation method.ConclusionAzelnidipine Solid Dispersions technology can significantly increase the dissolution of Azelnidipine in vitro.
Azelnidipine;Solid dispersions;Dissolution
R971.9
A
1673-7210(2012)08(c)-0118-03
王悦(1985.9-),女,天津人,硕士研究生,从事药物制剂研究工作。
王成港,硕士研究生,副研究员,从事药物制剂研究工作。
2012-04-17 本文编辑:卫 轲)
