基质金属蛋白酶1及其抑制剂在舌癌浸润性转移中的作用
2012-11-22李静平张翠香
张 鹏 纪 亮 沈 雷 李静平 王 岩 张翠香 沙 峰
齐齐哈尔医学院解剖教研室,黑龙江齐齐哈尔 161006
基质金属蛋白酶1及其抑制剂在舌癌浸润性转移中的作用
张 鹏 纪 亮 沈 雷 李静平 王 岩 张翠香 沙 峰
齐齐哈尔医学院解剖教研室,黑龙江齐齐哈尔 161006
目的 检测舌癌黏膜固有层组织中基质金属蛋白酶-1(MMP-1)、基质金属蛋白酶抑制剂-1(TIMP-1)的表达,揭示它们在舌癌浸润和转移中的作用。方法应用ABC免疫组织化学染色方法分别检测舌癌标本及正常组织各取材部位中MMP-1、TIMP-1的免疫学定位及表达情况。结果 舌癌组织的MMP-1和TIMP-1的阳性表达率与对照组相比,差异有高度统计学意义(P<0.01);舌癌组织中的MMP-1和TIMP-1的表达与舌癌大小无关(P>0.05),而与舌癌分化程度、有无转移、病理分级等具有差异(P<0.05或P<0.01)。 结论 MMP-1和TIMP-1在舌癌黏膜固有层组织中的表达关系,有助于判断舌癌的侵袭和转移及病理分期。
基质金属蛋白酶-1;基质金属蛋白酶抑制剂-1;舌癌
基质金属蛋白-1(matrix metalloproteinases,MMP-1)属于胶原酶,可降解细胞外基质(extracellular matrix,ECM)中的胶原纤维成分。基质金属蛋白酶抑制剂-1(Tissue Inhibitor of Metalloproteinases,TIMP-1)对 MMP-1活性有抑制作用,二者之间的平衡可维持ECM中胶原纤维合成和分解的稳定,并与肿瘤的发生、浸润和转移密切相关[1]。肿瘤的浸袭和转移机制研究已经成为热点,目前,对于舌癌如何突破ECM造成浸润转移尚无定论。本实验对舌癌的MMP-1、TIMP-1的表达及关系进行研究,以解决舌癌浸润转移的机制。
1 材料与方法
1.1 材料
实验组选择本课题组2006~2008年使用二甲基苯并蒽(DMBA)涂抹金黄地鼠舌体建立的舌癌模型存档标本,其中涂抹 4、8、12、16、20、24 周各为一组,每组 5例,共计 30例;将上述标本切片行HE染色,在显微镜下观察。确定原位癌11例,进展期舌癌19例(包括浸润癌13例,转移癌6例);有淋巴结转移者17例,无淋巴结转移者13例。每例均按癌巢大小取取癌中组织(肿瘤中心区)、癌周组织(肿瘤边缘区);对照组取上述组织块中的正常组织各1块,共计30例。
1.2 试剂
兔抗人MMP-1、TIMP-1多克隆抗体购自武汉博士德生物工程有限公司;SP超敏试剂盒购自福州迈新生物技术开发有限公司;DAB试剂盒购自北京中杉金桥生物技术有限公司。
1.3 实验方法
HE染色法,光镜下观察切片,确定组织的病理分级:原位癌、浸润癌、转移癌。应用ABC免疫组织化学染色方法分别检测舌癌标本各取材部位中MMP-1、TIMP-1的定位及表达情况。
1.4 结果判断
MMP-1、TIMP-1均采用半定量积分法:以胞质内出现黄色颗粒状物质为阳性,根据肿瘤细胞胞浆染色的程度及染色细胞百分率进行评分:基本不着色者为0分;着色淡黄色为1分;棕色为2分;深棕色为3分。着色细胞占计数细胞百分率:≤5%为 0分;6%~25%为 1分;26%~50%为 2分;≥51%为3分。将每张切片着色程度得分与着色细胞百分率得分相乘,为 MMP-1、TIMP-1 表达强度积分。≤1 分为阴性(-);2~3分为弱阳性(+);4~5 分为中等阳性(++);≥6 分以上为强阳性(+++)。免疫组化ABC法进行结果判断,用已知阳性切片作阳性对照,以PBS代替一抗作空白对照,以正常血清代替一抗作阴性对照。
1.5 图像分析
采用image-pro plus全自动图像分析系统,观察、检测以上2种染色切片,在200倍放大下随机选取5个测定域,分别测定MMP-1和TIMMP-1表达的数密度(目标数/统计场面积)[2]。
1.6 统计学方法
所得数据采用SPSS 13.0软件进行统计分析,计量资料数据以均数±标准差(±s)表示,等级资料采用秩和检验。计量资料比较采用t检验,计数资料比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 MMP-1和TIMP-1蛋白在舌癌黏膜固有层中的表达
MMP-1在舌癌黏膜固有层的阳性表达率为90.0%(27/30),其中(+++)表达为 43.3%(13/30),(++)表达为 26.67%(8/30),(+)表达为20.0%(6/30),其阳性表达主要位于细胞浆内。TIMP-1在舌癌黏膜固有层的阳性表达率为86.7%(26/30),其中(+++)表达为 33.3%(10/30),(++)表达为 26.7%(8/30),(+)表达为26.67%(8/30),其阳性表达主要位于细胞浆内。MMP-1和TIMMP-1蛋白在实验组中的表达与对照组(阳性率分别为10.0%和13.33%)相比,差异有高度统计学意义(P<0.01)。在癌中、癌周组织中MMP-1和TIMP-1蛋白的表达比较,差异均有高度统计学意义(均P<0.01)),见表1。
表1 舌癌黏膜固有层各部位中MMP-1、TIMP-1的强度积分表达(±s,分)(n=30)
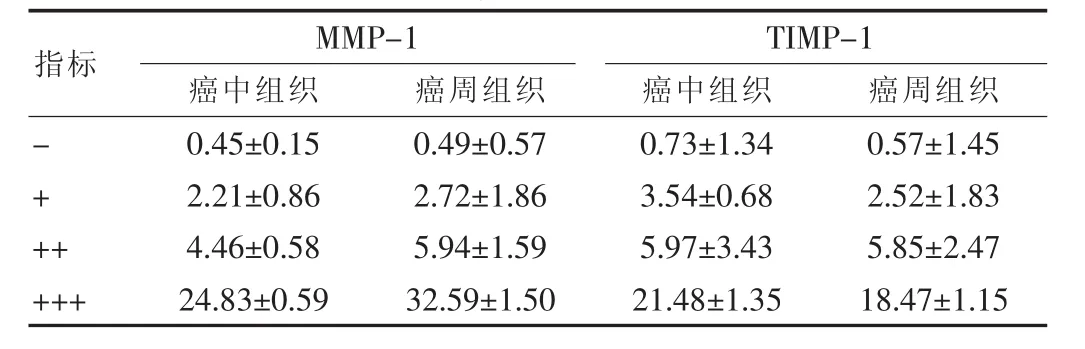
表1 舌癌黏膜固有层各部位中MMP-1、TIMP-1的强度积分表达(±s,分)(n=30)
指标 MMP-1癌中组织 癌周组织TIMP-1癌中组织 癌周组织-++++++0.45±0.15 2.21±0.86 4.46±0.58 24.83±0.59 0.49±0.57 2.72±1.86 5.94±1.59 32.59±1.50 0.73±1.34 3.54±0.68 5.97±3.43 21.48±1.35 0.57±1.45 2.52±1.83 5.85±2.47 18.47±1.15
2.2 MMP-1和TIMMP-1蛋白表达的关系
随着周龄的增加,舌癌标本组织中的MMP-1和TIMP-1的表达均增强,二者与舌癌大小无关(P>0.05),而与舌癌分化程度、有无转移等差异有高度统计学意义 (P<0.05或P<0.01),见表2。
3 讨论
在生理情况下,细胞外基质(ECM)在维持正常组织结构与功能及细胞生长、分化过程中起到非常重要的作用。大量研究表明,它不再被认为是静止不动的,而是处在不断代谢更新、降解重塑的动态平衡中。近来在研究有关ECM合成和降解的代谢平衡调节中,引人注目的是MMPs和TIMPs两个酶系统的作用。ECM的主要成分由胶原纤维和弹性纤维构成,MMP-1在这一过程中起着分解胶原纤维的作用。TIMP-1除了是MMP-1的天然抑制剂外,还对所有类型MMPs均有抑制作用。在生理情况下,它可参与细胞外基质的改建及影响细胞生长[3]。本实验对照组的MMP-1、TIMMP-1含量差异无统计学意义(P>0.05),亦证明了二者同时存在于细胞的生理情况下,可参与细胞外基质的改建及影响细胞生长。
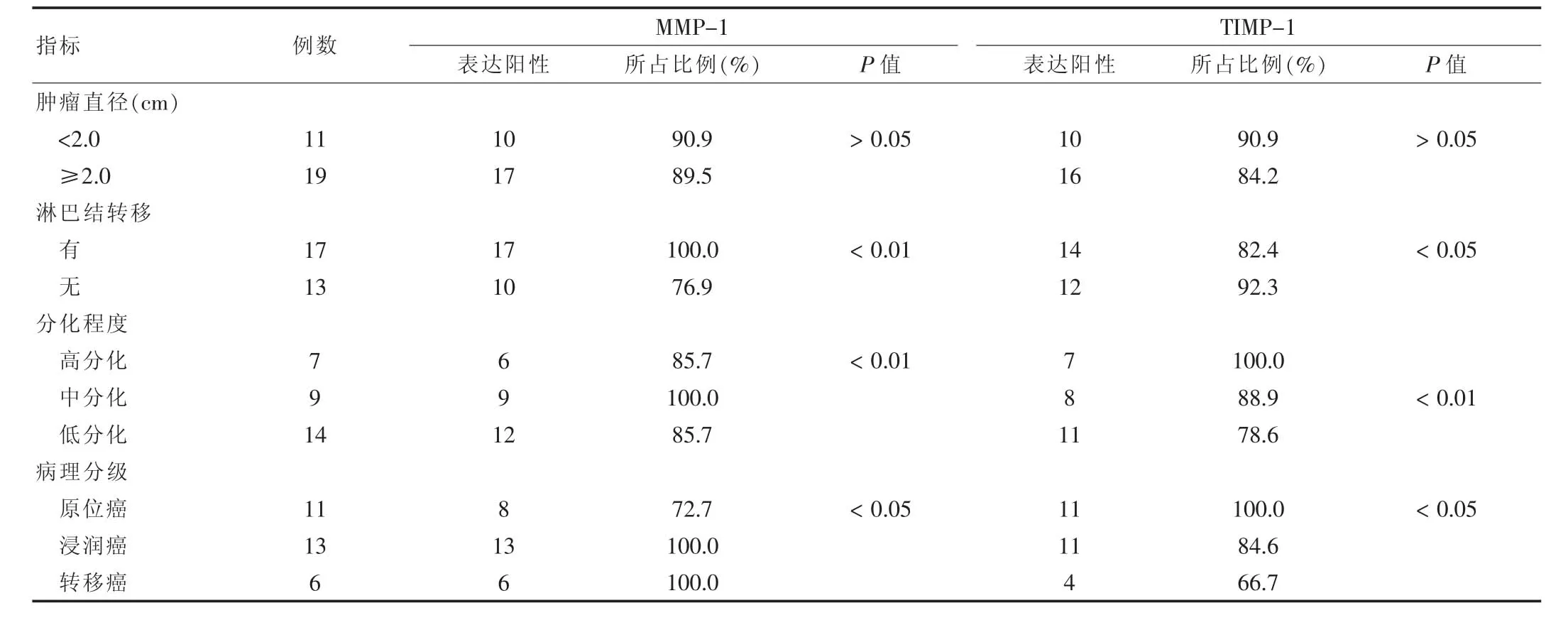
表2 舌癌黏膜固有层病理特征与MMP-1、TIMMP-1蛋白表达的关系
MMPs和TIMPs与肿瘤的发生、发展密切相关:大部分肿瘤中均可检测到MMPs和TIMPs的表达异常。有研究表明,在头颈部鳞癌中,肿瘤细胞可通过分泌MMPs降解细胞外基质,促进肿瘤的侵袭转移并影响患者的转归和预后[4]。本研究从表1中可发现MMP-1随着舌癌的进展,其癌中心区域高表达性愈来愈高(P<0.01),说明舌癌发生转移的趋势越来越高;当 MMP-1 表达为(++)~(+++)时,癌周围区组织的MMP-1表达比癌中心区表达要高,这是由于随着舌癌的进展,癌体积逐渐变大,癌中心区域会产生缺血性改变,中心区细胞缺血,减少分泌MMP-1的同时,还会分泌缺氧诱导因子(HIF-1)等细胞因子,诱导新生血管形成[5],而新生血管的发生必须侵及基底层到达癌体,此时癌周围区域受到缺血、细胞因子等因素刺激会使MMP-1分泌就会迅速升高,以溶解胶原纤维,促使新生血管的形成[6]。MMP-1增多的同时,TIMP-1也会相应增多,这是机体的应答机制,原位杂交也发现MMP的mRNA主要分布在肿瘤边缘的间质细胞中,或同时分布在瘤细胞和间质中[7],造成这种不同分布的机制可能就是由于肿瘤血管生成的需要,也说明MMP-1具有促血管生成的作用。但是从表1来看,虽然MMP-1和TIMP-1皆升高,但是后者的升高的程度较小。这主要是由于MMP家族有激活的级联效应[8],导致20周以后MMP-1表达明显升高。通过表2可以发现MMP-1和TIMP-1的表达与肿瘤大小无关(P>0.05),但与肿瘤的淋巴结转移、分化程度等具有密切联系 (P<0.01),这是由于MMP-1参与破坏基底层的胶原纤维,以利于舌癌的转移,这与低分化细胞分泌高表达的MMP-1观点相一致[9]。Gunduz等[10]通过研究口腔纤维化,发现TIMP-1在纤维化的病损比正常高,可能MMP-1会使细胞外基质的合成和堆积增加,高表达的TIMP-1对MMP-1的抑制作用,从而破坏MMPs与TIMP的动态平衡,TIMP-1在口腔黏膜下纤维化的成纤维细胞中表达,随着口腔黏膜纤维化的严重程度加大而增加,因此TIMP-1可能与口腔黏膜纤维化的病理过程有关[11]。MMP-1和TIMP-1在舌癌的发生、发展过程中所起的作用不仅是通过降解细胞外基质和基底膜,促进肿瘤侵袭转移的,而且还可以促进肿瘤组织中新生血管的形成,增强了肿瘤侵袭能力和转移能力,抑制MMP-1具有抑制肿瘤侵袭转移和血管生成的双重作用。
综上所述,MMP-1和TIMP-1在舌癌黏膜固有层组织中的表达与舌癌进展密切相关,与舌癌分化程度、有无转移、病理分级等关系密切,可作为判断舌癌的侵袭和转移及病理分期的参考。可以预见,基质金属蛋白酶及其抑制剂在抗肿瘤转移的治疗中,将具有良好的应用前景。
[1]Polette M,Nawrocki-Raby B,Gilles C,et al.Tumour invasion and matrix metalloproteinases[J].Crit Rev Oncol Hematol,2004,49(3):179-186.
[2]吴旋,苏振忠,蒋爱云,等.瘢痕性喉狭窄瘢痕组织中弹性纤维和胶原纤维分析[J].中山大学学报:医学科学版,2005,26(3):312-315.
[3]赵海,于志丹.基质金属蛋白酶抑制剂与胃癌浸润转移的关系[J].实用临床医学,2005,6(2):4-6.
[4]Charoenrat P,Modjtahedi H,Rhys P,et al.Epidermal growth factor like ligands differentially up-regulate matrix metalloproteinase-9 in head and neck squamous carcinoma cells[J].Cancer Res,2000,60(4):11-18.
[5]陈晶,卢娜,郭青龙.肿瘤血管生成机制及抗血管生成药物的研究进展[J].药学服务与研究,2007,7(1):49-52.
[6]Bjorklund M,Koivunen E.Gelatinase-mediated migration and invasion of cancer cells[J].Biochim Biophys Acta,2005,1755 (1):37-69.
[7]张志刚.基质金属蛋白酶及其抑制剂与疾病的关系[J].国外医学:生理、病理科学与临床分册,1997,14(7):351-353.
[8]陈意生.肿瘤分子生物学[M].北京:人民军医出版社,2002:67.
[9]Arai I,Nagano H,Kondo M,et al.Overexp ression of MT3-MMP in hepatocellularcarcinoma correlates with cap sularinvasion [J].Hepatogastroenterology,2007,54 (73):167-171.
[10]GunduzK,DemireliP,InanirI,etal.Expressionofmatrixmetalloproteinases(MMP-2, MMP-3,and MMP-9) and fibronectin in lichen planus[J].J Cutan Pathol,2006,33(8):545-550.
[11]Sutinen M,Kainulainen T,Hurskainen T,et al.Expression of matrix metalloproteinases(MMP-1 and-2) and their inhibitors(TIMP-1,-2 and-3) in oral lichen planus,dysplasia,squamous cell carcinoma and lymph node metastasis[J].British Joumal of Cancer,1998,77 (12):2239-2245.
Effect of MMP-1 and TIMP-1 in tongue cancer with invasion and metastasis
ZHANG Peng JI Liang SHEN LeiLI Jingping WANG Yan ZHANG Cuixiang SHA Feng Department of Anatomy,Qiqihar Medical University,Heilongjiang Province,Qigihar 161006,China
ObjectiveTo detect the expression of matrix metalloproteinase-1 (MMP-1),tissue inhibitor of matrix metalloproteinase-1(TIMP-1)in mucosa lamina propria tissue of tongue cancer,in order to reveal the role of MMP-1 and TIMP-1 in the invasion and metastasis of tongue cancer.MethodsThe immunological localization and expression of MMP-1 and TIMP-1 in tongue cancer specimens and normal tissues were detected by immunohistochemical staining methods(ABC method).ResultsPositive expression rate of MMP-1 and TIMP-1 between tongue cancer tissues and normal tissues was significantly different(P<0.01).The expression of TIMP-1 and MMP-1 in tongue cancer tissues had no relationship with the size of tongue cancer(P>0.05),but it had significantly differences compared with differentiation degree,metastasis and pathological grade of tongue cancer(P<0.05 or P<0.01).ConclusionThe expression of MMP-1 and TIMP-1 in mucosa lamina propria tissue of tongue cancer can contribute to judge the invasion,metastasis and pathological grade of tongue cancer.
Matrix metalloproteinase-1;Tissue inhibitor of matrix metalloproteinase-1;Tongue cancer
R735.3
A
1673-7210(2012)08(c)-0014-03
黑龙江省齐齐哈尔市科学技术计划项目(项目名称:细胞外基质在鼠舌癌侵袭和转移中的实验性研究);黑龙江省教育厅科学技术研究面上项目 (No:12521635); 黑龙江省 自 然 科 学 基 金课 题项 目 (No:D200957);黑龙江省齐齐哈尔市科学技术计划项目(项目名称:Tenascin-C、MMP-1及其抑制因子对人增生性瘢痕作用的分子机制;No:SHFZD9011)。
2011-12-18 本文编辑:谷俊英)
