泽泻汤加味方对高盐饮食高血压大鼠降压作用及机理的实验研究
2012-11-21张万龙张树峰范洪亮沙洁津于海荣刘振岳
张万龙 张树峰 范洪亮 沙洁津 于海荣 刘振岳
(1北京市通州区中西医结合骨伤医院,北京,101100;2承德医学院;3天津中医药大学)
泽泻汤源于《金匮·痰饮咳嗽病脉证并治第十二》“心下有支饮,其人苦冒眩,泽泻汤主之”,为主治水停心下、浊阴上冒所致眩晕症的代表方,后世用此方为主进行高血压病的治疗始见于1984年[1]。现有报道中多为泽泻汤化裁方的临床疗效观察,运用科学实验方法进行降压机理的研究尚无。笔者从盐负荷—肾功能变化后,RAAS负反馈调节异常,内源性哇巴因(EO)代偿性地分泌增多、细胞膜Na+,K+-ATPase活性降低着手,针对自然高盐饮食状态下形成的高血压大鼠,依据“水郁折之”的中医治则,结合原发性高血压(EH)病程中普遍存在着水浊内结、痰湿阻滞、瘀血阻络的研究成果,以《金匮要略》利水制水的泽泻汤为主方,加用活血、祛痰的泽兰、石菖蒲,组成泽泻汤加味方,进行降压效果、机理的实验研究。以期通过调节RAAS的压力—利钠作用,改善肾功能,使EO产生减少,恢复细胞膜Na+,K+-ATPase活性,改善肾水钠代谢及外周阻力,达到长期降压目的。
1 材料与方法
1.1 实验动物 3周龄Wistar大鼠100只,健康雄性,体重(56.3±3.2)g,由中国医学科学院实验动物研究所提供,饲养于温度18~22℃清洁级动物实验室内。
1.2 实验药品和主要试剂 泽泻汤加味方由本课题组提供。处方由泽泻、白术、泽兰、石菖蒲组成。中药饮片(购自承德医药集团责任有限公司,批号0712002)泽泻 21g,白术 9g,泽兰 15g,石菖蒲 15g。上四味,加8倍量水浸泡4h,加热煎煮1h,过滤,药渣再加6倍水,煎煮1h,过滤,两次滤液合并,浓缩制成浓度为0.81g/mL的水煎剂备用。置于-20℃冻室中冰冻保存;复代文(缬沙坦/氢氯噻嗪)片(诺华制药有限公司北京生产基地,批号2044768)实验时研成细粉用蒸馏水配置成所需浓度的溶液。
1.3 主要试剂 血浆血管紧张素Ⅱ放射免疫分析药盒(北京北方生物技术研究所,批号20080320);醛固酮放射免疫分析药盒(北京北方生物技术研究所,批号20070820);大鼠内源性洋地黄素酶联免疫分析试剂盒(USCN LIFE Science&USCN LIFE Science&Technology公司);超微量ATP酶测试盒(南京建成生物工程研究所,批号A0705)。
1.4 主要仪器 BP-6动物无创血压测试仪(成都泰盟科技有限公司);SERIAL RS-232C酶标仪(Thermo公司);ALLEGRA 64R台式高速离心机(美国Beckman公司);GC-1200r放射免疫计数器(科大创新股份有限公司中佳分公司);F33半自动生化分析仪(澳大利亚TRACE公司);JA1003型精密天平(上海天平仪器厂);友声ACS-A型电子体重秤(上海申衡电子有限公司);漩涡混合器GL-88B(江苏海门麒麟医用仪器厂);离心机LD5-2A(北京医用离心机厂);移液器(Giasen公司)。
1.5 实验方法
1.5.1 高血压大鼠模型的建立 根据文献报道[1]及预实验造模结果,选择3周龄雄性Wistar大鼠100只,体重(56.3±3.2)g。按体重随机随机分为正常组10只和造模组90只。正常组给予普通饲料喂养至实验结束;造模组给予含6%NaCl的高盐饲料,第15周末开始测量血压,从第16周开始每周一次进行血压达标(SBP>120mmHg)筛选。模型筛选方法:凡血压已达标大鼠,进行改饲普通饲料一周后的再次血压测量值仍达标的为造模成功。故用于造模的90只Wistar大鼠,全部从3周龄开始高盐饲料喂养16周,统一测量血压,筛选出符合标准的模型。成模数目没有达到设计要求时,全部大鼠继续高盐饲料饲养至第18周,进行第二次筛选,至造模成功数目达设计要求。
1.5.2 饲料配方 由华荣科技有限公司提供。高盐饲料配方6%NaCl,94%基础饲料。普通饲料配方0.5%NaCl,99.5% 基础饲料。
1.5.3 分组方法 待造模组高盐饮食高血压大鼠造模成功筛选50只后,连同保留正常组10只,计60只,分为6组。具体组别为,A组(空白组)。另外50只高盐饮食高血压大鼠根据血压值随机分为B组(模型对照组)、C组(复代文组)、D组(中药高剂量组)、E组(中药中剂量组)、F组(中药低剂量组),每组10只。
1.5.4 给药方法 空白组:灌服等体积蒸馏水;模型对照组:灌服等体积蒸馏水;复代文组:每日用药剂量为缬沙坦14.4mg/kg+氢氯噻嗪2.25mg/kg;泽泻汤加味方高剂量组:每日用药剂量为16.2g/kg;泽泻汤加味方中剂量组:每日用药剂量为10.8g/kg;泽泻汤加味方低剂量组:每日用药剂量为5.4g/kg;各组每日灌胃一次,连续28天。用药治疗期间各组大鼠均饲以普通饲料。
1.5.5 取材 用药治疗后第28天,禁食水12h,10%水合氯醛(0.3mL/100g)腹腔注射麻醉后,腹主动脉取血液8mL。1)取2mL血液放入酶抑制剂抗凝管(EDTA:江苏康健医疗用品有限公司,批号071208)中,摇匀后立即放入4℃冰箱中1~2h,取出后3000r/min离心5min后,取上层血浆350μL,移入印管中(标记P),密封,-20℃冷冻保存待检测AngⅡ。2)取4mL血液放入一次性使用真空采血管(无添加剂:江苏康健医疗用品有限公司,批号080518),3000r/min离心5min,取上层血清150μL移入印管(标记S)密封冷冻保存用以检测ALD;再取血清300μL至印管中(标记O)密封冷冻保存用以检测EO。3)另取2mL血放入肝素抗凝管(肝素钠:江苏康健医疗用品有限公司,批号080518)中标记R,加入4倍生理盐水后,轻摇匀,1500r/min离心5min,弃去上清液,再加入生理盐水,再离心。如此反复3次,留沉淀红细胞。在沉淀红细胞中加入双蒸水2mL,在漩涡器上混匀2min,4℃冰箱中保留15min,取出后再次混匀,密封,冷冻保存待检测红细胞Na+,K+-ATPase活性。
1.6 观察及检测
1.6.1 尿量收集及观察 分别于干预前及干预后第1、4、7、14、28 天给药后禁食、水,将大鼠置于带漏斗的特制鼠笼内,漏斗下方置量杯,用以留尿观察尿量。
1.6.2 血压测量 采用尾动脉测压法。即先把被测大鼠置于(38±1)℃恒温箱内预热5~10min,使尾部血管扩张。用大鼠尾压心率测定仪加压至搏动消失,放气后再次听到搏动声时血压计读数即为收缩压,重复测量3 次,取平均值。首次给药后,第 1、4、7、14、28天各测血压一次,均于给药后测量。
1.6.3 血浆血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)放射免疫分析法。
1.6.4 血清内源性哇巴因(EO) 酶联免疫吸附法。
1.6.5 红细胞膜Na+,K+-ATPase活性 定磷法。
2 实验结果
2.1 对高盐高血压大鼠尿量的影响 给药前,各模型组尿量均较正常组为少(P<0.01)。给药后第1、4、7天,各给药组较模型空白组尿量增加,尿量依次为复代文组>中药高剂量组>中药中剂量组>中药低剂量组(P<0.01或P<0.05)。中药各组尿量第4天达高峰,至第7天开始减少。1周后,中药各组尿量仍较模型空白组为多,但无统计学意义(P>0.05);中药各组与复代文组比较尿量为少(P<0.05或P<0.01),见表1。
表1 泽泻汤加味方对实验性高血压大鼠尿量的影响(±s)
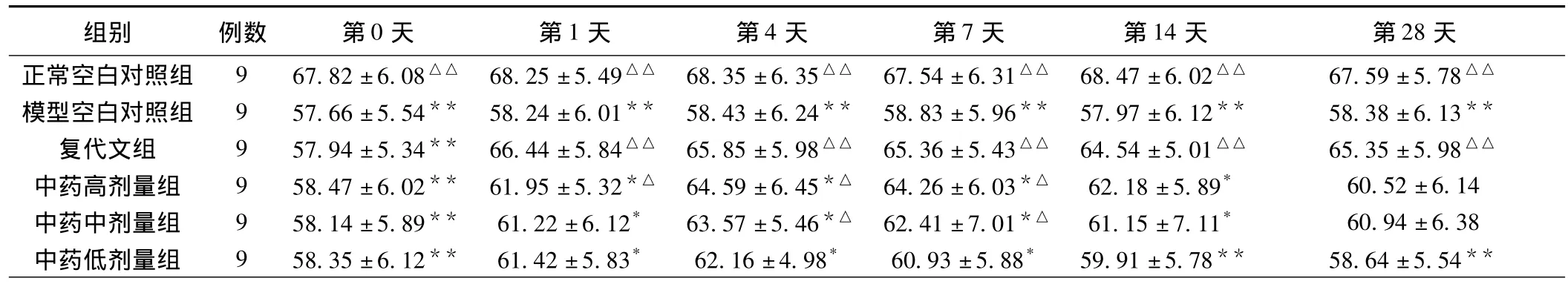
表1 泽泻汤加味方对实验性高血压大鼠尿量的影响(±s)
注:其他各组与空白组比较,*P<0.05,**P<0.01;其他与模型空白对照组比较,△P<0.05,△△P<0.01。
组别 例数 第0天 第1天 第4天 第7天 第14天 第28天正常空白对照组 9 67.82±6.08△△ 68.25±5.49△△ 68.35±6.35△△ 67.54±6.31△△ 68.47±6.02△△ 67.59±5.78△△模型空白对照组 9 57.66±5.54** 58.24±6.01** 58.43±6.24** 58.83±5.96** 57.97±6.12** 58.38±6.13**复代文组 9 57.94±5.34** 66.44±5.84△△ 65.85±5.98△△ 65.36±5.43△△ 64.54±5.01△△ 65.35±5.98△△中药高剂量组 9 58.47±6.02** 61.95±5.32*△ 64.59±6.45*△ 64.26±6.03*△ 62.18±5.89* 60.52±6.14中药中剂量组 9 58.14±5.89** 61.22±6.12* 63.57±5.46*△ 62.41±7.01*△ 61.15±7.11* 60.94±6.38中药低剂量组 9 58.35±6.12** 61.42±5.83* 62.16±4.98* 60.93±5.88* 59.91±5.78** 58.64±5.54**
表2 泽泻汤加味方对实验性高血压大鼠血压的影响(±s)

表2 泽泻汤加味方对实验性高血压大鼠血压的影响(±s)
注:其他各组与空白组比较,*P<0.05,**P<0.01;其他各组与模型对照组比较,△P<0.05,△△P<0.01。
组别 例数 第0天 第1天 第4天 第7天 第14天 第28天正常空白对照组 9 109.21±9.48△△ 112.32±10.08△△ 110.43±10.35△△ 111.26±10.68△△ 113.45±9.68△△ 112.54±10.82△△模型空白对照组 9 157.81±11.25** 155.63±12.57** 150.25±12.30** 147.61±12.06** 146.28±10.34** 146.47±12.26**复代文组 9 158.63±10.87**142.03±11.68**△△137.12±11.59**△△133.11±11.84**△△ 129.63±11.21**△△ 127.45±11.84**△△中药高剂量组 9 159.26±12.33** 150.14±12.03**△ 141.55±10.85**△△135.16±10.97**△△ 132.15±11.46**△△ 130.23±11.43**△△中药中剂量组 9 158.36±11.64** 152.15±9.54**△ 143.64±11.22**△△139.27±11.69**△△ 135.18±10.82**△△ 133.47±10.71**△△中药低剂量组 9 157.89±9.98** 154.32±10.75** 147.25±11.87**△ 141.52±10.96**△△138.66±11.67**△△ 137.26±12.04**△△
2.2 对高盐高血压大鼠血压的影响 第1周除空白组外,各模型组血压均有不同程度下降。下降程度依次为:复代文组>中药高剂量组>中药中剂量组>中药低剂量组>模型对照组。其降压作用:第1天,复代文组与其他模型组血压值比较有统计学意义(P<0.01);中药高剂量组、中药中剂量组与模型对照组比较有统计学意义(P<0.01)。至第4天,各组血压值进一步下降,中药各组虽然降压作用不及复代文组,但中药各组降压作用开始增强,而尤以中药高剂量组、中药中剂量组为明显,并持续至第7天。其中,中药高剂量组血压值较复代文组比较有统计学意义(P<0.05),而中药中剂量组、中药低剂量组血压值与复代文组比较有统计学意义(P<0.01);中药各组血压值与模型对照组比较,中、高剂量组有统计学意义(P<0.01),低剂量组有统计学意义(P<0.05)。从第2周开始至第4周末,空白组、模型对照组的血压没有明显变化,其中空白组保持在正常血压值范围,而模型对照组则维持在较高水平不再继续下降;其余用药4个组血压进一步下降,并持续至实验结束,各组同期降压幅度依旧是:复代文组>中药高剂量组>中药中剂量组>中药低剂量组。至第4周末最后测定血压值,复代文组血压值低于其他3个剂量中药组,有统计学意义(P<0.01);中药高剂量组较中药中、低剂量组有统计学意义(P<0.05、P<0.01);中药中剂量组较低剂量组有统计学意义(P<0.05);中药各剂量组较模型对照组均有统计学意义(P<0.01或P<0.05),见表2。
2.3 对高盐高血压大鼠RAAS的影响 28天后,模型对照组血浆AngⅡ值、ALD值较空白组明显升高,有统计学意义(P<0.01);复代文组及中药各组血浆AngⅡ值、ALD值与模型空白对照组比较均有下降。其中复代文组及中药高剂量组的血浆AngⅡ值、血清ALD值与模型对照组比较有统计学意义(P<0.05);中药中、低剂量组血浆AngⅡ值与模型空白对照组比较无统计学意义(P>0.05),ALD值与模型对照组比较有统计学意义(P<0.05)。各给药组的AngⅡ值、醛固酮值组间比较无统计学意义(P>0.05),见表3。
表328 天后各组血管紧张素Ⅱ、醛固酮值(±s)
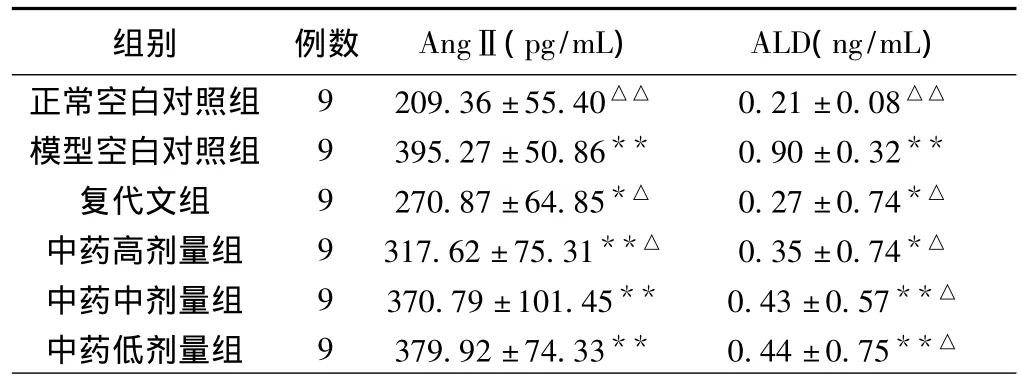
表328 天后各组血管紧张素Ⅱ、醛固酮值(±s)
注:其他各组与正常空白对照组比较,*P<0.05,**P<0.01;其他各组与模型空白对照组比较,△P<0.05,△△P<0.01。
组别 例数 AngⅡ(pg/mL) ALD(ng/mL)正常空白对照组 9 209.36±55.40△△ 0.21±0.08△△模型空白对照组 9 395.27±50.86** 0.90±0.32**复代文组 9 270.87±64.85*△ 0.27±0.74*△中药高剂量组 9 317.62±75.31**△ 0.35±0.74*△中药中剂量组 9 370.79±101.45** 0.43±0.57**△中药低剂量组 9 379.92±74.33** 0.44±0.75**△
表4 各组血清内源性类洋地黄含量及红细胞Na+,K+-ATPase活性(±s)
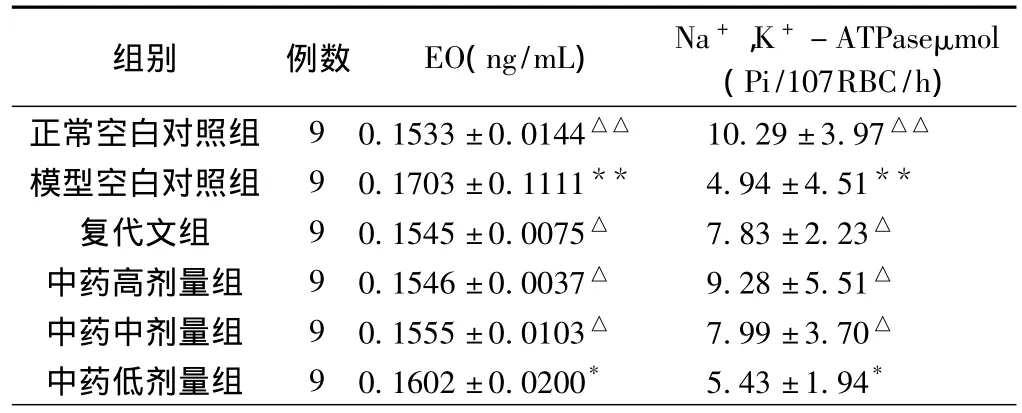
表4 各组血清内源性类洋地黄含量及红细胞Na+,K+-ATPase活性(±s)
注:其他各组与正常空白对照组比较,*P<0.05,**P<0.01;其他各组与模型空白对照组比较,△P<0.05,△△P<0.01。
组别 例数 EO(ng/mL) Na+,K+-ATPaseμmol(Pi/107RBC/h)正常空白对照组 9 0.1533±0.0144△△ 10.29±3.97△△模型空白对照组 9 0.1703±0.1111** 4.94±4.51**复代文组 9 0.1545±0.0075△ 7.83±2.23△中药高剂量组 9 0.1546±0.0037△ 9.28±5.51△中药中剂量组 9 0.1555±0.0103△ 7.99±3.70△中药低剂量组 9 0.1602±0.0200* 5.43±1.94*
2.4 对血清EO、红细胞Na+,K+-ATPase活性的影响 28天后,模型空白对照组血清EO含量较正常组显著升高。各用药组EO含量与模型空白对照组比较均有所降低。其中,复代文组及中药高、中剂量组与模型对照组比较有统计学意义(P<0.05)。模型对照组红细胞膜Na+,K+-ATPase活性较正常组显著降低。各用药组Na+,K+-ATPase活性较模型对照组均有提高,提高程度依次为中药高剂量组>中药中剂量组>复代文组>中药低剂量组。其中,中药高、中剂量组、复代文组与模型对照组比较有统计学意义(P<0.05),中药高、中剂量组、复代文组三组间比较无统计学意义(P>0.05),见表4。
3 讨论
本研究以中医“水郁折之”为指导思想,采用利水为主、利水活血祛痰三法合一的泽泻汤加味方,对高盐饮食高血压大鼠进行降压效果对比研究。结果表明:1)本方具有一定的降压作用,存在着剂量依赖关系;2)其降压作用于第4~7天相对明显,与其利水、减少血容量相关;3)模型对照组虽没有药物干预,但血压在实验后的第1周也在下降,表明高盐饮食高血压大鼠的血压存在自然回落现象,因本实验没有进行更为详尽的时间段血压测量,暂不能明确血压自然回落的至何时终止确切时间,但可基本限定在1~2周内;4)随着本方用药时间的延长,其降压作用及效果虽不及复代文,且1周后降压趋势弱于第1周,但依旧可使高盐高血压大鼠血压继续下降,说明了其长期降压作用不是单纯利水作用实现的,应是利水活血祛痰三法合一综述合作用结果。
流行病学和临床观察均示食盐摄入量与高血压发生呈正相关,其机制尚不完全清楚。多数学者认为:一是高盐摄入和肾排钠能力减退,使钠在体内积聚,可导致血管平滑肌细胞对去甲肾上腺素、血管紧张素Ⅱ等的反应性增强,易引起外周血管阻力增高;二是钠潴留使细胞外液量增加,引起心排血量增高[2]。利尿剂主要是减少体内钠而产生降压效应。初期以减少血容量和细胞外液为主,长期降压效应可能是通过抑制Na+进入血管平滑肌细胞使细胞内Na+浓度下降实现的。本研究结果显示,各组的降压作用为:复代文组>高剂量组>中剂量组>低剂量组,与其利尿作用(复代文组>高剂量组>中剂量组>低剂量组)呈一致性,这种关系主要体现于给药后的第1周。表明本方确有利尿作用,其利尿作用以第1周为突出,呈现剂量依赖关系,其降压作用与利尿作用呈正相关。1周后,除复代文组的尿量与给药前比较有统计学意义外,中药复方各组并不增加,但降压作用依然存在,表明其降压作用并非单一利水作用所为,应是利水活血祛痰三法合一作用的结果。其机制与初期加强肾脏排水利钠、减少血容量相关,后期降压作用或与降低体内升压因素、降低外周阻力相关。
RAAS在血压调节过程中起着枢纽作用。AngⅡ是调控ALD合成释放的重要因素,是RAAS中维持和升高血压的关键因子[3]。ALD由肾上腺皮质球状带细胞产生的盐皮质激素,可促进肾远曲小管和集合管对Na+的重吸收并促进K+的排泌,有保钠、保水、排钾作用,从而增加细胞外液量和心输出量,反射性引起血管收缩。本研究结果显示,本方具有降低血循环AngⅡ、ALD作用,且中药高、中剂量组与模型空白对照组均有统计学意义(P<0.05)。故其降压作用与本方降低循环AngⅡ、ALD直接相关。其可能的机制为:1)通过本方的利尿作用,减少血容量,进而减弱了RAAS活性,导致循环AngⅡ含量下降而实现降压效应的。2)通过本方改善肾小球入球小动脉血管弹性,提高肾脏入球小动脉压力感受器的敏感性实现的;亦或是抑制肾脏组织ALD,从而使ALD致残余肾小球硬化和间质纤维化作用减弱,恢复肾脏的压力—利钠功能,但尚缺乏直接证据。
EO作为一种肾上腺皮质激素,长期摄入高钠盐可通过体液容量扩张刺激肾上腺和下丘脑分泌EO和前海葱苷原A样物质(PLC)入血循环,抑制组织细胞特别是血管平滑肌细胞膜Na+,K+-ATPase活性,引起细胞内Na+和游离Ca2+浓度升高而导致血压升高[4]。流行病学研究显示,多种类型的高血压患者血浆EO水平均升高,其中30%~45%的原发性高血压患者明显高于正常血压者,有高血压家族史和临界高血压患者明显高于血压正常的人群[5]。本研究结果显示,高盐高血压大鼠血清EO含量较正常Wistar大鼠为高。用药28天后的EO含量,中药高、中剂量组与模型对照组比较有统计学意义(P<0.05)。说明本方具有降低血循环EO含量作用。其机制或与本方的利尿作用,促进水钠排泄,从而减弱了EO分泌、释放的应激性刺激,及降低血循环AngⅡ含量,并一定程度改善循环RAAS负反馈调节作用,从而减少EO代偿性释放入血、排钠利水的效应有关。
现代医学认为,膜离子运输失常和肾脏排钠能力降低与高血压发病之间存在密切关系,Na+,K+-ATPase是EO惟一内源性受体,通过与Na+,K+-ATPase的α1亚单位结合而介导升压和增强血管收缩力的作用,特别是细胞膜Na+,K+-ATPase活性抑制被认为是细胞内游离Ca2+浓度增加与血压升高相联系的核心成分。本研究结果显示,高盐高血压大鼠红细胞膜Na+,K+-ATPase活性较正常Wister大鼠为高。给药28天后,各用药组Na+,K+-ATPase活性均有提高,提高程度依次为中药高剂量组>中药中剂量组>复代文组>中药低剂量组,中药高、中剂量组、复代文组与模型对照组比较有统计学意义(P<0.05)。说明本方具有较好提高高盐饮食高血压大鼠红细胞膜Na+,K+-ATPase活性作用,并呈一定剂量依赖关系。其机制很可能与降低血清EO含量,减弱钠泵抑制因子对细胞膜Na+,K+-ATPase抑制作用,从使Na+,K+-ATPase活性得以恢复有关。
总之,泽泻汤加味主具有降低高盐高血压大鼠血压的作用,并呈一定的剂量依赖关系。其作用机制与本方具有利水作用直接相关外,另与本方能降低循环AngⅡ、ALD,改善循环RAAS调节作用,从而降低EO分泌,减弱EO对外周阻力血管平滑肌细胞膜Na+,K+-ATPase活性的抑制有关。
[1]曾邵华.一种新的高盐致高血压动物模型及其血管重构改变[J].中国临床药理学与治疗学,2005,10(1):24-27.
[2]陈灏珠.内科学[M].第3版.北京:人民卫生出版社,1989:207-208.
[3]任利群,冯改涛,李万红.高血压患者血浆PRA、AngⅡ、ALD浓度变化及意义[J].内蒙古医学杂志,2000,32(1):10 -11.
[4]符云峰,李素琴,卢振敏,等.高钠盐摄入对钠泵抑制因子水平和钠-钾泵活性的影响[J].高血压杂志,2000,8(2):171-174.
[5]Harnlyn JM,Hamilton BP,Manunla P,el al.Endonenousouabain,Sodium Balance and Blood Pressure:a Review and a Hypothesis.J Hypertens,1996,14(1):151 -161.
