非稳定型亚甲胺基叶立德参与的三组分1,3-偶极环加成反应合成新型四氢吡咯衍生物
2012-11-21潘华,徐亮
潘 华, 徐 亮
(四川大学 华西药学院,四川 成都 610041)
醛和胺基化合物在反应条件下原位生成亚甲胺基叶立德,继而与烯烃进行三组分1,3-偶极环加成反应是构建高度功能化四氢吡咯环结构最为简洁有效的方法。其中,具有吸电子基取代的稳定型亚甲胺基叶立德参与的三组分1,3-偶极环加成反应的研究已有众多文献[1~7]报道,并取得了许多重要结果。相对而言,有关非稳定型亚甲胺基叶立德参与的三组分1,3-偶极环加成反应却少见报道。1996年,Risch课题组[8]利用二苄胺与苯甲醛在甲苯中回流,再与多种亲偶极体(烯烃或醛羰基)发生1,3-偶极环加成反应,得到了一系列多苯基取代的五元含氮衍生物;Torii等[9]将N-三甲基硅甲基苄胺(1)与醛在四氢呋喃中加热回流生成非稳定亚甲胺基叶立德,继而与贫电子烯烃发生三组分1,3-偶极环加成反应得到各种四氢吡咯烷衍生物。但是,上述三组分反应都需要采用回流等比较剧烈的反应条件,底物类型也比较局限,多数亲偶极体都是高活性的烯烃底物,例如马来酸或富马酸衍生物等。
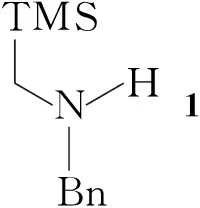
Scheme1
本文以1,多聚甲醛和各种贫电子烯烃(2a~2j)为原料,经质子酸催化剂和反应溶剂的筛选,在十分温和反应条件下发生非稳定型亚甲胺基叶立德参与的三组分1,3-偶极环加成反应,高收率地合成了10个3,4-二取代四氢吡咯衍生物(3a~3j, Scheme 1),其中3c,3d,3f~3h和3j为新化合物,其结构经1H NMR,13C NMR和HR-MS表征。
1 实验部分
1.1 仪器与试剂
Varian Unity NOVA-400/54型核磁共振仪(CDCl3为溶剂,TMS为内标);Waters Q-TOF-Premier型质谱仪。
柱层析用硅胶,200目~300目,青岛海洋化工厂;薄层层析GF254硅胶板,烟台江友硅胶开发有限公司;其余所用试剂均为分析纯。
1.2 合成
(1)1的合成[10]
氩气保护,在圆底烧瓶中加入N-三甲基氯甲基硅12.3 g(100 mmol)的乙腈(100 mL)溶液,搅拌下滴加苄胺21.4 g(200 mmol),滴毕,回流(90 ℃)反应16 h。冷却至室温,过滤,滤液浓缩后加水50 mL,用正己烷(3×50 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水硫酸钠干燥,蒸除溶剂得淡黄色液体117.6 g,收率91%;1H NMRδ: 8.15(s, 1H), 7.72~7.38(m, 5H), 3.42(s, 2H), 0.08(s, 9H)。
(2)3a~3j的合成(以3a为例)
氩气保护,在10 mL反应管中加入1 290 mg(1.5 mmol),多聚甲醛45 mg(1.5 mmol)和干燥DMF 2 mL,搅拌使其溶解;加入富马酸二甲酯(2a) 144 mg(1 mmol)和10%磷酸6 μL(0.1 mmol),于室温反应12 h(TLC检测)。加入乙酸乙酯2 mL,依次用饱和NaHCO3溶液(5 mL)和饱和NaCl溶液(5 mL)洗涤,无水Na2SO4干燥,蒸干溶剂后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=4 ∶1]纯化得白色固体3,4-二甲酸甲酯-N-苄基四氢吡咯(3a)。
用类似的方法合成白色固体3b~3j。
3a[11]:1H NMRδ: 7.31~7.26(m, 5H), 3.70(s, 6H), 3.60(s, 2H), 3.47~3.44(m, 2H), 2.92~2.88(m, 2H), 2.80~2.77(m, 2H)。
3b[12]:1H NMRδ: 7.39~7.21(m, 10H), 3.74~3.65(m, 6H), 3.15~3.01(m, 3H), 2.91~2.88(m, 1H), 2.79~2.75(m, 1H)。
3c:1H NMRδ: 8.15(d,J=8.8 Hz, 2H), 7.51(d,J=8.8 Hz, 2H), 7.37~7.25(m, 5H), 3.78~3.73(m, 1H), 3.69~3.65(m, 5H), 3.21~3.17(m, 1H), 3.09~3.04(m, 1H), 2.96~2.92(m, 1H), 2.85~2.76(m, 2H);13C NMRδ: 173.8, 152.3, 146.6, 138.3, 128.5, 128.5, 128.3, 128.3, 128.2, 128.2, 127.1, 123.8, 123.8, 61.0, 59.6, 57.1, 52.1, 51.6, 46.3; HR-MS: Calcd for C19H20N2O4340.142 3, found 340.142 2。
3d:1H NMRδ: 7.37~6.83(m, 9H), 3.78(s, 3H), 3.72~3.61(m, 6H), 3.07~2.98(m, 3H), 2.90~2.87(m, 1H), 2.73~2.69(m, 1H);13C NMRδ: 174.6, 158.2, 138.6, 136.0, 128.7, 128.7, 128.3, 128.3, 128.2, 128.2, 127.0, 113.8, 113.8, 61.8, 59.9, 57.3, 55.2, 51.9, 51.7, 46.2; HR-MS: Calcd for C20H23NO3325.167 8, found 325.168 0。
3e[13]:1H NMRδ: 7.45~7.09(m, 9H), 3.98~3.93(m, 1H), 3.72~3.64(m, 5H), 3.15~3.08(m, 2H), 3.02~2.98(m, 1H), 2.89~2.83(m, 1H), 2.72~2.68(m, 1H), 2.35(s, 3H)。
3f:1H NMRδ: 8.32~7.23(m, 12H), 4.51~4.46(m, 1H), 3.78~3.66(m, 2H), 3.62(s, 3H), 3.37~3.25(m, 2H), 3.09(t,J=8.8 Hz, 1H), 3.02~2.98(m, 1H), 2.84(t,J=8.0 Hz, 1H);13C NMRδ: 174.8, 140.2, 138.8, 133.9, 131.5, 128.8, 128.6, 128.6, 128.3, 128.3, 127.1, 127.0, 125.9, 125.6, 125.4, 124.3, 123.7, 61.4, 59.9, 57.7, 51.9, 51.0, 42.5; HR-MS: Calcd for C23H23NO2345.172 9, found 345.173 1。
3g:1H NMRδ: 7.34~7.25(m, 6H), 6.28~6.27(m, 1H), 6.08~6.07(m, 1H), 3.83~3.78(m, 1H), 3.71~3.61(m, 5H), 3.22~3.17(m, 1H), 3.05~3.00(m, 1H), 2.98~2.89(m, 2H), 2.72~2.68(m, 1H);13C NMRδ: 174.3, 155.9, 141.4, 138.4, 128.6, 128.6, 128.2, 128.2, 127.0, 110.1, 105.0, 59.7, 58.6, 56.7, 52.1, 48.1, 40.2; HR-MS: Calcd for C17H19NO3285.136 5, found 285.136 6。
3h:1H NMRδ: 7.38~7.23(m, 5H), 7.15~7.14(m, 1H), 6.92~6.89(m, 2H), 4.01~3.96(m, 1H), 3.73~3.64(m, 5H), 3.14~3.09(m, 1H), 3.07~3.00(m, 2H), 2.88(dd,J=6.4 Hz, 9.2 Hz, 1H), 2.74 (dd,J=6.4 Hz, 9.2 Hz, 1H);13C NMRδ: 174.3, 147.3, 138.6, 128.6, 128.6, 128.2, 128.2, 127.0, 126.5, 123.9, 123.7, 61.8, 59.6, 56.7, 52.0, 51.9, 42.3; HR-MS: Calcd for C17H19NO2S 301.113 6, found 30.113 9。
3i[14]:1H NMRδ: 7.32~7.24(m, 5H), 3.68(s, 3H), 3.66~3.51(m, 2H), 2.81~2.80(m, 2H), 2.71~2.70(m, 2H), 2.32~2.29(m, 2H), 1.63~1.56(m, 1H), 0.90(d,J=6.8 Hz, 3H), 0.87(d,J=6.8 Hz, 3H)。
3j:1H NMRδ: 7.32~7.24(m, 5H), 3.68(s, 3H), 3.66~3.54(m, 2H), 2.85~2.79(m, 2H), 2.76~2.71(m, 1H), 2.63~2.57(m, 1H), 2.45~2.39(m, 1H), 2.27~2.23(m, 1H), 1.56~1.49(m, 1H), 1.41~1.34(m, 1H), 1.29~1.26(m, 6H), 0.87(t,J=6.8 Hz, 3H);13C NMRδ: 175.4, 138.8, 128.6, 128.6, 128.2, 128.2, 126.9, 60.0, 59.9, 56.7, 51.8, 49.0, 42.0, 35.2, 31.8, 27.6, 22.5, 14.0; HR-MS: Calcd for C18H27NO2289.204 2, found 289.204 4。
2 结果与讨论
2.1 反应条件筛选
以相对惰性的4-甲氧基肉桂酸乙酯(2d)与1反应合成3d为模板,对反应条件进行筛选,结果见表1。从表1可以看出,各种质子酸都能不同程度地催化反应的发生;溶剂对反应的影响较为明显。以乙腈为溶剂,磷酸作催化剂时能够高收率(91%)地得到环加成产物3d,但反应时间较长;以DMF或HMPA为溶剂时,各种质子酸作催化剂均能有效地催化反应进行,其中磷酸催化效果最好,能够以几乎定量的收率得到3d,同时磷酸作催化剂也非常经济。由此可见,合成3d的较佳溶剂为DMF,较佳催化剂为H3PO4。
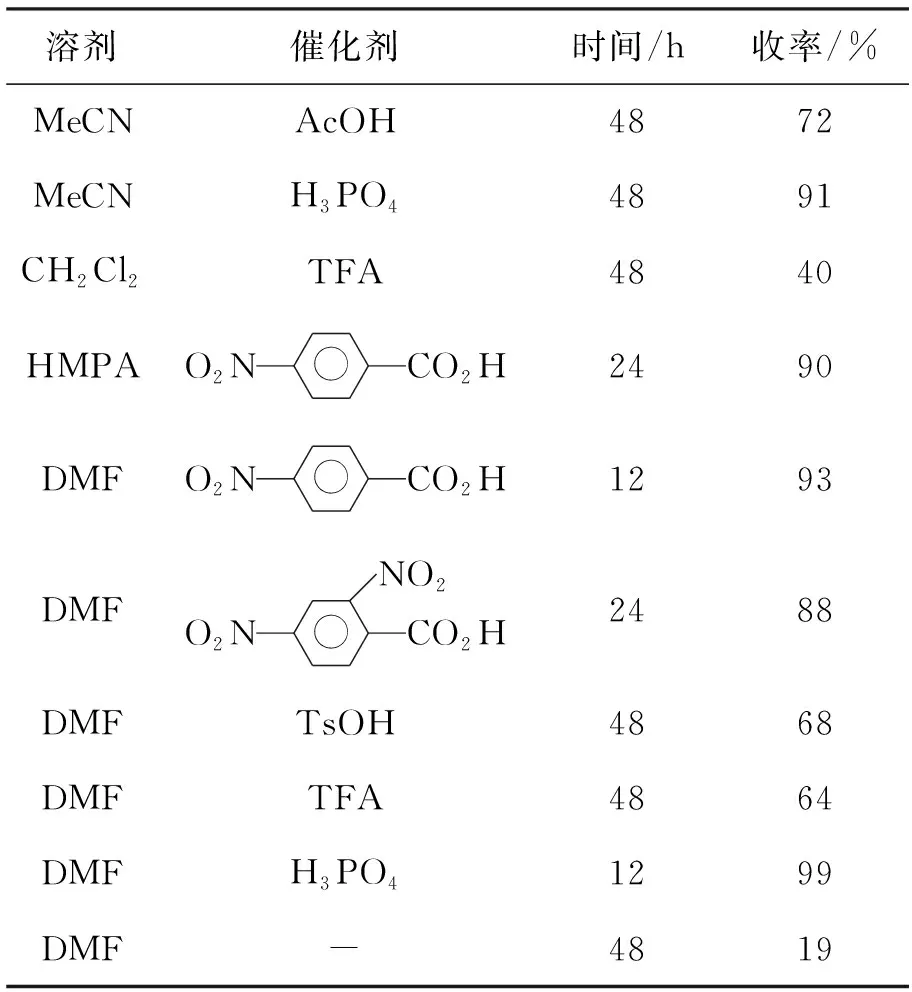
表1 合成3d反应条件的筛选*Table 1 Conditions screening of synthesizing 3d
*催化剂10 mol%,溶剂2 mL,其余反应条件同1.2(2)
2.2 烯烃底物的扩展
以H3PO4(10 mol%)为催化剂,DMF为溶剂,其余反应条件同1.2(2),拓展底物(2a~2j)的实验结果见Scheme 1。从实验结果可以看出,1和多聚甲醛均能与2a~2j发生三组分的1,3-偶极环加成反应,生成相应的3a~3j。无论是高活性的富马酸二甲酯(2a),还是富电子或贫电子取代苯基的烯烃(2b~2e),还是稠环芳烃(2f)与芳杂环取代的烯烃(2g, 2h)均获得了90%以上的高收率。异丙基取代的烯烃(2i)和正戊烷基取代的烯烃(2j)也可以在此条件下获得良好收率了。说明该反应对各种取代的烯烃具有良好的底物适应性。
[1] Hamper B C, Dukesherer D R, South M S. Solid-phase synthesis of proline analogs via a three component 1,3-dipolar cycloaddition[J].Tetrahedron Lett,1996,37:3671-3674.
[2] Sebahar P R, Williams R M. The asymmetric total synthesis of (+)- and (-)-spiroo-tryprostatin B[J].J Am Chem Soc,2000,122:5666-5667.
[3] Wilson N S, Sarko C R, Roth G P. Microwave-assisted synthesis of a [3+2]cyclo-addition library [J].Tetrahedron Lett,2001,42:8939-8941.
[4] Onishi T, Sebahar P R, Williams R M. Concise,asymmetric total synthesis of spirotryprostatin A [J].Org Lett,2003,17:3135-3137.
[5] Li G Y, Chen J, Yu W Y,etal. Stereo-selective synthesis of func-tionalized pyrrolidines by ruthenium porphyrin-catalyzed decomposition of α-diazo esters and cascade azomethine ylide formation/1,3-dipolar cycloaddition reactions[J].Org Lett,2003,5:2153-2156.
[6] Garner P, Kaniskan H U. Synthesis of highly functionalized pyrrolidines via a mild one-pot,three-component 1,3-dipolar cycloaddition process[J].J Org Chem,2005,70:10868-10871
[7] Zhang W, Chen C H T. Fluorous synthesis of biaryl-substituted proline analogs by 1,3-dipolar cycloaddition and Suzuki coupling reactions [J].Tetrahedron Let,2005,46:1807-1810.
[8] Wittland C, Arend M, Risch N. Synthesis of 2, 4, 5-triphenyl-substituted oxazolidine and 2, 5-diphenyl-substituted pyrrolidine[J].Synthsis,1996:367-371.
[9] Torii S, Okumoto H, Genba A. A versatile cycloaddition for the generation of pyrroli-dine derivatives via C-N-C 1,3-dipoles[J].Chemistry Letter,1996:747-748.
[10] Albert P, William D.N-benzyl-N-methoxymethyl-N-(trimethylsilyl)methylamine as an azomethine ylide equivalent:2,6-Dioxo-1-phenyl-4-benzyl-1,4-diazabicyclo[3.3.0]octane[J].Org Synth,1993,8:231-232.
[11] Kibayashi C, Yamazaki N. Product class 1:O,N-acetals.Product subclass 1:acyclic bO,N-acetals[J].Science of Synthesis,2007,30:7-19.
[12] Yoshiyasu T, Kotaki H, Nobuyuki I. Trifluoroacetic acid-catalyzed 1,3-cycloaddition of the simplest iminium ylide leading to 3- or 3,4-substituted pyrrolidines and 2,5-dihydropyrroles[J].Chem Pharm Bull,1985,33:2762-2766.
[13] Shawn J S, Thomas S, Alessia.Preparation of 3,4-disubstituted pyrrolidines asβ-secretase inhibitors[P].WO 2 009 078 932,2009.
[14] Robert V P, Caroline P L. Amino-heterocyclic compounds as PDE9 inhibitors and their preparation,pharmaceutical compositions and use in the treatment of neurodegenerative diseases[P].WO 2 008 139 293,2008.
