新型异噁唑衍生物的合成及其抗菌活性
2012-11-21张存彦刘登科孙长海
张存彦, 刘登科, 孙长海, 刘 默, 刘 巍
(1. 天津红日药业股份有限公司,天津 301700; 2. 天津药物研究院,天津 300193)
噁唑烷酮类抗菌药物是继磺胺类和氟喹诺酮类后上市的又一类全合成抗菌药物,对革兰阳性菌的抗菌谱非常广,对耐甲氧西林葡萄球菌和耐万古霉素的葡萄球菌、耐万古霉素肠球菌、耐青霉素肺炎球菌和厌氧菌均有抗菌活性。其作用机制是抑制mRNA与核糖体的结合。代表药物是利奈唑胺在国外被用于治疗由革兰氏阳性菌所造成的感染。但是利奈唑胺易引起白细胞血小板减少及高血压等不良反应。
为降低药物的毒副作用,研究人员对噁唑烷酮的化学结构作进一步研究,其中生物电子等排体的使用是发现新药物的重要手段。近年来,通过对异噁唑的结构改造合成具有生物活性的化合物已成为创制药物研究的热点之一[1~9]。
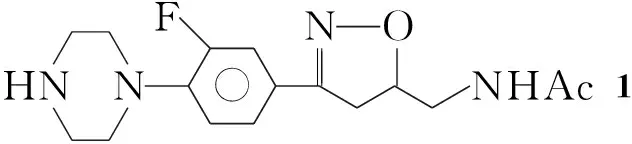
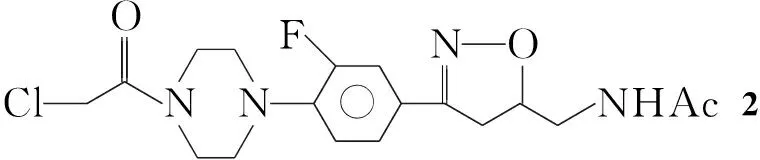
本文设计并且合成了15个新型的异噁唑衍生物。5-乙酰胺甲基-3-[3-氟-4-(1-哌嗪基苯基)]异噁唑啉(1)与氯乙酰氯反应制得中间体5-乙酰胺甲基-3-[3-氟-4-(4-氯乙酰基-1-哌嗪基苯基)]异噁唑啉(2); 2与取代哌嗪(3a~3l)或取代六氢吡啶(3m~3o)反应合成了15个新型的异噁唑类衍生物(4a~4o),其结构经1H NMR和FAB-MS表征。以利奈唑为阳性对照,初步测试了4a~4o对黄色葡萄球菌CMCC 26003(S.aureus26003),藤黄八叠球菌CMCC 28001(Sarcinalutea28001),绿脓假单胞菌CMCC 10211(P.aeruginosa10211)和肺炎克雷伯杆菌CMCC 46117(K.pneumoniae46117)的抗菌活性。
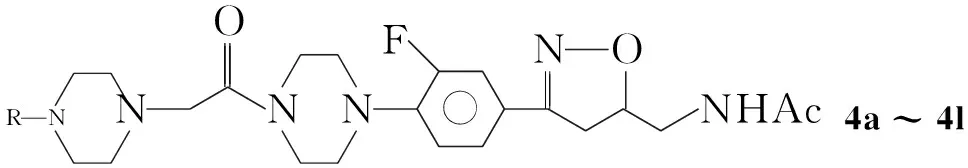

CompabcdefghRMePhPh- Ph- F--Bn OO - N -CompijklmnoR O2N-OO - HO-HO-H2NO -3,5-Me23-HO
Scheme1
1 实验部分
1.1 仪器与试剂
YRT-3型熔点仪(温度未校正);Bruker AV400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);VGZAB-HS型质谱仪。
1按文献[5,6]方法合成(白色固体,收率98%, m.p.160.3 ℃~161 ℃);微生物鉴定培养基(pH 7.9±0.1),北京三药科技开发公司;S.aureus26003),Sarcinalutea28001,P.aeruginosa10211,K.pneumoniae46117,中国药品生物制品鉴定所。
1.2 合成
(1) 2的合成
在反应瓶中加入1 2.54 g(10 mmol)的氯仿(10 mL)溶液和三乙胺2 mL(10 mmol),搅拌下冷却至5 ℃,缓慢滴加氯乙酰氯(控制在5 ℃以下,有大量烟雾产生),滴毕,反应2 h(TLC检测)。加水30 mL,分液,水层用氯仿(2×10 mL)萃取,合并有机层,用无水硫酸钠干燥,浓缩后经无水乙醚重结晶得白色固体2,收率98.2%, m.p.156.1 ℃~158.0 ℃;1H NMRδ: 1.81(s, 3H), 3.04~3.11(m, 5H), 3.22~3.25(t, 2H), 3.40~3.43(q, 1H), 3.62(s, 4H), 4.42(s, 2H), 4.65~4.74(m, 1H), 7.06~7.10(t, 1H), 7.35~7.42(m, 2H), 8.08~8.11(t, 1H)。
(2)4a~4o的合成(以4a为例)
在反应瓶中依次加入N-甲基哌嗪(3a) 0.28 g(2.8 mmol),氯仿10 mL,碳酸钾0.4 g(2.8 mmol)和2 1.1 g(2.8 mmol),搅拌下回流反应约3 h(TLC监测)。过滤,滤饼用氯仿洗涤,合并有机液,浓缩后经硅胶柱层析[洗脱剂:V(6%甲醇) ∶V(二氯甲烷)=3 ∶50]分离得4a。
用类似的方法合成4b~4o。
2 结果与讨论
2.1 合成
4a~4o的实验结果和MS数据见表1;表征数据见表2。
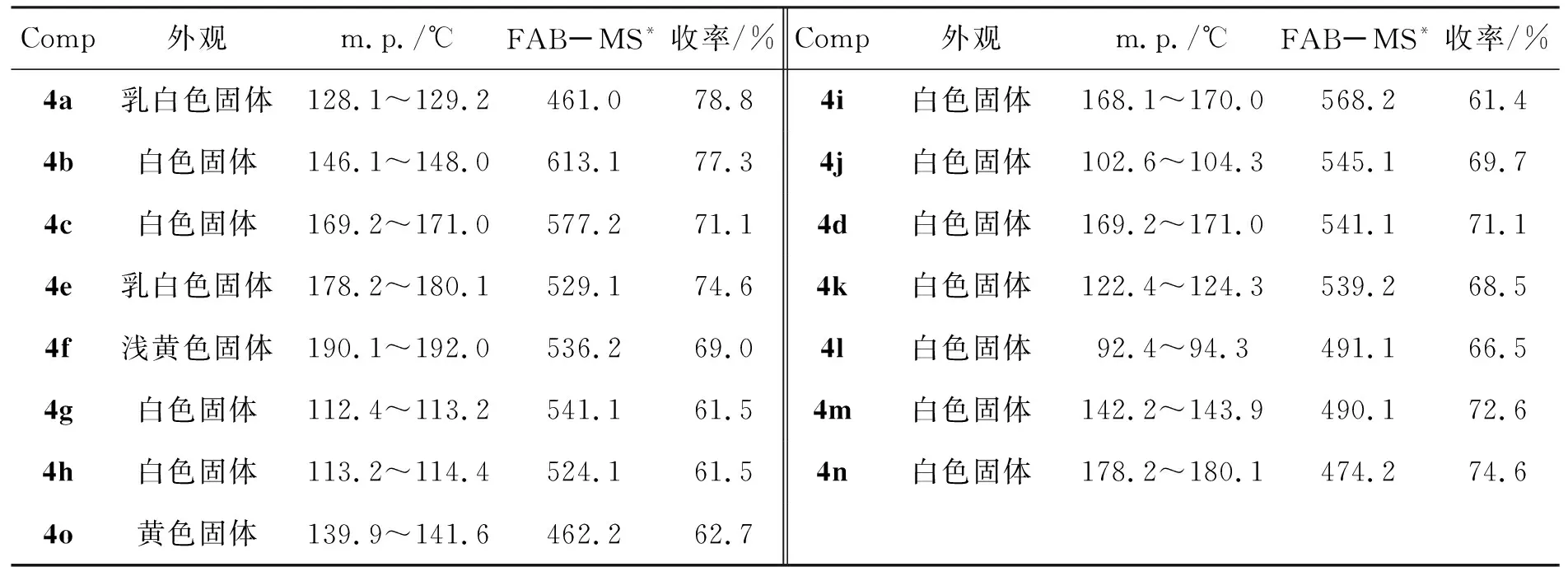
表1 合成4的实验结果和MS数据Table 1 Experimental results and MS data of synthesizing 4
*m/z: {[M+H]+}
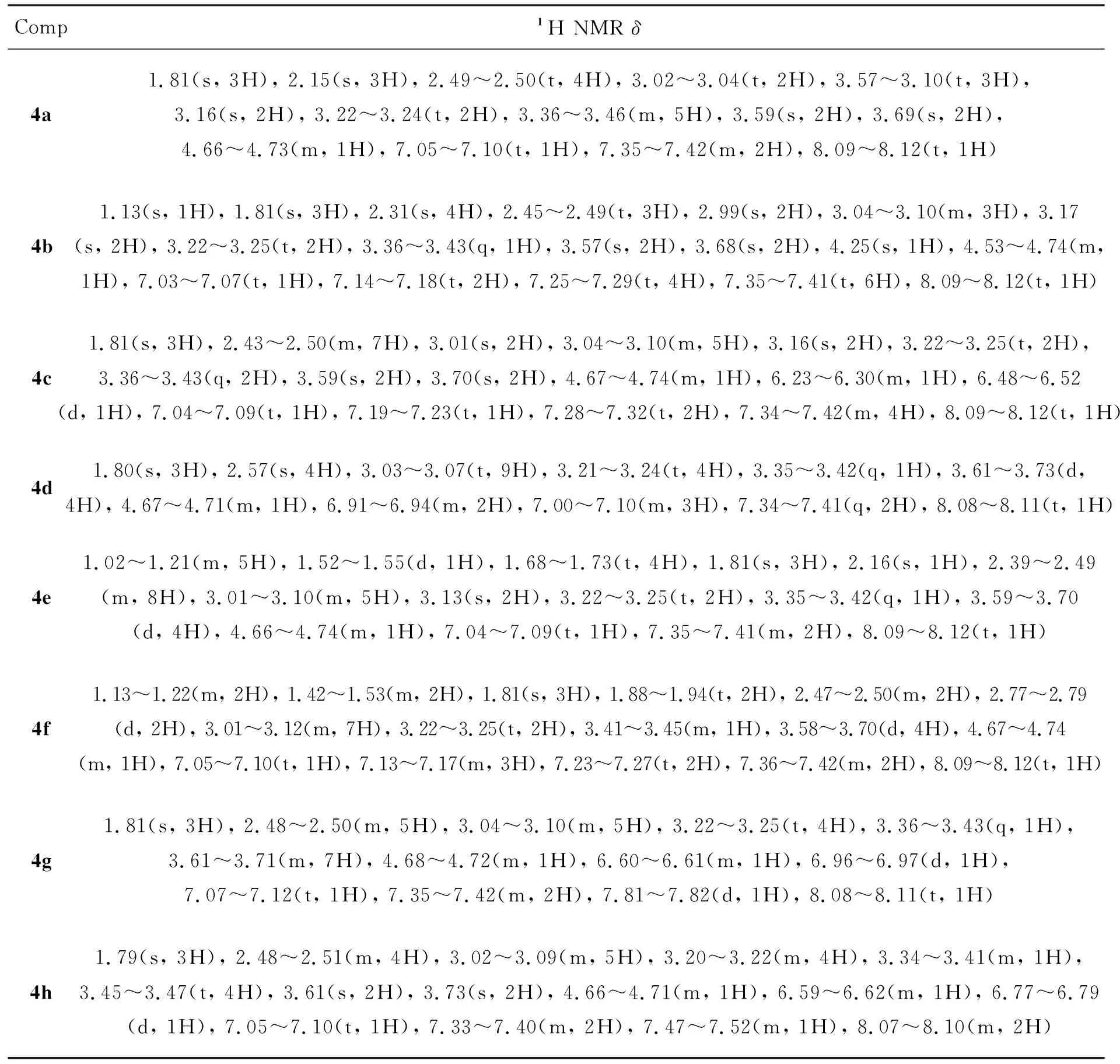
表2 4的1H NMR数据Table 2 1H NMR data of 4
续表2

Comp1H NMR δ4i1.80(s, 3H), 2.48^2.58(m, 3H), 3.03^3.10(m, 5H), 3.21^3.24(t, 2H), 3.28(s, 1H), 3.31(s, 2H), 3.35^3.42(q, 1H), 3.47(s, 4H), 3.62^3.72(d, 4H), 4.66^4.73(m, 1H), 7.00^7.03(d, 2H), 7.07^7.11(t, 1H), 7.34^7.41(t, 2H), 8.02^8.03(d, 2H), 8.08^8.11(t, 1H)4j1.76^1.76(m, 5H), 1.90^2.03(m, 2H), 2.40^2.49(m, 4H), 3.04^3.10(m, 5H), 3.22^3.23(d, 4H), 3.36^3.55(m, 6H), 3.60(s, 2H), 3.68^3.78(m, 4H), 4.61^4.73(m, 2H), 7.07^7.11(t, 1H), 7.35^7.42(m, 2H), 8.09^8.12(t, 1H)4k1.80(s, 3H), 2.49^2.55(m, 3H), 2.96(s, 3H), 3.03^3.05(d, 3H), 3.07^3.09(d, 3H), 3.21^3.24(t, 4H), 3.31(s, 1H), 3.35^3.42(q, 1H), 3.61(s, 2H), 3.73(s, 2H), 4.66^4.74(m, 1H), 6.61^6.64(t, 2H), 6.75^6.77(d, 2H), 7.05^7.10(t, 1H), 7.34^7.41(m, 2H), 8.08^8.11(s, 1H)4l1.81(s, 3H), 2.34^2.40(m, 9H), 3.01^3.08(m, 5H), 3.14(s, 2H), 3.22^3.24(t, 2H), 3.36^3.46(m, 4H), 3.59^3.70(d, 4H), 4.35(s, 1H), 4.68^4.72(m, 1H), 7.05^7.09(t, 1H), 7.35^7.41(t, 2H), 8.09^8.12(t, 1H)4m1.50^1.57(m, 2H), 1.63^1.66(d, 2H), 1.81(s, 3H), 1.94^2.03(m, 3H), 2.80^2.83(d, 2H), 3.02^3.10(d, 5H), 3.13(s, 2H), 3.22^3.24(t, 2H), 3.35^3.42(m, 1H), 3.59(s, 2H), 3.71(s, 2H), 4.67^4.72(m, 1H), 6.70(s, 1H), 7.06^7.10(t, 1H), 7.20(s, 1H), 7.35^7.41(m, 2H), 8.08^8.11(t, 1H)4n0.44^0.50(q, 1H), 0.78^0.80(d, 5H), 0.89^0.90(d, 1H), 1.46^1.65(m, 4H), 1.81(s, 3H), 2.73^2.75(d, 2H), 3.01^3.12(m, 7H), 3.22^3.25(t, 2H), 3.35^3.42(d, 1H), 3.59^3.70(d, 4H), 4.66^4.73(m, 1H), 7.04^7.09(t, 1H), 7.35^7.41(m, 2H), 8.09^8.12(t, 1H)4o1.05^1.08(m, 1H), 1.38^1.44(m, 1H), 1.59^1.63(m, 1H), 1.74^1.81(m, 5H), 1.89^1.94(m, 1H), 2.60^2.63(d, 1H), 2.79^2.82(m, 1H), 3.02^3.12(m, 5H), 3.17(s, 2H), 3.20^3.25(m, 2H), 3.36^3.40(m, 1H), 3.42^3.48(m, 1H), 3.59^3.70(m, 4H), 4.59^4.60(d, 1H), 4.66^4.74(m, 1H), 7.05^7.09(t, 1H), 7.35^7.41(m, 2H), 8.09^8.11(t, 1H)
2.2 抗菌活性测试及结果
在消毒过的96孔板的1孔和12孔中分别加入菌液和肉汤培养液(对照)。用培养基按倍比将4配成浓度为(0.25~128) μg·mL-1的溶液。在2孔~11孔中用微量可调移液器从低浓度到高浓度依次加入药液(每孔100 μL);在每孔中加入稀释菌液1 μL,使各孔中4的浓度分别为(0.125, 0.25, 0.5, 1, 2, 4, 8, 16, 32, 64) μg·mL-1;置振荡器上振荡1 min,使孔内溶液充分混合。微孔板加盖并用胶纸密封以减少孵育过程中的蒸发,于37 ℃温箱中孵育18 h,肉眼观测无细菌生长孔所含最低药物的浓度即为最小抑菌浓度(MIC/μg·mL-1)。每组实验重复3次,求平均值。
4的抗菌活性结果见表3。由表3可见,4a~4o对S.aureus26003,Sarcinalutea28001,P.aeruginosa10211,K.pneumoniae46117均有一定的抗菌活性。但对革兰氏阳性菌的抑菌作用优于革兰氏阴性菌。其中,4g对革兰氏阳性菌的抑菌作用较强。
3 结论
本文设计并且合成了15个新型的异噁唑衍生物。初步的生物活性测试结果表明,他们对金黄色葡萄球菌、藤黄八叠球菌、绿脓假单胞菌和肺炎克雷伯杆菌均有一定的抗菌活性。
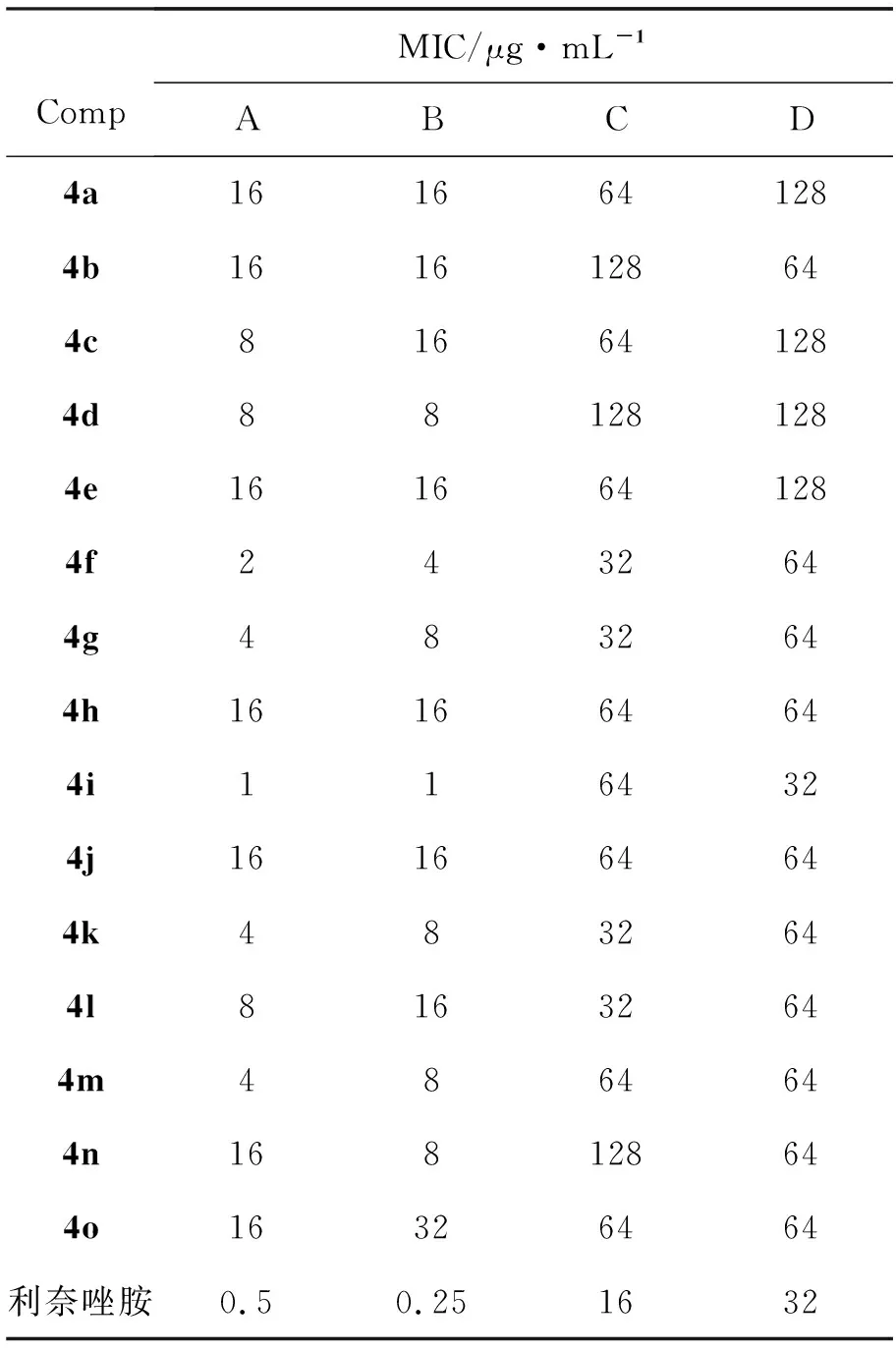
表3 4的抗菌活性Table 3 Antibacterial activity of 4
*A=Sarcinalutea28001, B=S.aureus26003, C=K.pneumoniae46117, D=P.aeruginosa10211
[1] Barbachyn M R, Morris Joel, Wishka D G,etal. Substituted aminopkenyl isoxazoline derivatives as antimicrobials.[P]WO 9 941 244,1999.
[2] Douglas K H, Michael R B, Steven T B,etal. Oxazolidinone antimicrobials containing substituted diazine moieties[P].US 5 547 950,1996.
[3] Davenport J D. Substituted isoxazolines for control of plant phytopathogens[P].US 4 283 403,1981.
[4] Bramhall W H, Wilmslow G A H. Nitrofuryl derivatives of 5-substituted isoxalines[P].US 3 769 295,1973.
[5] 张志强,刘冰妮,刘默,等. 5-乙酰胺甲基-3-[3-氟-4-(1-哌嗪基苯基)]异噁唑啉的合成[J].精细化工中间体,2009,39(3):31-33.
[6] 刘冰妮,刘默,刘登科. 新型异噁唑啉类化合物的合成及其抗肿瘤活性[J].合成化学,2011,19(6):734-736.
[7] 张峥,李忠. 异噁唑衍生物的合成及其生物活性[J].农药研究与应用,2007,11(4):21-26.
[8] 杜光剑,陈东亮,卢锐炯,等. 3-(吗啉吡啶基)-5-取代异噁唑啉类化合物的合成及抗菌活性研究[J].有机化学,2009,29(10):1575-1581.
[9] 刘默. 取代的哌嗪基苯基异噁唑啉衍生物及其用途[P].CN 101 016 270A,2007.
