ezrin表达与宫颈鳞癌组织微血管微淋巴管生成、癌细胞增殖、浸润转移及预后的关系
2012-11-21齐碧如江忠清连成瑛黄勉林岷刘兆董方娇宁
齐碧如 江忠清 连成瑛 黄勉 林岷 刘兆董 方娇宁
埃兹蛋白(ezrin)是ezrin-radixin-moesin(ERM)家族的成员之一,1981年首先作为表皮生长因子受体蛋白酪氨酸激酶的底物被发现,之后从鸡小肠微绒毛中提取鉴定[1]。ezrin作为膜细胞骨架连接蛋白,主要参与上皮细胞中细胞骨架与细胞膜之间的连接,介导信号转导,对维持细胞形态、分化、运动性、细胞与细胞以及细胞与间质之间的的黏附有重要调节作用,并参与多种疾病的发病过程,影响肿瘤的分化、侵袭性和转移[2]。研究表明ezrin过度表达与不同来源的多种人体肿瘤进展密切相关,可促进肿瘤侵袭转移[3]。ezrin与宫颈鳞癌关系的研究国内少见报道。本研究采用免疫组化SP法和图像分析技术检测ezrin在宫颈鳞癌组织的表达情况,探讨其表达与局部肿瘤微血管微淋巴管生成、癌细胞增殖、侵袭转移及预后的关系。
1 材料与方法
1.1 材料 选自1998年3月26日至2005年6月21日在福建医科大学附属第一医院手术治疗的36例宫颈上皮内瘤变(cervical intraepithelial neoplasm,CIN)和68例宫颈鳞状细胞癌(squamous carcinoma of cervix,SCC)患者作为研究对象。所有研究对象术前均未经过化疗、放疗及免疫治疗,并均经病理确诊。选取28例因功血或子宫肌瘤行子宫切除术的正常宫颈上皮(normal cervical epithelium,NCE)作为对照。CIN分级及宫颈癌组织学分级和FIGO分期参照文献[4]。68例宫颈鳞癌患者年龄24~72岁,中位年龄45岁,<45岁者30例,≥45岁者38例。CINⅠ、Ⅱ、Ⅲ级分别为12、11和13例。鳞癌FIGO分期Ⅰ期32例,Ⅱ期36例;组织学分级Ⅰ、Ⅱ、Ⅲ级分别2、19和47例;脉管浸润34例,盆腔淋巴结转移17例;镜下早期浸润癌5例,明显间质浸润癌63例(浅、深肌层浸润各15和48例)。从手术当日到2006年12月31日止,对本组68例宫颈鳞癌患者进行随访,共随访到53例,随访率77.94%,随访时间5~93个月,平均54.8个月。在随访到的53例中死亡14例,3年生存率74.51%(38/51),5年生存率67.44%(29/43)。
1.2 试剂 鼠抗人ezrin单克隆抗体(克隆号3 c12)、鼠抗人CD34单克隆抗体(克隆号QBEND/10)、鼠抗人MIB1单克隆抗体(克隆号 MIB1)、即用型 UltraSensitiveTMSP超敏试剂盒(Cat.No:KIT-9710)及DAB染色剂等购自福州迈新生物技术有限公司。浓缩型兔抗人VEGFR-3多克隆抗体(产品编号ZA-0267,工作浓度1∶100)购自北京中杉金桥生物技术有限公司。
1.3 方法 所有新鲜标本均经4%甲醛溶液固定,48 h内取材,石蜡包埋,连续3~5 μm厚度切片。采用免疫组化SP法检测CIN和宫颈鳞癌组织中ezrin、CD34、VEGFR3和MIB1的表达情况。具体步骤按说明书进行。ezrin、CD34、VEGFR3和MIB1均采用柠檬酸缓冲液高压热力修复抗原,DAB显色。ezrin未进行苏木素复染,CD34、VEGFR3和MIB1进行苏木素复染。用已知阳性片作为阳性对照,用PBS代替第一抗体作为阴性对照。
1.4 结果判断 ezrin表达水平测定:ezrin在细胞浆和(或)细胞膜表达,阳性染色者在细胞浆和(或)细胞膜被染色呈棕黄色。用JD801图像分析系统测定每张切片9个200倍视野ezrin阳性染色区的灰度值和光密度值,以平均光密度值的大小来表示ezrin表达水平的高低。CD34标记的微血管密度(microvessel density,MVD):CD34表达于血管内皮细胞质,呈棕黄色染色,其判断标准及脉管浸润的判断标准参照文献[5]。VEGFR3标记的微淋巴管密度(lymphatic microvessel density,LMVD):VEGFR-3阳性染色主要位于肿瘤边缘及间质微淋巴管内皮细胞质,呈棕黄色染色,可见微淋巴管内皮细胞围成壁薄、形态不规则的管腔结构,内无红细胞。LMVD判断标准参照文献[6]。MIB1标记的增殖指数(proliferation index,PI):MIB1在细胞核表达,阳性染色者细胞核呈棕黄色。在光镜下随机观察具有代表性的10个高倍视野(400),每个视野记数100个肿瘤细胞,计算其阳性标记细胞数即为PI。
1.5 统计学分析 采用SPSS 11.5统计软件包进行分析,定量资料比较采用方差分析及t检验,变量间的关系采用直线相关分析,生存情况采用Kaplan-Meier曲线表示,Log rank检验。检验水准α=0.05,以P<0.05差异有统计学意义。
2 结果
2.1 ezrin在NCE、CIN及SCC组的表达 从NCE到CIN再到SCC组,ezrin表达水平显著升高(P<0.05)。ezrin在NCE组主要表达于上皮细胞膜,在CIN组主要表达于异型细胞质,在SCC组主要弥漫性表达于癌细胞质和(或)细胞膜。ezrin在CINⅠ、Ⅱ、Ⅲ的表达水平分别为(0.0819±0.0153)、(0.0933±0.0107)、(0.1018±0.0159)。ezrin在 CINⅢ的表达水平显著高于CINⅠ(SNK方差分析:CINⅢvs CINⅠ,P<0.05)。ezrin在 NCE、CIN及 SCC组的表达见图 1A、1B及1C。
表1 ezrin在NCE、CIN及SCC组的表达(±s)
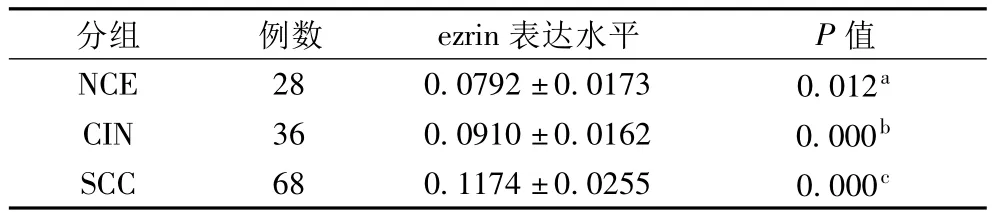
表1 ezrin在NCE、CIN及SCC组的表达(±s)
注:Dunnett`s T3方差分析:a指NCE vs CIN,P=0.012;b指CIN vs SCC,P=0.000;c指 SCC vs NCE,P=0.000
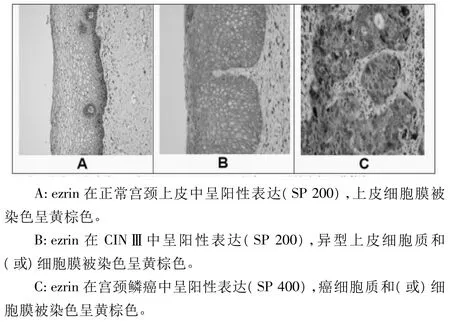
图1 ezrin在NCE、CIN及SCC组表达
2.2 ezrin在CIN及SCC组的表达分别与MVD、LMVD及PI的关系 在NCE、CIN及SCC组,CD34标记的MVD分别为(6.3±2.9)、(18.0±4.7)及(58.2±19.6)条;VEGFR-3标记的LMVD分别为(2.24±3.8)、(6.37±5.7)和(8.3±2.8)条;Ki-67标记的 PI分别为(96.0±54.6)、(300.0±157.1)及(378.7 ±199.6)。从NCE到CIN再到SCC组,MVD、LMVD及PI均显著升高(MVD 组:CIN vs NCE,P=0.000,SCC vs CIN,P=0.000,SCC vs NCE,P=0.000;LMVD 组:CIN vs NCE,P=0.003,SCC vs CIN,P=0.176,SCC vs NCE,P=0.000;PI组:CIN vs NCE,P=0.000,SCC vs CIN,P=0.043,SCC vs NCE,P=0.000)。将ezrin在CIN及SCC组的表达均以中位值为界分为高和低表达两组。在CIN及SCC组,ezrin高表达组MVD、LMVD及PI分别与低表达组相比均无显著性差异(P>0.05)。Pearson相关分析显示,ezrin在CIN和SCC组表达均分别与MVD(CIN组:r=0.059,P=0.735;SCC组:r=0.148,P=0.233)、LMVD(CIN 组:r=0.173,P=0.314;SCC组:r=0.230,P=0.059)及 PI(CIN 组:r=0.160,P=0.359:SCC 组:r=-0.067,P=0.589)无关。CD34、VEGFR3和Ki-67在SCC组表达分别见图2A、2B和2D。

表2 ezrin在CIN和SCC组表达分别与MVD、LMVD及PI的关系
2.3 ezrin在SCC组的表达与临床病理特征的关系 ezrin在SCC组表达与FIGO分期、浸润深度、有否淋巴结转移以及脉管浸润密切相关(P<0.05)。FIGO分期为Ⅱ期、有盆腔淋巴结转移、突破深肌层间质浸润及有脉管浸润者,其ezrin表达显著高于FIGO分期为Ⅰ期、无盆腔淋巴结转移、浸润深度在浅肌层间质以内及无脉管浸润者(P<0.05)(表3)。
表3 ezrin 在SCC组的表达与临床病理特征的关系(±s)
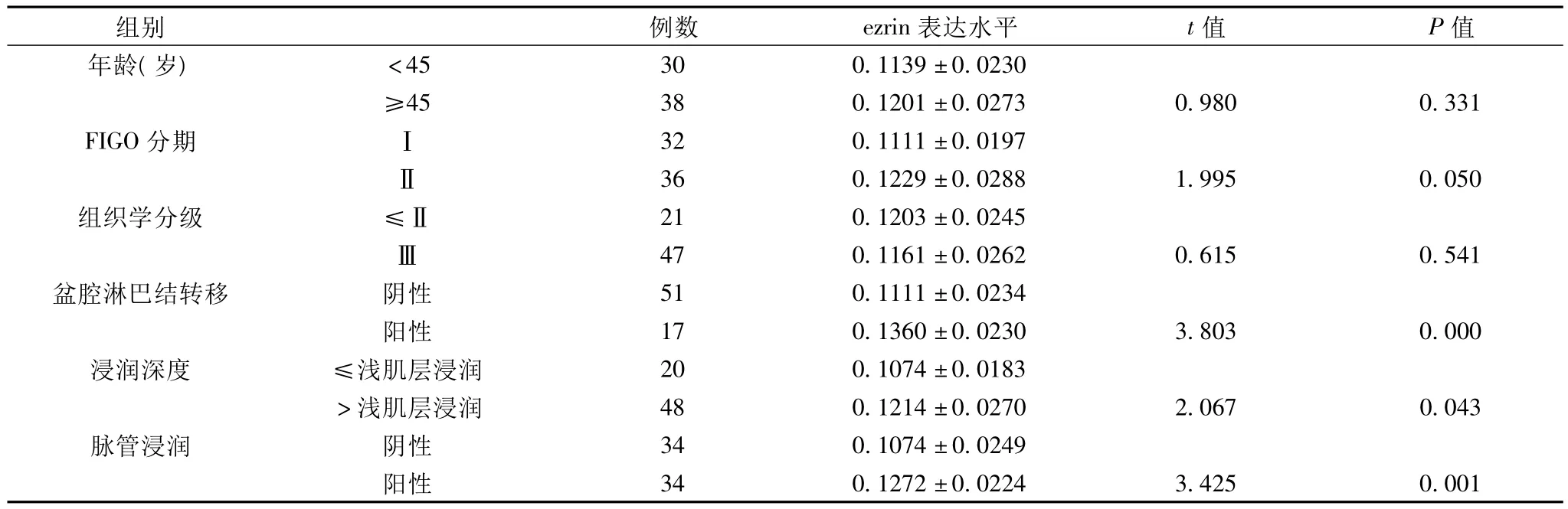
表3 ezrin 在SCC组的表达与临床病理特征的关系(±s)
2.4 ezrin在SCC组的表达与预后的关系 将ezrin在SCC组的表达以中位数为界分为高表达组和低表达组,两组Kaplan-Meier生存曲线见图3。ezrin高表达组患者的生存率明显低于低表达组,但无统计学差异(log rank检验,P=0.0631)。
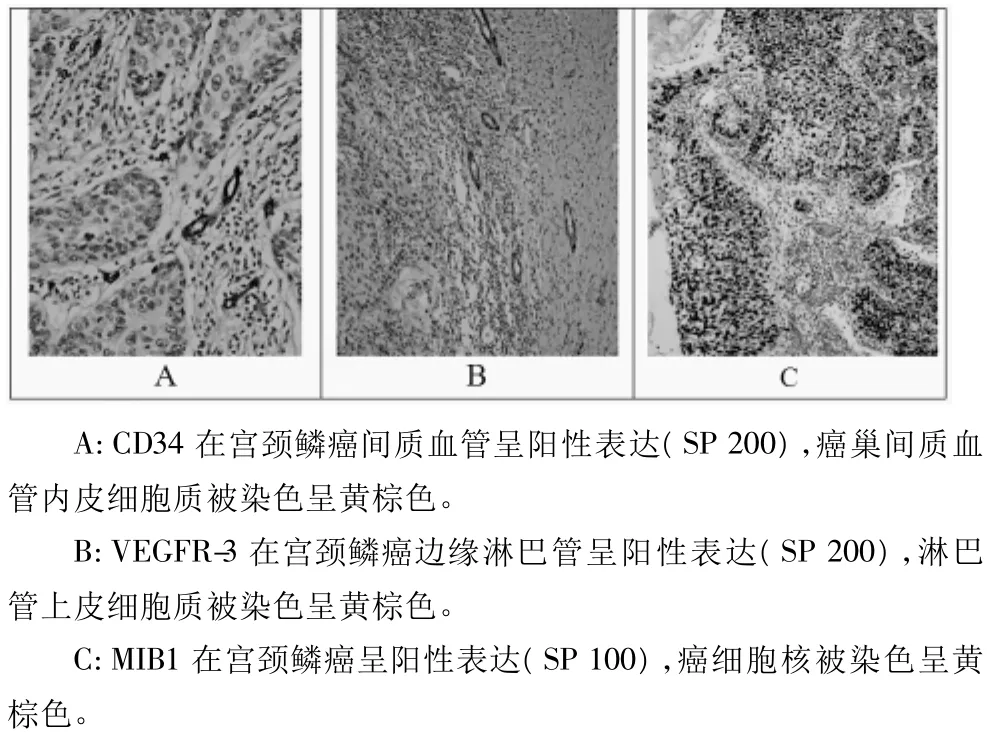
图2 CD34、VEGFR3和MIB-1在宫颈鳞癌的表达
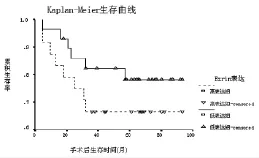
图3 ezrin高表达组和低表达组宫颈鳞癌患者Kaplan-Meier生存曲线
3 讨论
ezrin是一个分子量为82KDa的磷酸化蛋白,由585个氨基酸组成,其编码基因为Villin2(Vil2),定位于6q25.2-6q26。ezrin蛋白N-端与细胞膜结合,C-端与F-肌动蛋白连接,参与亚细胞骨架构建和接触识别,维持细胞膜表面的一些特殊结构如微绒毛、丝状假足、尾足等,在细胞形态调节和细胞运动中发挥重要作用,此外还将膜蛋白如CD44、E-Cadherin等与F-肌动蛋白连接起来[2]。ezrin与膜表面受体分子、粘附分子相互作用,参与细胞信号转导,将各种细胞膜外信号通过ezrin与膜整合蛋白直接连接而传入细胞内[2]。ezrin参与的这些细胞活动与肿瘤的发生发展、浸润转移等密切相关,可能是肿瘤转移的核心蛋白。ezrin与宫颈癌进展及预后的研究国内外少见报道。本研究结果显示,从NCE到CIN再到SCC组,ezrin表达水平显著增强(P<0.05)。在CIN中,ezrin在CINⅢ的表达水平显著高于CINⅠ(P<0.05)。提示宫颈上皮细胞从受损到癌变,ezrin蛋白合成增加。ezrin与肿瘤细胞表面黏附分子CD44及其变异体形成复合物,在肿瘤细胞的浸润转移中有共同表达现象,并参与肿瘤细胞的转移过程。CD44过度表达可引起膜-细胞骨架连接蛋白-ezrin的功能激活[1]。E-cadherin能反向调节CD44活性而抑制其介导的肿瘤转移。E-cadherin丢失或调节功能降低将破坏其下游信号转导,进而促进肿瘤转移扩散。ezrin在E-cadherin的膜定位上起着重要作用,ezrin激活或过度表达使E-cadherin在胞内蓄积而在细胞表面表达减少,使E-cadherin被隔离在细胞内,从而导致细胞与细胞间连接破坏[7]。可见,ezrin过度表达可能导致E-cadherin功能缺失,后者对CD44的降调作用解除而使CD44表达升高,最终引起E-cadherin与CD44功能失衡,从而导致肿瘤细胞侵袭转移能力的增强。故笔者认为,宫颈鳞癌ezrin过度表达可能在其发生发展过程中发挥重要作用。Ohtani等[8]报道,ezrin在正常子宫内膜和增殖症子宫内膜细胞中仅表达于细胞膜,而在非典型增生子宫内膜细胞及子宫内膜癌细胞中表达于细胞浆,认为ezrin不同着色部位对子宫内膜癌病变的性质具有标识作用。本研究结果也显示,ezrin在NCE、CIN和SCC细胞中定位不同,ezrin在NCE组几乎表达于细胞膜上,而在CIN和SCC组异型或癌细胞质内呈弥漫性表达。上述研究提示,随宫颈上皮恶性转化的发生,ezrin蛋白表达上调并出现表达定位改变。可见,ezrin蛋白的表达改变可能与宫颈上皮恶性转化密切相关,但有待于进一步研究证实。
Zhang等[9]发现,ezrin蛋白过表达与肝细胞癌增殖、侵袭和迁移正相关,下调其表达可抑制高转移潜能肝癌细胞系侵袭力。张肖肖等[10]研究发现,ezrin蛋白在胃癌组织中高表达,并与胃癌淋巴结转移正相关。Shen等[11]研究发现,高侵袭性人食管癌细胞株ezrin表达显著高于对照组,且高表达ezrin的SHEEMT细胞在体内更易于侵犯软组织、系膜和胰腺而表现更高的侵袭特性。Khanna等[12]发现高转移能力的小儿骨肉瘤细胞株K7 m2 ezrin表达量是低转移能力的K12的3倍,高转移能力的K7 m2细胞转染反义RNA抑制ezrin表达,能显著阻止肺部转移,而转染ezrin-T567A(相当于失活ezrin)后,肺部转移则完全被阻止。可见,ezrin不但足以导致肿瘤转移,而且对于肿瘤转移是必不可少的。本研究结果显示,ezrin在SCC组表达与FIGO分期、浸润深度、有否淋巴结转移以及脉管浸润密切相关(P≤0.05)。FIGO分期为Ⅱ期、有盆腔淋巴结转移、突破深肌层间质浸润及有脉管浸润者,其ezrin表达显著高于FIGO分期为Ⅰ期、无盆腔淋巴结转移、浸润深度在浅肌层间质以内及无脉管浸润者(P≤0.05)。随FIGO分期增加、间质浸润加深、盆腔淋巴结转移和脉管浸润的发生,宫颈鳞癌组织ezrin表达水平显著升高。张艳廷等[13]报道,ezrin和CD44V6在喉鳞癌中表达升高与组织学分级、TNM分期及淋巴结转移关系密切,联合检测 ezrin和CD44V6表达有助于综合判断喉鳞癌的恶性度和转移潜能。Ohtani等[14]研究发现,ezrin在高转移能力的子宫内膜癌细胞系mEⅡL表达显著高于低转移能力的细胞系Ishikawa,过度表达ezrin的肿瘤细胞穿透基底膜的能力增强,而抑制ezrin表达后的两种细胞系的侵袭能力均下降,穿透基质膜的瘤细胞数量均明显减少,但ezrin表达对癌细胞增殖没有影响。Chuan等[15]研究发现,前列腺癌细胞珠LNCaP-FGC采用siRNA抑制或采用过表达T567A和Y353F-ezrin突变体干扰ezrin表达活性,能显著降低癌细胞穿透基质膜的能力,但不影响癌细胞的增殖能力。本文研究结果显示,宫颈鳞癌ezrin表达与癌细胞增殖指数没有显著相关性(r=-0.067,P=0.589),与 Ohtani等[14]和 Chuan 等[15]的结果一致。ezrin 与肿瘤新生血管生成关系的研究国内外少见报道。有学者报道,Ezrin能抑制内皮细胞扩增和血管生成[16]。笔者发现宫颈鳞癌组织ezrin表达与微血管密度无显著相关性(r=0.148,P=0.233)。ezrin与肿瘤新生淋巴管生成关系的研究国内外未见报道。笔者结果显示,宫颈鳞癌组织ezrin表达与微淋巴管密度无显著相关性(r=0.230,P=0.059)。故笔者认为,ezrin在CIN中表达增强提示癌细胞易于突破基底膜向间质浸润,ezrin在SCC中过度表达显示癌细胞向深部浸润的同时进而突破脉管基底膜浸润淋巴管和血管,最终发生远处转移。在宫颈鳞癌发生发展过程中,ezrin可能不直接参与癌细胞增殖和新生血管淋巴管形成的调节,而直接参与增强癌细胞穿透基底膜,致使肿瘤侵袭转移。
文献报道,多种人体恶性肿瘤ezrin表达上调与患者预后密切相关,ezrin过度表达生存期短、预后差[17-20]。但也有研究认为,恶性肿瘤ezrin表达下调者预后差。Moilanen等[21]报道,浆液性卵巢癌ezrin蛋白表达下调者预后差。绒毛膜癌ezrin蛋白表达降低后侵袭力反而增强[22]。笔者资料可以看出,ezrin高表达组患者的生存率明显低于低表达组,但未达统计学差异(log rank检验,P=0.0631)。故笔者认为,ezrin表达可能具有组织和器官的特异性,其表达水平并非完全与肿瘤转移及预后平行,其在肿瘤转移中的复杂作用有待进一步研究探讨。
[1]Martin TA,Harrison G,Mansel RE,et al.The role of the CD44/ezrin complex in Cancer metastasis. Crit Rev Oncol Hematol,2003,46(2):165-186.
[2]Haedicke J,de Los Santos K,Goff SP,et al.The ezrin-radixinmoesin family member ezrin regulates stable microtubule formation and retroviral infection.J Virol,2008,82(9):4665-4670.
[3]Sizemore S,Cicek M,Sizemore N,et al.Podocalyxin increases the aggressive phenotype of breast and prostate cancer cells in vitro through its interaction with ezrin.Cancer Res,2007,67(13):6183-6191.
[4]乐杰.妇产科学.第7版.北京:人民卫生出版社,2008:261-268.
[5]林岷,江忠清,朱凤川,等.宫颈癌CD44V6表达与局部肿瘤血管生成、癌细胞增殖及浸润转移的关系.福建医科大学学报,2005,39(1):41-44.
[6]林岷,江忠清,连成瑛,等.宫颈鳞状细胞癌局部淋巴管生成与浸润转移及预后的关系.福建医科大学学报,2008,42(2):116-120.
[7]Xu Y,Yu Q.E-cadherin negatively regulates CD44-hyaluronan interaction and CD44-mediated tumor invasion and branching morphogenesis.J Biol Chem,2003,278(10):8661-8668.
[8]Ohtani K,Sakamoto H,Rutherford T,et al.Ezrin,a membranecytoskelet al linking protein,is highly expressed in atypical endometrial hyperplasia and uterine endometrioid adeno-carcinoma.Cancer Lett,2002,179(1):79-86.
[9]Zhang Y,Hu MY,Wu WZ,et al.The membrane-cytoskeleton organizer ezrin is necessary for hepatocellular carcinoma cell growth and invasiveness.J Cancer Res Clin Oncol,2006,132(11):685-697.
[10]张肖肖,武洋,杨君,等.ezrin和c-Met基因编码蛋白表达与胃癌发生和转移的关系和意义.中国肿瘤临床,2009,36(7):404-408.
[11]Shen ZY,Xu LY,Chen MH,et al.Upregulated expression of ezrin and invasive phenotype in malignantly transformed esophageal epithelial cells.World J Gastroenterol,2003,9(6):1182-1186.
[12]Khanna C,Wan X,Bose S,et al.The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis.Nat Med,2004,10(2):182-186.
[13]张艳廷,皇甫辉,田俊.ezrin蛋白和CD44V6在喉鳞癌组织中的表达及临床意义.山西中医学院学报,2009,10(1):50-52.
[14]Ohtani K,Sakamoto H,Rutherford T,et al.Ezrin,a membranecytoskelet al linking protein,is involved in the process of invasion of endometrial cancer cells.Cancer Lett,1999,147(1-2):31-38.
[15]Chuan YC,Pang ST,Cedazo-Minguez A,et al.Androgen induction of prostate cancer cell invasion is mediated by ezrin.J Biol Chem,2006,281(40):29938-29948.
[16]Kishore R,Qin G,Luedemann C,et al.The cytoskelet al protein ezrin regulates EC proliferation and angiogenesis via TNF-alpha-induced transcriptional repression of cyclin A.J Clin Invest,2005,115(7):1785-1796.
[17]Carneiro A,Bendahl PO,Akerman M,et al.Ezrin expression predicts local recurrence and development of metastases in soft tissue sarcomas.J Clin Pathol,2011,64(8):689-694.
[18]Elzagheid A,Korkeila E,Bendardaf R,et al.Intense cytoplasmic ezrin immunoreactivity predicts poor survival in colorectal cancer.Hum Pathol,2008,39(12):1737-1743.
[19]Kobel M,Lanshammer T,Huttelmaier S,et al.Ezrin expression is related to poor prognosis in FIGO stage I endometrioid carcinomas.Mod Pathol,2006,19(4):581-587.
[20]Deng X,Tannehill-Gregg SH,Nadella MV,et al.Parathyroid hormone-related protein and ezrin are up-regulated in human lung cancer bone metastases.Clin Exp Metastasis,2007,24(2):107-119.
[21]Moilanen J,Lassus H,Leminen A,et al.Ezrin immunoreactivity in relation to survival in serous ovarian carcinoma patients.Gynecol Oncol,2003,90(2):273-281.
[22]Karmakar S,Das C.Modulation of ezrin and E-cadherin expression by IL-1 beta and TGF-beta 1 in human trophoblasts.J Reprod Immunol,2004,64(1-2):9-29.
