丛枝菌根真菌与根瘤菌接种对大豆根瘤分布及磷素吸收的影响
2012-11-21丁效东李淑仪
丁效东,张 林,李淑仪,冯 固*
(1中国农业大学资源与环境学院,植物-土壤相互作用教育部重点开放实验室,北京100194;2广东省生态环境与土壤研究所,广东广州510650)
豆科植物根际微生态系统中共同繁衍着大量的丛枝菌根(arbuscular mycorrhizae,AM)真菌和根瘤菌,它们在长期进化过程中与豆科植物形成了AM真菌-豆科植物-根瘤菌三重共生的关系[1-3],这种共生体具有很重要的农业和生态意义[4]。早在高等植物没有出现以前,菌根真菌已与古老的陆生植物形成共生体,在陆地生态系统中扮演着至关重要的角色[5]。与AM真菌相比,根瘤菌(rhizobia)的共生起源要晚得多,约为距今0.65亿年前的白垩纪[6]。根瘤菌是一类广泛分布于土壤中的革兰氏阴性细菌,能与豆科植物形成高度专化的共生关系,侵染豆科植物根部形成根瘤,进而固定空气中的分子态氮形成能被植物利用的有机氮。在磷缺乏土壤中,特别是难溶性磷含量高的土壤,磷的吸收成为固氮豆科作物生长和结瘤固氮过程中一个限制因素[7]。在低磷土壤中,AM真菌通过对土壤中磷营养的吸收,满足根瘤生长和固氮作用对磷的需求[7-8],但是当AM真菌缺乏时将导致大豆根瘤固氮减少,甚至完全被抑制[9]。
在AM真菌-豆科植物-根瘤菌共生体系中,每种微生物活性的改变都会影响另一种微生物的生存和发展[10]。研究表明,根瘤信号(根瘤因子)刺激AM真菌对寄主的侵染[11]。菌根真菌是否直接抑制了部分根瘤的固氮活性而同时又促进了另一部分根瘤的活性?即抑制了一些衰老的根瘤的活性而促进幼小、活性强的根瘤的固氮活性。Ruiz-Lozano等[12]在研究大豆根瘤过早衰老的现象时发现,干旱条件下,同时接种摩西球囊霉(G.mosseae)比单接种大豆慢生根瘤菌(B.japonicum)提高了大豆的结瘤量、植株体内乙炔还原酶的活性、豆血红蛋白和其它蛋白的含量,从而避免了大豆根瘤过早衰老。
到目前为止,AM真菌对根瘤的形成、分布所起的生态作用研究较少。我们提出的问题是,在缺磷条件下,双接种能够提高对氮、磷的吸收,但是是否AM真菌在根瘤的形成以及根瘤在整个根系中的分布中起到重要的生态功能作用。为此,本实验利用沙培试验研究根瘤的形成、分布是否依赖于AM真菌的侵染和调控,以期明确AM真菌与根瘤菌双接种对根瘤数量、分布以及吸磷效率的影响。
1 材料与方法
1.1 供试植物
大豆(Glycine max L.Merr)种子由中国农业大学曲周试验站提供,品种为冀豆6号。种子经10%的H2O2浸泡10 min灭菌,70%乙醇灭菌3~5 min,以无菌水冲洗7~8次。转移至底部铺有灭菌湿纱布托盘中,上部盖一层无菌湿纱布,置于27℃避光催芽,间歇用无菌水冲洗种子(3次/日)以保持湿度。
1.2 接种剂及接种方法
供试根瘤菌(Bradyrhizobium japonicum,简写为BJ)由中国农业大学生物学院根瘤菌分类课题组提供。将供试菌株先接到YMA斜面活化,然后转接于含有培养液的三角瓶中。培养液化学组成(mmol/L):K2HPO42.87、NaCl 1.71、CaSO41.47、MgSO40.81、MnSO46.67 × 10-5、Na2MoO44.88 ×10-5、H3BO31.62 × 10-4、C6H5O7Fe 2.96 × 10-5、CH2OH(CHOH)4CH2OH 27.45、蔗糖14.61、酵母浸膏1 g/L。震荡(转速为200 r/min,28℃)过夜培养至对数期,测其OD600值,计算含菌量(菌数约109个/mL)。接种方法:待大豆种子发芽至3~4 mm时,浸泡于根瘤菌菌液5 min;播种之后,于芽根处将10 mL根瘤菌菌液倒入到根部。在不接种和单接种AM真菌的处理中加入10 mL灭菌(121℃,45 min)的根瘤菌菌液。
供试 AM 真菌[Glomus mosseae(Nicol.&Gerd.)Gerdemann & Trappe,BEG167,简写为 GM]由北京市农林科学院植物营养与资源研究所扩繁。接种剂为含有宿主植株根段和根外菌丝体的砂土混合物,然后通过蔗糖离心获得大量孢子,每盆利用大约1000个孢子在大豆根系周围进行接种。
1.3 试验设计
本试验于2009年在中国农业大学植物营养温室中进行,培养室温度30±3℃白天/24±3℃夜晚,相对湿度为50%~60%。采用石英砂培养,石英砂高压蒸汽灭菌2次,每次121℃高压蒸汽灭菌45 min。盆钵为直径0.20 m、深度为0.15 m的塑料盆,每盆装入石英砂1.5 kg,在盆钵中部加200 g/盆的磷矿粉(产地为云南省,P2O5含量≥30.0%,灭菌2次,每次121℃高压蒸汽灭菌45 min)。
采取完全随机设计,共设4个处理:1)不接种处理(对照,CK);2)单接AM真菌处理(G.mosseae,GM);3)单接根瘤菌处理(B.japonicum,BJ);4)根瘤菌与真菌双接种处理(G.mosseae/B.japonicum,GM/BJ)。每个处理8个重复。
挑选发芽一致的大豆种子播于盛有石英砂的塑料盆中,每盆播种3粒种子,待幼苗长至3 cm时,留1株;大豆发芽后,第1天用1/10的营养液,第2天浇1/5浓度的营养液,然后每天浇全营养液至底部有营养液流出。营养液组成(mmol/L):NH4Cl 1.5、KH2PO40.1、CaCl22.5、K2SO42、MgSO42。铁和其它微量元素含量与完全Hoagland营养液相同。溶液pH用KOH和HCl调至6.5±0.1。为了防止盐分积累,每2 d用去离子水淋洗1次。
1.4 样品采集与测定
植株分2次收获(接种后第28 d和第56 d)。各个处理第28 d收获4个重复,测定根系,地上部,根瘤中的氮、磷含量和主根、结根瘤的侧根,无根瘤的侧根中AM真菌的侵染率;其余4个重复第56 d收获测定生物量,不同部位(根系、地上部、根瘤)中的氮、磷含量和根系中(主根、结根瘤侧根、无根瘤侧根)AM真菌的侵染率、固氮酶活性。
鲜重、干重、根瘤数统计 植株用去离子水冲洗,分为地上、根和根瘤(主根根瘤、侧根根瘤)3部分,用吸水纸吸干表面水分,测定鲜重(FW)、根瘤数。再将部分鲜样放在烘箱中105℃杀青0.5 h,80℃烘干,称干重(DW),然后将植株磨碎。
植株氮、磷分析 植株全磷含量测定:烘干后的地上部植株样品经粉碎,称取0.3 g左右,H2SO4-H2O2法消煮,钒钼黄吸光光度法测定植物全磷含量。植株全氮测定:采用 H2SO4-H2O2凯氏定氮法[13]。
真菌根段侵染率 采用Philipps和Hayman的方法[14]将洗净的大豆主根、侧根(结根瘤、无根瘤)根段分别切成1 cm长,10%KOH溶液浸泡,90℃水浴中12~15 min,冲洗3次后,加入2%(v/v)HCl溶液浸泡5 min,然后直接加入0.05%曲利苯蓝,90℃水浴30 min,水洗。置于盛有乳酸甘油溶液的培养皿脱色。取30条根段制片,在100~400×的显微镜下观察,并“MYCOCALC”软件计算真菌的根段侵染率[15]。
根瘤固氮酶活性 固氮酶活性采用乙炔还原法[16],用气相色谱分析仪测定。将豆科植物植株剪掉地上部分,用去离子水洗净,用吸水纸吸干,将结瘤的根系部分分别剪开,从主根和侧根根瘤直接剥下(0.5 h内采集根瘤),按照成熟度分别选择一系列根瘤,分别取5个根瘤测定根瘤鲜重,每个处理4次重复。装入提前准备好的5 mL的青霉素小瓶中;然后按瓶子中气相体积用注射器从瓶中抽出1 mL的空气,再用注射器注入等体积的C2H2,28℃保温2 h,准确记时并记录;取出瓶子,用注射器吸出100 μL的混合气体,用气相色谱仪以外标法测定其固氮酶活性。乙烯含量气体利用用气相色谱仪[日本岛津公司生产的气相色谱GC-14B(FID)]测定条件如下:柱温80℃,进样口温度100℃,检测器温度150℃,载气流量50 mL/min,氢气流量50 mL/min,空气流量500 mL/min,保存数据并计算。每个处理重复3次。固氮酶活性用单位重量的根瘤在单位时间内还原乙炔,生成乙烯的毫摩尔数来表示,固氮酶活[mmol/(g·h)]=C2H4(mmol)/[鲜瘤重(g)×反应时间(h)],根据气体的摩尔数与体积、温度、压力的关系:C2H4(mmol)=C2H4的体积(mL)/22.4×273/(273+t℃)×P/760。
1.5 数据统计分析
所有数据采用 SASTM软件(SAS Institute Inc.,1989)进行单因素显著性检验。用LSD法在0.05水平进行多重比较。
2 结果与分析
2.1 不同接种处理对植株生长的影响
无论接种后28 d还是56 d,大豆单接种菌根真菌与单独接种根瘤菌相比,根系和地上部生物量(DW)都没有显著性差异(表1)。可是,与单独接种AM真菌或根瘤菌相比,双接种显著提高了根系和地上部生物量(P<0.05)。单独接种菌根真菌或根瘤菌的植株根系和地上部生物量高于不接种处理(对照)(表1)。结果表明,AM真菌与根瘤菌的互作对植株生长起到促进作用。
2.2 不同接种处理对根瘤生长及分布的影响
在2次收获时,与单独接种根瘤菌相比,双接种处理显著增加了主根根瘤的数目(图1A)。接种28 d时,单独接种根瘤菌与双接种处理相比,侧根根瘤数量没有显著性差异。可是,接种56 d时,双接种处理侧根根瘤数量显著高于单独接种根瘤菌根瘤数量(图1A)。2次收获时双接种处理各个直径根瘤数量都显著高于单独接种根瘤菌时对应直径的根瘤数量(图1A)。

表1 菌根真菌与根瘤菌不同接种处理对大豆生长的影响Table 1 Effects of G.mosseae and/or B.japonicum inoculations on soybean biomass at 28thand 56thday after inoculation
菌根真菌接种与单独接种根瘤菌相比,并没有增加主根上根瘤的生物量;相反,双接种处理时侧根根瘤生物量显著高于单独接种根瘤菌处理时,而且在接种处理56 d时显著高于接种28 d收获时(图1B)。
另外,无论是接种28 d还是接种56 d,单独接种根瘤菌处理时侧根根瘤数量占总根瘤数量的比例与主根根瘤数量所占比例没有显著性差异。双接种处理28 d时,侧根中根瘤数量所占比例总是低于主根所占比例,可是,接种56 d时正好相反。在单独接种根瘤菌时,无论接种28 d还是接种56 d,主根根瘤生物量所占总生物量比例与侧根根瘤生物量所占总生物量比例没有显著差异。双接种处理时侧根上根瘤生物量所占总生物量比例高于主根上根瘤生物量所占总生物量比例(图1C)。

图1 菌根真菌与根瘤菌不同接种处理对大豆根瘤数量和大小分布、生物量以及在根系中比例的影响Fig.1 Effects of the inoculations on numbers and distribution between 5 diameter classes,biomass and proportion of nodules in the taproots and lateral roots of soybeans at 28thand 56thday after inoculation
2.3 不同接种处理对根瘤固氮酶活性的影响
接种28 d时,单接种根瘤菌时侧根根瘤的固氮酶活性显著低于主根根瘤的固氮酶活性,但是双接种处理时主根与侧根的根瘤固氮酶活性没有显著差异(图2)。接种56 d时,单接种根瘤菌处理的侧根根瘤的固氮酶活性与主根根瘤的固氮酶活性没有显著差异,但是双接种处理中主根根瘤固氮酶活性显著低于侧根根瘤固氮酶活性。接种28 d和56 d时,双接种处理的主根和侧根的根瘤固氮酶活性均高于单接种处理的根瘤固氮酶(图2)。

图2 接种处理对大豆根瘤固氮酶活性的影响Fig.2 Effects of the inoculations on nitrogenase activity of soybean
2.4 不同接种处理对根系的菌根侵染率的影响
通过显微镜观察,无论是单接种AM真菌还是双接种处理,所有处理的根瘤都没有被AM真菌侵染;而根系侵染率在接种56 d时(开花期)高于28 d时(三叶期)的根系侵染率(P<0.05);无论是28 d还是56 d,单独接种菌根真菌或双接种处理时,大豆侧根根系侵染率显著高于主根根系侵染率(P<0.05)(图3)。单独接种菌根真菌与双接种处理,2次收获时主根侵染率没有显著性差异。但是双接种处理在接种56 d时,结根瘤侧根的侵染率显著高于无根瘤侧根侵染率。
2.5 不同接种处理对根瘤植株或根瘤氮、磷吸收的影响
无论是接种28 d还是56 d,地上部氮含量表现为:双接种>单独接种根瘤菌>单独接种菌根真菌>对照(表2)。根系氮浓度顺序表现为双接种>单独接种(根瘤菌处理或菌根真菌处理)>对照,单独接种根瘤菌和单独接种菌根真菌之间根系氮浓度没有显著性差异。
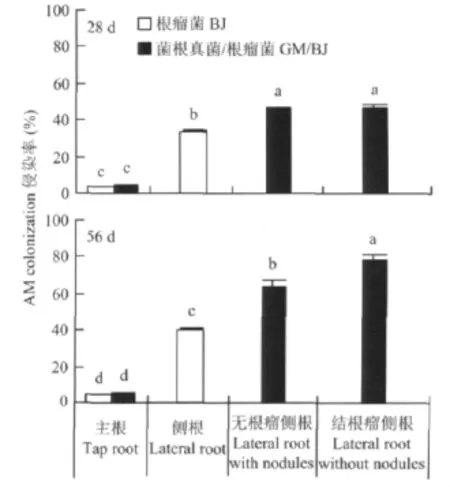
图3 接种处理对大豆不同根系侵染率的影响Fig.3 Effects of the inoculations on root AM colonization of soybean seedlings
相对于对照处理,2次收获时单独接种根瘤菌或没有显著提高地上部磷含量。接种处理28 d时,根系磷浓度趋势是双接种>单独接种菌根真菌>单独接种根瘤菌>对照;接种处理56 d时,双接种处理与单独接种菌根真菌处理间根系磷浓度没有显著差异(表2)。
单接种根瘤菌或菌根真菌相比,无论是接种后28 d还是56 d,双接种处理显著提高了植株中氮、磷的含量。接种后28 d,单独接种菌根真菌处理的植株磷的吸收效率显著高于双接种处理,而56 d时趋势相反(表3)。
3 讨论
从AM真菌和根瘤菌对宿主植物根的识别、侵入、在植物根内定殖并形成可交换营养的界面[17],到诱导植物根发生形态和生理上的变化[18],最终与植物建立共生关系,都离不开植物根系分泌的信号分子的诱导。本研究发现,根瘤菌与AM真菌双接种能够提高侧根数,增加侧根上根瘤数目,增强侧根根瘤的固氮能力以及提高结根瘤的侧根AM真菌侵染率,但是主根根瘤固氮活性与单接种根瘤菌接种处理相比没有显著差异。对侧根根瘤来说,在同一条侧根上,根瘤活性在接种后56 d内(开花期)随着根瘤发育程度增加,根瘤活性增加(图2)。通过显微镜观察,发现双接种中所有根瘤均没有被AM真菌侵染,但是结根瘤的侧根AM真菌侵染率最高,侧根中根瘤数与该侧根AM真菌的侵染具有正相关性
(图1A,图3)。这表明双接种时AM真菌侵染增强根瘤菌在寄主植物侧根的定殖、根瘤的发育和固氮能力。这说明同一侧根根内的AM真菌侵染与根瘤菌侵染固氮之间存在着关系:AM真菌提供给植物根瘤固氮作用所需的磷素,提高植株的固氮能力,同时植株固氮为AM真菌提供良好的氮素营养,提高植株结根瘤的侧根中AM真菌侵染率。研究发现,AM真菌比植物体本身的氮浓度高3.7倍[19],这说明AM真菌对氮营养有较高需求,AM真菌可能被根瘤中较高浓度的氮营养所吸引[3]。

表2 菌根真菌与根瘤菌不同接种处理对大豆根系、地上部、根瘤中氮和磷浓度的影响(mg/g,DW)Table 2 Effects of G.mosseae and/or B.japonicum inoculations on N and P concentration in shoots,roots and root nodules of soybeans at 28thand 56thday after inoculation

表3 菌根真菌与根瘤菌不同接种处理对大豆氮、磷含量及磷吸收效率的影响Table 3 Effects of G.mosseae and/or B.japonicum inoculations on N and P contents,and P uptake efficiency of soybeans at 28thand 56thday after inoculation
豆科植物通常通过增加根瘤数量来适应缺磷胁迫[9],根瘤数量的增加扩大与土壤接触面积[20]。在低磷土壤中,AM真菌的缺乏将导致大豆根瘤固氮减少,甚至完全被抑制[9]。研究表明,根瘤信号(类黄酮类物质)刺激AM真菌对寄主的侵染[11],根瘤菌也能够促进AM真菌的侵染,促进丛枝的形成[21]。共生体的形成对植物来说是有益的,但是它也是一个耗能量的过程。许多研究发现,AM真菌和根瘤菌对寄主中有限光合产物存在竞争关系[22],一种共生体的形成会影响另一种共生体的建立[10]。本试验结果表明,双接种时侧根有更多根瘤的形成,这显然是由于AM真菌的存在所诱导的,不仅是根瘤数量,而且根瘤固氮酶活性与根瘤生物量都有提高。以前的研究认为,根瘤固氮酶活性及根系中磷含量与AM真菌的侵染率有正相关关系[23]。根瘤固氮酶活性提高,根瘤生物量有增加的趋势[24],而且AM真菌的侵染也增加了侵染植物的可溶性糖浓度[25]。因此,侧根中较高的根瘤生物量和固氮酶活性可能是由于AM真菌的侵染导致的。根系具有较高的AM真菌的侵染时AM真菌提供根系更多的磷,诱导更多的碳水化合物从地上部转运到根系的AM真菌侵染的部位,进而供给根瘤生长所需。根瘤的存在促进了侧根的形成,进而为AM真菌的侵染提供新的目标[26]。结根瘤的侧根提高了共生体的氮营养,随即刺激了菌根真菌的侵染和丛枝的形成[21]。另一种可能性是,侧根中菌根生长和丛枝形成的紧密相关过程依赖于碳的有效性[27]。以前的证据支持了我们的假说,因为根瘤有相对高的磷需求[7-8],AM 真菌提供更多的磷营养给结根瘤的侧根。
4 结论
菌根真菌的存在,显著提高了大豆根系侧根上根瘤数量,增强了其固氮能力,而且提高了植株在生殖生长期的磷素吸收效率。结根瘤的侧根中菌根侵染率显著提高,表明根瘤数量、分布与AMF的侵染存在正相关关系。
[1]Sprent J I.Nodulation in Legumes[M].London,UK:Royal Botanic Gardens,Kew Publishing,2001.
[2]Lodwig E,Hosie A Bourdes A,Findlay K et al.Amino-acid cycling drives nitrogen fixation in the legume-Rhizobium symbiosis[J].Nature,2003,422(6933):722-726.
[3]Scheublin T,van der Heijden M.Arbuscular mycorrhizal fungi colonize nonfixing root nodules of several legume species[J].New Phytol.,2006,172(4):732-738.
[4]Cullimore J,Dénarié J.How legumes select their sweet talking symbionts[J].Science,2003,302(5645):575-578.
[5]Franken P,Requena N.Analysis of gene expression in arbuscular mycorrhizas:New approaches and challenges[J].New Phytol.,2001,150:517-523.
[6]Lum M R,Hirsch A M.Roots and their symbiotic microbes:Strategies to obtain nitrogen and phosphorus in a nutrient-limiting environment[J].J.Plant Growth Regul.,2003,21:368-382.
[7]Almeida J. Evidence that P deficiency induces N feedback regulation of symbiotic N2fixation in white clover(Trifolium repens L.)[J].J.Exp.Bot.,2000,51(348):1289-1297.
[8]Sa T,Israel D.Energy status and functioning of phosphorusdeficient soybean nodules[J].Plant Physiol.,1991,97(3):928-935.
[9]Asimi S, Gianinazzi-Pearson V, Gianinazzi S. Influence of increasing soil phosphorus levels on interactions between vesiculararbuscular mycorrhizae and Rhizobium in soybeans[J].Can.J.Plant Sci.,1980,58(20):2200-2205.
[10]Catford J,Staehelin C,Lerat S,Piché Y et al.Suppression of arbuscular mycorrhizal colonization and nodulation in split-root systems of alfalfa after pre-inoculation and treatment with Nod factors[J].J.Exp.Bot.,2003,54(386):1481-1487.
[11]Xie Z,Staehelin C,Vierheilig H,Wiemken A et al.Rhizobial nodulation factors stimulate mycorrhizal colonization of nodulating and nonnodulating soybeans[J].Plant Physiol.,1995,108(4):1519-1525.
[12]Ruiz-Lozano J M,Collados C,Barea J M,Azcón R.Arbuscular mycorrhizalsymbiosiscan alleviate drought-induced nodule senescence in soybean plants[J].New Phytol.,2001,151(2):493-502.
[13]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.Bao S D.Soil analysis in agricultural chemistry[M].Beijing:China Agriculture Press,2000.
[14]Phillips J,Hayman D.Improved procedures for clearing roots and staining parasitic and vesicu lar-arbuscular mycorrhizal fungi for rapid assessment of infection[J].Trans.Br.Mycol.Soc.,1970,55,158-161.
[15]Giovannetti M,Mosse B.An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots[J].New Phytol.,1980,84:489-500.
[16]Hardy R,Holsten R,Jackson E,Burns R.The acetyleneethylene assay for N2fixation:Laboratory and field evaluation[J].Plant Physiol.,1968,43:1185-1207.
[17]Lum M,Hirsch A.Roots and their symbiotic microbes:strategies to obtain nitrogen and phosphorus in a nutrient-limiting environment[J].J.Plant Growth Regul.,2003,21(4):368-382.
[18]Yuichi D,Mari B,Yoshikazu S,Svetlana A et al.Transcriptome profiling of Lotus japonicus roots during arbuscular mycorrhiza development and comparison with that of nodulation[J].DNA Res.,2007,14:117-133.
[19]Schulze J,Temple G,Temple S J et al.Nitrogen fixation by white lupin under phosphorus deficiency[J].Ann.Bot.,2006,98(4):731-740.
[20]RibetJ, Drevon J. Phosphorus deficiency increases the acetylene-induced decline in nitrogenase activity in soybean[Glycine max(L.)Merr.][J].J.Exp.Bot.,1995,46(10):1479-1486.
[21]Staehelin C,Charon C,Boller T et al.Medicago truncatula plants overexpressing the early nodulin gene enod40 exhibit accelerated mycorrhizal colonization and enhanced formation of arbuscules[J].Proc.Nat.Acad.Sci.USA,2001,98(26):15366-15371.
[22]Bethlenfalvay G, Bayne H, Pacovsky R. Parasitic and mutualistic associationsbetween a mycorrhizalfungus and soybean:The effect of phosphorus on host plant-endophyte interactions[J].Physiol.Plant.,1983,57(4):543-548.
[23]Bethlenfalvay G,Brown M,Stafford A.The glycine-glomusrhizobium symbiosis: Ⅱ. Antagonistic effectsbetween mycorrhizal colonization and nodulation [J].Plant Physiol.,1985,79(4):1054-1058.
[24]Wolyn D,Attewell J,Ludden P et al.Indirect measures of N2fixation in common bean(Phaseolus vulgaris L.)under field conditions:The role of lateral root nodules [J].Plant Soil,1989,113(2):181-187.
[25]Feng G,Zhang F,Li X,Tan C et al.Improved tolerance of maize plants to salt stress by arbuscular mycorrhiza is related to higher accumulation of soluble sugars in roots[J].Mycorrhiza,2002,12(4):185-190.
[26]Olah B,Briere C,Becard G et al.Nod factors and a diffusible factor from arbuscular mycorrhizal fungi stimulate lateral root formation in Medicago truncatula via the DMI1/DMI2 signalling pathway[J].Plant J.,2005,44(2):195-207.
[27]Smith S, ReadD.Mycorrhizal symbiosis[M]. London:Academic Press,1997.
