不同氮素水平对甜菜硝酸还原酶和亚硝酸还原酶活性的影响
2012-11-21杜永成王玉波范文婷盖志佳于敦爽张俐俐马凤鸣
杜永成,王玉波,范文婷,盖志佳,于敦爽,谷 维,张俐俐,马凤鸣*
(1东北农业大学农学院,黑龙江哈尔滨150030;2黑龙江省农业科学院作物营养实用技术研究所,黑龙江哈尔滨150086)
NO3-在植物体内先还原成NH4+,最后才能转化为植物体可直接利用的有机物谷氨酰胺[1]。目前已知,由NO3-还原成NH4+这一代谢过程需要由硝酸还原酶(nitrate reductase,NR)和亚硝酸还原酶(nitrite reductase,NiR)参与完成。而NR及NiR与光合都有着极为密切的联系,NR是一种光诱导酶,并且硝酸还原反应的进行需要NADH提供还原力[2-3],而 NADH 正是由光反应产生的 NADPH 转换而来;NiR则是直接需要光反应中产生的铁氧还蛋白(Fd)才能进行还原反应[4],将NO2-还原成NH4+。前人对 NR 进行了大量细致的研究[5-11],但是对NiR的研究鲜有报道。
由于NR在植物体内的生成受硝态氮的诱导,而NR与NiR在氮代谢中以偶联调节的形式对氮代谢进行调节,因此本试验以甜菜品种KWS0143为材料,通过施用不同硝态氮水平对甜菜体内NR活力、NiR活力、叶绿素总含量以及生育期内光合速率的动态变化进行研究,对硝态氮与NR活力、NiR活力、叶绿素总含量及光合速率间关系进行分析,从而进一步探索甜菜的氮代谢过程。
1 材料与方法
1.1 试验设计
试验于2009~2010年在东北农业大学科研实习基地进行,土壤类型为黑土,耕层土壤基础肥力为:有机质含量26.4 g/kg、全氮1.55 g/kg、全磷0.348 g/kg、缓效钾888 mg/kg、碱解氮189.2 mg/kg、速效磷28.9 mg/kg、速效钾272 mg/kg、pH 6.47。
试验设 0、60、120、180 kg/hm24个氮素水平,分别以N0、N60、N120、N180表示。供试肥料为硝酸钙(含N 13%),以基肥的形式一次施用。采用框栽栽培方式(框深0.5 m),框区内规格为行长8 m、行距0.7 m、株距0.23 m,5行区,面积为28 m2。5次重复,随机区组排列。
供试甜菜品种为KWS0143。试验于4月20日人工播种,10月2日收获,管理同大田。
1.2 测定指标及方法
从长出第6片真叶时(6月6日)开始取样,每隔15 d左右在晴朗天气的上午8:00~10:00,每处理随机取三株,对其完全展开的功能叶片进行光合速率的测定,然后将植株整株出土放入冷藏箱带回实验室。叶片部分取样方法为自内向外选取完全展开的功能叶数片,去叶脉剪碎混匀用以测定叶绿素含量及酶活性。块根部分取样方法为将块根切成小片混匀用以测定酶活性。
光合速率的测定:采用Photosynthesis System CI-310(CID.inc U.S.A)。仪器初始设定为 Open System(开放叶室),Single(单次测量),叶室面积6.5 cm2,设定流量为0.4 L/min,反应时间10 s。于光合稳定时进行3次测定,取平均值。每株甜菜测定2片叶,每处理测定3株,取平均值。
叶绿素(a+b)总含量的测定按郝再彬等[12]的方法。加80%丙酮提取,于波长663 nm、645 nm下测定光密度值并代入公式计算。叶绿素总含量Ct=8.05 A663+20.29 A645,其中,Ct为叶绿素浓度,以μg/mL表示。
硝酸还原酶(NR)活性的测定:参照于海彬等[13]的方法,分别测定内源与外源基质条件下的甜菜叶片NR活力,即enNRA与exNRA。NR活性用NO2-μg/(g·h),FW表示。
亚硝酸还原酶(NiR)活性的测定:参照Rajasekhar等[14]和 Kenjirou 等[15]的方法,略有改动。NiR活性用NO2-μg/(g·h),FW表示。
含糖率的测定:将取样器由根颈和根头部交界处依45°角方向插入根内取样,样品置于压榨钳中压出汁液,用折光法进行测定[16]。
1.3 数据分析
数据采用DPS 7.05系统进行统计分析。
2 结果与分析
2.1 光合速率、叶绿素总含量、NR和NiR活性的动态变化
2.1.1 甜菜叶片光合速率的动态变化 甜菜叶片光合速率呈单峰曲线变化,峰值在块根增长初期(8月7日)。不同处理的叶片光合速率变化趋势基本一致。N0处理的光合速率在各取样时期均最低。在同一取样时期,4个处理表现为N180≈N120>N60>N0(图1)。

2.1.2 甜菜叶片中叶绿素总含量的动态变化 在幼苗期,甜菜叶片叶绿素总含量较高,随后下降,至叶丛形成初期(7月8日)升至最高水平其后缓慢下降(图2)。这可能是因为幼苗期(6月6日)甜菜叶片新生,所以有较高的叶绿素含量;在叶丛形成期,叶片形态建成,以增大单位面积光合能力为主,所以叶绿素含量最高;甜菜叶片的旺盛生长(7月)结束后,生长中心逐渐下移,同时叶片开始出现衰老,新生叶片少于衰老叶片,导致叶绿素含量逐渐下降。不同处理的叶片叶绿素总含量变化趋势基本一致。在同一取样时期,各处理间叶绿素含量差异较大,其中N0处理的含量在整个取样时期均最低。
2.1.3 甜菜叶片中NR活性的动态变化 NR活性在整个生育期间呈双峰曲线变化(图3)。6月上旬(苗期)出现第一个NR活性高峰,此时幼苗6片真叶完全展开,之后酶活性下降,7月上旬降至最低,在7月下旬(叶丛形成末期或块根增长初期)出现第二个NR活性高峰,随后NR活性又下降,在9月中旬(糖分积累期)又出现一个微弱的高峰。在生育期间出现两次NR高峰,此结果与李文华[17]的试验结果相一致。这两个时期正是氮素的代谢旺盛期,在苗期,根系分化,地上部也在迅速进行器官建成,需要较高的NR活性促进NO-3吸收和转化,用来提供较多的氨基酸、蛋白质供器官建成;叶丛形成期,甜菜正处于生育盛期,叶丛形成与块根增长相重叠,生长中心开始由叶部转至根部,功能叶片NR活性的适当高值并协同氮代谢的其它酶,既为形成繁茂叶丛,又为块根增大提供结构蛋白。此后,9月中旬的微弱高峰可能是由于老叶枯死,新叶刚刚长出的缘故。
内源、外源基质条件下甜菜叶片NR活性的变化趋势基本上一致,在苗期活性最高,叶丛形成末期出现第二个高峰,峰值远小于苗期。各生育时期,外源基质NR(exNR)活性均高于内源基质NR(enNR)活性,二者的差值在苗期大于甜菜生育后期。在同一取样时期,各氮水平间NR活性差异较大,各生育时期均为高氮处理的酶活性大于低氮处理的酶活性。enNR活性反映的是甜菜营养生长的生物学特性,即为甜菜叶片对氮素的真实还原速率,而exNR活性反映的是叶片对NO-3的可利用强度和植株细胞代谢库中NO-3的状况,即叶片对氮素的还原潜力,实际上是间接地反映了甜菜叶片内NR酶量的多少。以上结论可以说明,在甜菜生育前期,NR的还原潜力远远高于生育后期。

图3 不同氮素水平下内源、外源基质条件下甜菜叶片NR活性的变化Fig.3 Dynamics of NR(enNR、exNR)activities of sugar beet leaves under different nitrogen levels
2.1.4 甜菜叶片和块根中NiR活性的动态变化 甜菜叶片中NiR活性在整个生育期间基本呈“M”型曲线变化(图4),幼苗期活性较低,6月22日(苗期)出现第一个NiR活性高峰,随后酶活性开始下降,在7月份(叶丛形成期)酶活性持续最低,在8月7日NiR活性出现第二个高峰,峰值较第一个峰值稍有降低,随后9月上旬(糖分积累期)NiR活性缓慢下降,在9月下旬酶活性又稍有回升,幅度较小。在生育前期地上部生长较快,氮素代射旺盛,而较多的结构蛋白和酶蛋白完成光合器官的建成,较高的酶活性有利于氮素的吸收和转化,促进叶丛生长;生育后期,酶活性显著减弱,对氮素吸收减少,氮代谢维持在较低水平,有利于蔗糖的合成和积累。同NR相似,不同氮水平处理的叶片NiR活性具有一致的变化趋势。在同一取样时期,氮水平之间NiRA差异较大,各生育时期叶片酶活性均表现为高氮处理大于低氮处理,且无氮处理的酶活性最低。
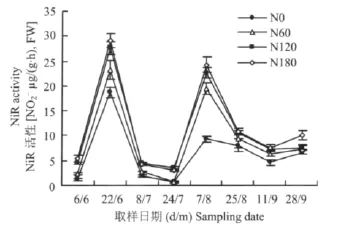
图4 甜菜叶片NiR活性的动态变化Fig.4 Dynamics of NiR activities in sugar beet leaves
苗期块根中NiR活性最低,几乎测不到酶活力,整个生育期间呈双峰曲线变化(图5)。块根NiR酶活性从苗期开始逐渐升高,至块根增长初期(8月7日)出现第一个高峰,这与叶片中NiR活性变化同步,随后酶活性下降,直至8月25日最低,在9月中旬有一个小回升。各生育时期内,块根NiR活性均低于叶片NiR活性,二者的差值在苗期大于甜菜生育后期。根中两个NiR活性高峰皆在生育后期(块根增长期和糖分积累期),这主要是由于生育后期根是甜菜的生长中心,根中氮代谢旺盛。
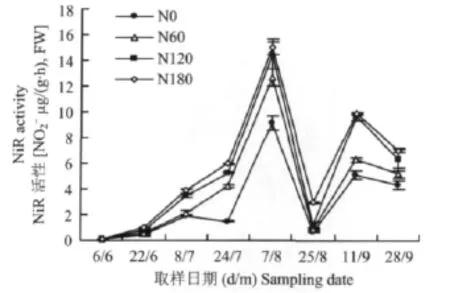
图5 甜菜块根NiR活性的动态变化Fig.5 Dynamics of NiR activities in sugar beet roots
2.2 氮素水平对甜菜产量、含糖率及产糖量的影响
由表1知,甜菜产量随施氮水平的增加而提高,N180水平时产量最高,达到63.94 t/hm2;含糖率则正好相反,随施氮水平的增加而降低,N0处理的含糖率最高,为17.01%;由于产量的极显著提高伴随着含糖率的显著降低,所以N120水平的产糖量最高,为9567.94 kg/hm2。 因此,在农业生产中,考虑成本以及经济效益,适宜的施氮量极为重要。产量及产糖量的结果也符合光合速率的变化规律(图1),高氮水平下的高光合速率为产量的提高提供了条件。本研究中产量、含糖率以及产糖量随氮水平的变化规律与马凤鸣和高继国[18]的研究结果基本一致。
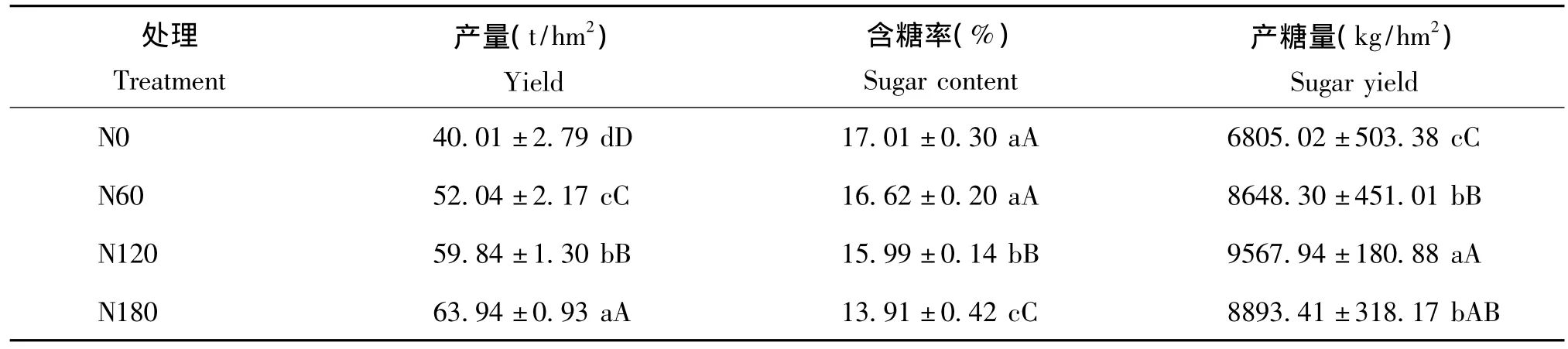
表1 氮肥对甜菜产量、含糖率以及产糖量的影响Table 1 Effects of the nitrogen fertilization on yield,sugar content and sugar yield of sugar beet
2.3 氮素与叶绿素含量、NR活性、NiR活性的相关关系
相关性分析结果(表2)表明,氮素与叶绿素总含量、NR活性、NiR活性皆表现为正相关关系,NRA和NiRA在各时期均表现为显著正相关关系。氮素与叶绿素总含量在生育后期表现为极显著正相关,主要是由于生育后期叶片开始走向衰老,叶绿素逐渐降解,而氮素能够一定程度地延缓功能叶片衰老,减慢叶绿素降解过程,此结果与黄兆峰等[19]的研究结论一致。由于NR、NiR是诱导酶,所以氮素与两种酶活性在全生育期都表现出显著正相关或极显著正相关关系。
2.4 叶绿素含量与酶活性的相关关系
相关性分析结果(表3)表明,叶绿素总含量与叶片NR、NiR酶活性和块根NiR酶活性均表现为正相关关系,叶丛形成初期相关极显著(P<0.01),生育后期相关达显著或极显著水平。叶丛形成末期和块根形成初期相关系数明显变小。
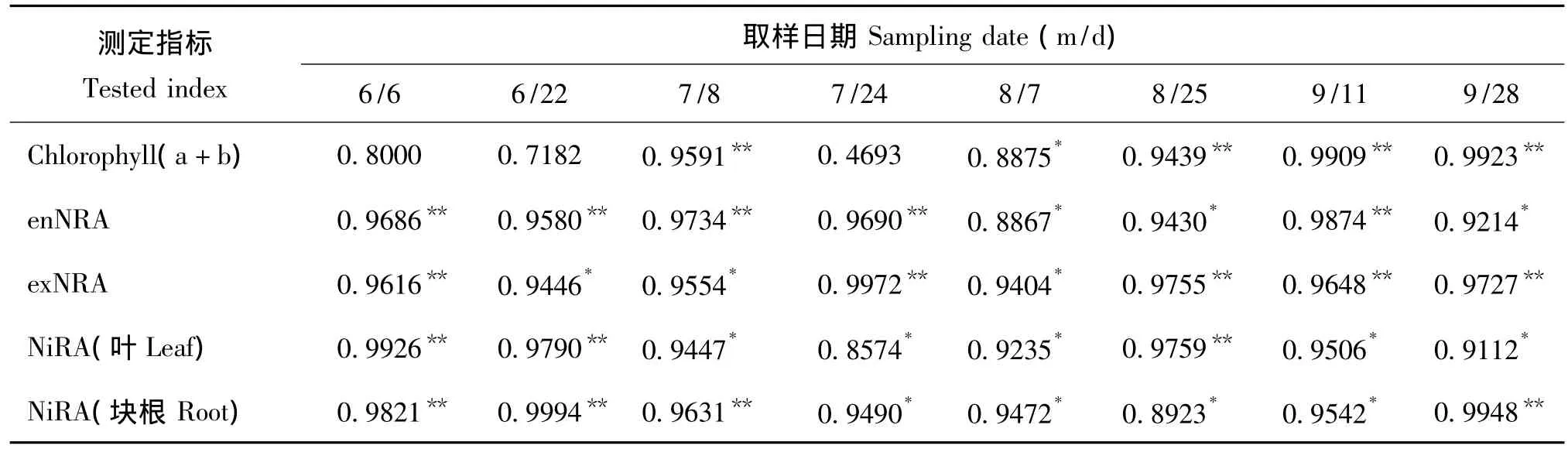
表2 不同生育时期施氮量与测定指标的相关分析Table 2 Correlation analysis between different N levels and the tested indexes at different growth periods

表3 不同生育时期叶绿素总含量与酶活性的相关分析Table 3 Correlation analysis between total content of chlorophyll(a+b)and different enzyme activities in sugar beet at different growth periods
3 讨论
植物的光合作用受多种因素如土壤水分、光照、温度、植物本身的生理状况等综合因素的影响。本试验是在其他影响基本一致的条件下,研究了氮素水平与叶片光合速率、叶片叶绿素总含量、NRA以及NiRA的关系。
硝态氮对于叶绿素总含量、硝酸还原酶活性(NRA)、亚硝酸还原酶活性(NiRA)皆有促进作用。本试验中叶绿素总含量在N0到N120水平内,叶绿素总含量随施氮量的增加而提高,但是N180处理下叶绿素总含量与N120处理时基本一致,这与曲文章等[20]的研究结果有一定区别,可能是由于品种差异,叶绿素总含量在氮素水平120 kg/hm2已经达到单位鲜重的最大量。而两种酶的活性则是随着氮水平的增加而升高,表现为 N180>N120>N60>N0。NR活性随着硝态氮水平的增加而提高,这与前人在甜菜[6]及小麦[21]中的研究相一致。试验结果可以看出,叶中NiR活性高峰滞后NR活性一个时期,这与氮代谢的过程一致,首先,硝态氮被硝酸还原酶还原成亚硝态氮,然后亚硝态氮激活亚硝酸还原酶或刺激亚硝酸还原酶表达,将亚硝态氮还原成铵。
甜菜光合速率在N120和N180处理下变化较小,此结果与于海彬[22]的研究一致。可能是甜菜的光合速率主要决定因素在于品种,品种决定了其最大极限,氮素调控只能使作物尽可能发挥出潜力;或者是试验过程中的光强度不足导致光合受限。光合速率变化趋势与叶绿素及酶活性的变化趋势有差异,可能是植株光合产生的还原力远远大于单一酶代谢所需,正因此才有富余能量进行干物质积累,因此光合速率的起伏对酶活性没有明显影响;也可能是本试验中用光合速率代表光合能力做光合与NR、NiR活性关系相关研究不是很适合,试验中所用测定方法是以单位时间、单位叶面积CO2的吸收量间接表示光合能力,但是酶活性的主要相关因素是还原力,光合反应中生成的还原力如何分配,有多少提供给NR、NiR进行氮代谢并不清楚。因此,可以用叶绿素荧光测定仪测定光反应阶段的光合情况,进一步研究光合与NR和NiR的关系。
将叶绿素总含量的动态规律与NR活性的动态规律进行比较发现,两者皆为双峰曲线,但是叶绿素的含量高峰早于NR活性高峰,可能是因为NR需要叶绿素进行光合产生还原力,所以叶绿素以及光合系统的建成高峰先于氮素同化的高峰。叶绿素与酶活性的相关性分析虽然呈现正相关,但显著或极显著时期较少,可能是由于NR和NiR虽然需要光合提供还原力,但是光合速率的影响因素较多,而且还要考虑呼吸消耗以及其他的能量转化。叶片NiR活性与叶绿素的相关性较好,可能是由于NiR的还原力是Fd,而Fd直接产生于光反应,两者之间的反应过程直接相连。
4 结论
光合速率呈单峰曲线变化,NR、NiR活性及叶绿素总含量基本呈双峰曲线变化。不同施氮量对甜菜光合速率、叶绿素总含量、硝酸还原酶及亚硝酸还原酶活性的影响不同。氮肥施用量在120 kg/hm2时显著提高了甜菜光合速率、叶绿素总含量、NR和NiR活性。与氮肥施用量为120 kg/hm2相比,在180 kg/hm2时光合速率及叶绿素总含量没有明显变化,NR和NiR活性则有一定的提高。叶绿素总含量与NR和NiR活性在生育中后期表现为显著或极显著正相关关系。本试验条件下,施氮量为180 kg/hm2时获得甜菜产量的最高值63.94 t/hm2,不施氮时获得含糖率的最高值17.01%,施氮量120 kg/hm2时获得产糖量的最高值9567.94 kg/hm2。
[1]潘瑞炽.植物生理学(第五版)[M].北京:高等教育出版社,2004.45-48.Pan R C.Plant physiology(5th Edn.)[M].Beijing:Higher Education Press,2004.45-48.
[2]田华,段美洋,王兰.植物硝酸还原酶功能的研究进展[J].中国农学通报,2009,25(10):96-99.Tian H,Duan M Y,Wang L.Research progress on nitrate reductase functions in plants[J].Chin.Agric.Sci.Bull.,2009,25(10):96-99.
[3]洪华生,王玉珏,王大志.海洋浮游植物硝酸还原酶研究进展[J].海洋科学,2007,31(10):4-10.Hong H S,Wang Y Y,Wang D Z.Study on process of nitrate reductase(NR)in marine phyton-plankton[J].Mar.Sci.,2007,31(10):4-10.
[4]May S K,顾立江,程红梅.植物中硝酸还原酶和亚硝酸还原酶的作用[J].生物技术进展,2011,1(3):159-164.May S K,Gu L J,Cheng H M.The role of nitrate reductase and nitrite reductase in plant[J].Cur.Biotechnol.,2011,1(3):159-164.
[5]陈志英.甜菜氮素同化与蔗糖代谢机理研究及人工调控[D].哈尔滨:东北农业大学博士学位论文,2008.Chen Z Y.Study on the mechanism and regulation of nitrogen assimilation and sucrose metabolism of sugar beet[D].Harbin:PhD dissertation,Northeast Agricultural University,2008.
[6]李彩凤,马凤鸣,赵越,李文华.氮素形态对甜菜氮糖代谢关键酶活性及相关产物的影响[J].作物学报,2003,29(1):128-132.Li C F,Ma F M,Zhao Y,Li W X.Effects of nitrogen forms on key enzyme activities and related products in sugar and nitrogen metabolism of sugar beet(Beta vulgaris L.)[J].Acta Agron.Sin.,2003,29(1):128-132.
[7]刘淑云,董树亭,赵秉强,等.长期施肥对夏玉米叶片氮代谢关键酶活性的影响[J].作物学报,2007,33(2):278-283.Liu S Y,Dong S T,Zhao B Q et al.Effects of long-term fertilization on activities of key enzymes related to nitrogen metabolism(ENM)of maize leaf[J].Acta Agron.Sin.,2007,33(2):278-283.
[8]张杰,屈红军,任静,等.甜菜硝酸还原酶全长基因的克隆及其在缺氮胁迫下表达与活性分析[J].黑龙江大学自然科学学报,2008,25(5):614-620.Zhang J,Qu H J,Ren J et al.Cloning of full-length gene of nitrate reductase and analysis on mRNA expression activity under N-absent stress condition in sugar beet(Beta vulgaris L.)[J].J.Nat.Sci.Heilongjiang Univ.,2008,25(5):614-620.
[9]越鹏.甜菜叶片衰老超微结构变化及氮对光合特性调控与Rubisco抗体制备[D].哈尔滨:东北农业大学硕士学位论文,2010.Yue P.Change of ultrastructure and nitrogen regulation on photosynthesisofsugarbeetleaves (Beta Vulgaris L.)senescence, rubisco antibody preparation[D]. Harbin:Ms thesis,Northeast Agricultural University,2010.
[10]陈龙正,梁亮,徐海,等.小白菜光合性能与硝酸还原酶活性关系的研究[J].西北植物学报,2009,29(11):2256-2260.Chen Z L,Liang L,Xu H et al.Relationship of photosynthetic characters and nitrate reductase activity of pakchoi[J].Acta Bot.Bor.-Occid.Sin.,2009,29(11):2256-2260.
[11]刘燕.黄瓜嫁接苗对NO-3胁迫的生理响应[D].泰安:山东农业大学硕士学位论文,2010.Liu Y.The physiological response of cucumber grafted seedlings tostress[D].Tai’an:Ms thesis,Shandong Agricultural University,2010.
[12]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.46-49.Hao Z B,Cang J,Xu Z.Plant physiology experiments[M].Harbin:Harbin Institute of Technology Press,2004.46-49.
[13]于海彬,蔡葆,孙国琴,等.甜菜硝酸还原酶活性研究[J].中国甜菜,1993,(3):18-23.Yu H B,Cai B,Sun G Q et al.Studies on nitrate reductase activity in sugar beet[J].Chin.Sug.Beet,1993,(3):18-23.
[14]Rajasekhar V K,Mohr H.Appearance of nitrite reductase in cotyledons of the mustard(Sinapis alba L.)seedling as affected by nitrate,phytochrome and photooxidative damage of plastids[J].Planta,1986,168:369-376.
[15]Ozawa K,Kawahigashi H.Positional cloning of the nitrite reductase gene associated with good growth and regeneration ability of calli and establishment of a new selection system for Agrobacterium mediated transformation in rice(Oryza sativa L.)[J].Plant Sci.,2006,170:384-393.
[16]邵金旺,蔡葆,张家骅.甜菜生理学[M].北京:农业出版社,1991.181-196.Shao J W,Cai B,Zhang J H.Sugar beet physiology[M].Beijing:Agriculture Press,1991.181-196.
[17]李文华.氮素水平和形态对甜菜(Beta Vulgaris L.)形态建成和氮素同化的影响[D].哈尔滨:东北农业大学博士学位论文,2002.Li W H.The effete of nitrogen levels and form on nitrogen assimilation and morphogenesis of sugar beet(Beta Vulgaris L.)[D].Harbin: PhD dissertation, Northeast Agricultural University,2002.
[18]马凤鸣,高继国.硝酸还原酶活力作为甜菜氮素营养诊断及预测产糖量指标的研究[J].中国农业科学,1996,29(5):16-22.Ma F M,Gao J G.Studies on nitrate reductase activity as indices of nitrogen nutrition diagnosis and sugar yield prediction in sugar beet[J].Sci.Agric.Sin.,1996,29(5):16-22.
[19]黄兆峰.氮素水平对甜菜叶片衰老调控的研究[D].哈尔滨:东北农业大学硕士学位论文,2009.Huang Z F.Study on regulating leaves senescence with nitrogen levels in sugar beet(Beta Vulgaris L.)[D].Harbin:Ms thesis,Northeast Agricultural University,2009.
[20]曲文章,蔡伯岩,高妙真.氮素水平对甜菜光合效率的影响[J].中国甜菜糖业,1999,(4):1-4.Qu W Z,Cai B Y,Gao M Z.The affection of nitrogen amount to photosynthetic efficient in the sugar beet plant[J].Chin.Beet Sug.,1999,(4):1-4.
[21]肖凯,张淑华,邹定辉.不同形态氮素营养对小麦光合特性的影响[J].作物学报,2000,26(1):53-58.Xiao K,Zhang S H,Zou D H.The effect of different nitrogen nutrition forms photosynthetic characteristics in wheat leaves[J].Acta Agron.Sin.,2000,26(1):53-58.
[22]于海彬,周芹,刘娜,等.不同氮磷营养水平对甜菜叶片光合速率的影响[J].中国糖料,2001,(3):19-21.Yu H B,Zhou Q,Liu N et al.Effect on the photosynthetic rate of sugar beet blade with different level of N,P applied[J].Sug.Crops Chin.,2001,(3):19-21.
