奶牛隐性乳房炎检测方法的比较研究
2012-11-20张广斌山东畜牧兽医职业学院山东潍坊261061
张广斌 (山东畜牧兽医职业学院 山东 潍坊 261061)
奶牛隐性乳房炎检测方法的比较研究
张广斌 (山东畜牧兽医职业学院 山东 潍坊 261061)
本研究首先通过对选定奶牛场的隐性乳房炎的检测,用目前广泛用于奶牛隐性乳房炎检测的LMT法、体细胞计数法、电导率检测法、pH测定等方法进行比较,结果表明,在注意固定外界条件的前提下,四种方法检测结果差异不显著(P>0.05),其中LMT法操作更方便,因而可以作为对奶牛隐性乳房炎进行流行病学调查的实际检测方法。
隐性乳房炎 检测方法 比较
奶牛隐性乳房炎发病率高,无明显的临床症状,隐蔽性较强,看不到乳汁和乳房变化,因此常被人忽视。但乳汁的生物化学、乳汁成分已发生变化,产奶量下降,奶品质降低。其最大的危害是随着病情的发展,会发展成临床型乳房炎。因此,如能做到早发现就可尽早采取必要措施,控制病情的发展,把损失减少到最小程度。因而,隐性乳房炎的早期、快速、简便可靠的诊断方法就显得非常重要。
目前,已建立了用于奶牛隐性乳房炎早期快速诊断的多种方法,包括电导率值检验法、pH值检测法、乳中体细胞直接记数法(以下简称SCC)和加州乳房炎检测法(以下简称LMT)等。本研究对选定奶牛场的乳样用不同检测方法进行检测,通过比较筛选流行病学调查的最佳检测方法。
1 材料和方法
1.1 试验材料
1.1.1 试验奶牛山东潍坊某奶牛场,共存栏200头奶牛,选取非临床型乳房炎的泌乳期健康牛130头试验用。
1.1.2 实验仪器CON-2A数字电导率计(深圳产)、Nucleo Counter体细胞计数器(意大利ChemoMetec公司生产)、PHS-3CD型酸度计(深圳产)。
1.1.3 隐性乳房炎诊断试剂 LMT诊断液,中国农科院兰州畜牧与兽药研究所生产。
1.2 试验方法
1.2.1 检测方法 (1)乳样采集:挤奶前用40℃左右0.02%~0.03%高锰酸钾温水溶液消毒手指,毛巾消毒后拧干备用。后用消毒湿毛巾擦拭乳头和乳房。按摩乳房,将挤出的头2~3把奶弃掉。用消毒灭菌后的三角瓶或试管,每个乳区取10ml混合后分两份,各40ml左右,一份做pH值、电导率的测定,另一份送往实验室做直接体细胞计数。(2)LMT检测:用诊断盘分别接取4个乳区的乳汁,每个乳区取3~4ml,倾斜诊断盘到一个角度(约45°),倒出多余的乳汁,使每个乳杯内剩余乳汁2ml左右;用定量移液管在每个乳杯内加入诊断液2ml,将诊断盘水平旋转摇动,使乳汁与诊断液充分混合,30s内根据凝集反应程度进行判定,并以颜色反应作为参考,具体判定方法见表1。奶牛各乳区均为“-”或“±”的为LMT阴性牛,其他则为阳性牛。诊断盘经清水冲洗后再进行第2头检测。根据判定标准记录结果。(3)电导率测定:每头奶牛用4只50ml塑料烧杯,分别取4个乳头的乳汁各约30ml,插入数显温度计和铂黑电极(数显温度计和电导率仪操作方法按仪器说明书使用),记录温度计的温度和该温度下电导率值与表2进行对照,确定4个乳头是否患有隐性乳房炎。凡判定为可疑的牛奶次日进行重复检测,若测得结果为阳性则记为阳性。(4)pH检测:用酸度计对4个乳区乳样进行测定,凡pH值大于6.8者判为隐性乳房炎阳性。(5)直接体细胞计数:根据仪器使用说明对样品进行处理并用体细胞计数器进行检测。判定标准:乳中体细胞超过50万个/ml,即判定奶牛隐性乳房炎阳性[10]。

表1 奶牛隐性乳房炎LMT判定标准
注:分娩后1周内或泌乳后期的母牛都会出现强阳性反应,即初乳期和泌乳末期乳中体细胞数均出现生理性升高,故该法不适于检查初乳期和泌乳末期的乳样。
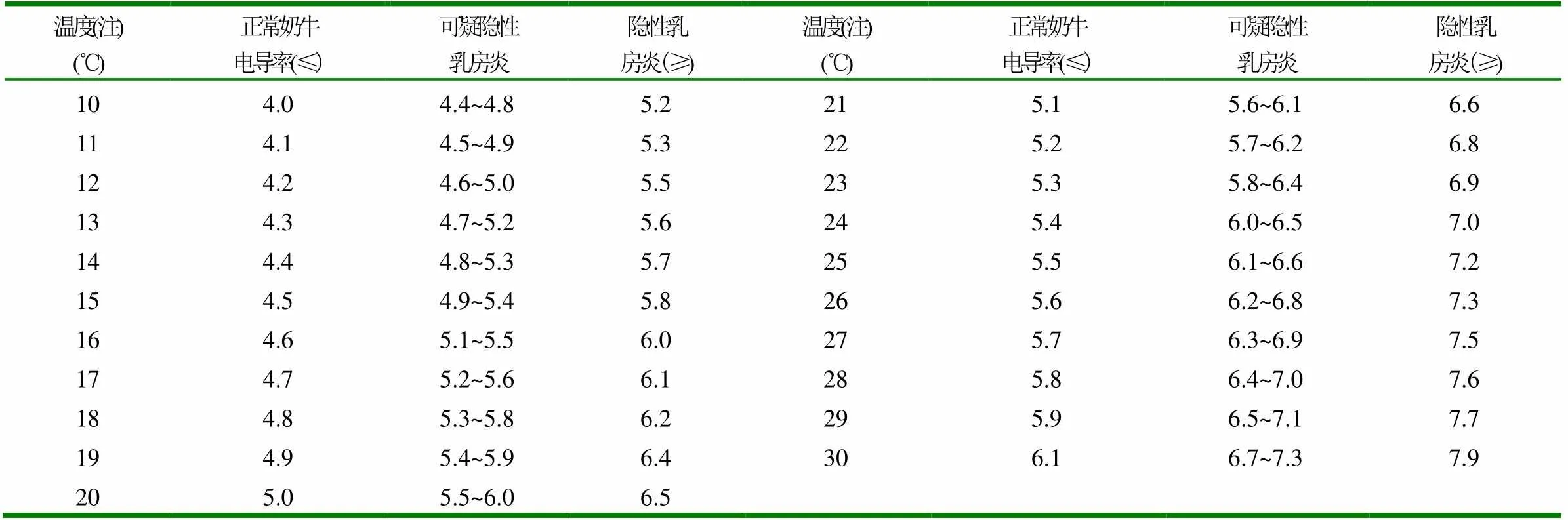
表2 电导率法判定奶牛隐性乳房炎标准 (ms/cm)
注:温度上限是30℃,因样品少,37℃乳样很快就降到30℃以下;下限10℃已满足,在冬天可能低于0℃。但还是建议在10~30℃范围内测定。
2 试验结果
2.1 检测结果
通过对所检奶牛场进行的隐性乳房炎检测,其结果见表3。
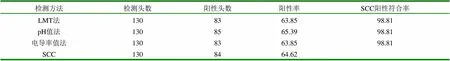
表3 LMT法、pH值法、电导率值法和SCC检测结果 (%)
2.2 统计分析
试验数据统计表明,LMT法、pH检测法、电导率值测定法检测结果与SCC检测结果差异均不显著(P>0.05)。LMT法、pH检测法、电导率值测定法检测结果与SCC检测结果符合率均为98.81%。
3 讨论
(1)本研究通过用体细胞计数法、LMT法、pH检测法、电导率值测定法四种常用方法对所选牛场进行检测的结果表明,在注意固定外界条件的前提下,四种方法检测结果无显著差异。但是由于检测手段不统一,判定标准不完全一致,检测人员的主观性等原因导致检测结果出现不同。郑浩等应用上海乳房炎检测法(SMT)检测了南京某奶牛场88头奶牛,以体细胞计数(SCC)作为隐性乳房炎判定基准,计算检测结果与不同诊断阈值检测结果的相符率,结果表明,以30万个/ml为诊断阈值,检测结果与诊断结果的相符率最高[26]。欧阳五庆等用BMT与SCC的乳区阳性符合率为97.67%[27]。(2)对奶牛隐性乳房炎的发病率进行较大范围的流行病学调查,需选择一种既准确,又简单方便、快速的检测方法,比较四种方法:体细胞直接镜检计数法需要对乳样进行涂片的制备、染色和油镜检查,检测必须在有条件的实验室中进行,体细胞计数器价格比较昂贵。pH值检测法可用酸度计或者用特制的试纸进行,但检测结果可能会受到外界环境温度、以及奶牛生产胎次等因素的影响,而出现较大误差。电导率检测法,除需要特定的仪器外,检测结果也易受外界温度等因素影响较大,不同时间、不同条件的检测结果会出现较大的误差。LMT检测法,结果误差较小,且较为方便快速,是进行流行病学调查的良好方法。
[1] 吴润, 郝保青, 农向等. 奶牛隐性乳房炎的主要病原菌的PCR鉴定[J]. 中国牛业科学, 2006, 32(2): 12-16.
[2] 扬章平, 王健等. 奶牛隐性乳房炎的发病规律的研究[J]. 中国奶牛, 1998 (1):18-21.
[3] 陈北亨, 王建辰. 兽医产科学[M]. 北京: 中国农业出版社, 2000.
[4] 董德宽, 陆静等. 关于牛乳中的体细胞[J]. 乳业科学与技术, 2002, 100(3):18-23.
[5] 董德宽, 王文光. 乳牛高效生产技术手册[M]. 上海: 上海科学技术出版社, 2004.
[6] 肖定汉. 奶牛病学[M]. 北京: 中国农业大学出版社, 2002, 205-239.
[7] 刘文进, 陈创夫, 张银国等. 隐性乳房炎患牛乳汁pH值变化与体细胞数关系的研究[J]. 畜牧与兽医, 2005, 37(3): 9-11.
[8] 吴国娟, 蒋林树. 无公害奶牛养殖技术与疾病防治[M]. 北京: 中国农业科学技术出版社, 2002: 93-95.
[9] 李力.简介几种奶牛隐性乳房炎快速诊断方法[J]. 宁夏农林科技, 2005(2): 21-22.
[10] 唐淑珍, 李永鹏. 利用体细胞记数监控奶牛乳房炎[J]. 奶牛保健, 1999(4): 45-46.
[11]] 田雨泽, 窦红, 姚金良等. DHI(奶牛牛群改良)技术与应用[J]. 中国奶牛, 2004(4): 33-35.
[12] 庆麦玉. 加拿大的DHI评价[J]. 畜牧兽医杂志, 1996, 15(1): 49-50
[13] 沈美英, 孙海洲, 卢德勋等. 利用CMT法评判乳中体细胞数及奶牛乳房炎[J]. 畜牧与饲料科学, 2005(2): 48-49.
[14] 朱平民, 陈惠珍, 蒋次升. 奶牛乳房炎诊断液(LMT)的研制[J]. 浙江农业大学学报, 1984, 10(3): 261-284.
[15] 袁永隆, 张永欣, 侯新昭等. 奶牛乳房炎乳汁细菌的分离和鉴定程序[J]. 中国兽医科技, 1991, 2.
[16] 郝建国, 梁淑萍. 日本学者对体细胞数与乳房炎关系的论述[J]. 中国奶牛, 2002(1): 52 -54.
[17] Marcus E. Kehrli, J R. Facter affecting milk somatic cells and their role in health of the bovine mammary gland[J]. DairySci, 1994, 77:619-627.
[18]Alan L Kelly. Effect of decreased milking frequency of cow sinlatelacatation on milk somatic cell count, polmy orphonuclear leucocytrnumbers, composition and prote olyticactivity[J]. Dairy Sci, 1998, 65:365-373.
[19] Yde Haas, H. W. Barkemaetal.Theeffect of pathogen specific clinical mastitis on the lactation curve for somatic cell count [J], Dairy Sci, 2001, 85:1314 -1323.
[20] R J Harmon. Physiology of mastitis and factors affecting somatic cell count [J]. Dairy Sci, 1994, 77:2103 -2112.
[21] A J Schepers, T J G M Lam. Estimation of variance component for omatic cell count to determine threshold for unifection quarter [J]. Dairy Sci, 1997, 80:1833-1840.
[22] G E Shook. Selection on somatic cells core to improve resistance to mastitis in the Unite States [J]. Dairy Sci, 1994.77:648-658.
[23] L M Berning and G E Shook. Prediction of mastitis using milk somatic cell count, N Acetyl β D Glucosaminidase, and lacose [J]. Dairy Sci, 1992, 75:1840-1848.
[24] Little, R.B. Plastridge, W.N Borine: Mastitis (Asymposinm) Lsted (see.Impression). Newyorkand London. 1946: 504.
[25] Little, R B Plastridge, W N Borine. Mastitis (Asymposinm) Lsted (see. Impression). Newyorkand London.1946, 504.
[26] 郑浩, 高飞, 徐晔等. 应用上海乳房炎检测法检测奶牛隐性乳房炎[J]. 畜牧与兽医, 2006, 38(1): 47-48.
[27] 欧阳五庆, 唐光武, 席文平等. 牛羊隐性乳房炎快速诊断法研究[J]. 黑龙江畜牧兽医, 1995, (5): 12-14.
(2012–04–17)
S823..9+1
A
1007-1733(2012)08-0006-03
