应用激流式生物反应器大规模悬浮培养昆虫细胞(sf9)的工艺研究
2012-11-20赵立民蒋天华罗乃杰广东温氏食品集团有限公司研究院广东新兴527400
赵立民 蒋天华 罗乃杰 (广东温氏食品集团有限公司研究院 广东 新兴 527400)
应用激流式生物反应器大规模悬浮培养昆虫细胞(sf9)的工艺研究
赵立民 蒋天华 罗乃杰 (广东温氏食品集团有限公司研究院 广东 新兴 527400)
应用激流式生物反应器对大规模悬浮培养sf 9细胞的工艺进行了研究,通过摸索细胞接种密度、溶解氧(DO)、反应器转速3项工艺参数,成功实现了sf 9细胞的大规模悬浮培养,细胞密度最高可达到0.8~1.5×106/ml,生长状态良好。
激流式生物反应器 sf 9细胞 接种密度 DO 转速
sf 9细胞由G.E. Smith和C.L. Cherry在1983年从细胞株IPLB-SF 21 AE得来的一个克隆,是目前国际上常用的细胞株之一,可作为猪圆环病毒(PCV)等多种病毒的宿主细胞,用于生产兽用疫苗,也可用于昆虫细胞/杆状病毒表达系统,制备各种农业杀虫剂等,用途广泛[1]。相比哺乳动物细胞,昆虫细胞对生长环境要求苛刻,所需培养液营养丰富,添加的血清须是高质量的胎牛血清[2]。细胞本身娇弱,对剪切力敏感,较难以反应器发酵的方式进行大规模培养。激流式生物反应器是目前国内新兴的一次性生物反应器,具有剪切力小、控制精准、操作简单、规模易放大等特点。本文采用该反应器,通过对相关工艺参数的摸索,进行了sf 9细胞大规模悬浮培养工艺的实验研究。
1 材料和方法
1.1 材料
1.1.1 细胞系 sf 9昆虫细胞,购自武汉生物所,100~150代。
1.1.2 细胞培养液 Grace干粉培养基(Gibco),每升添加0.35gNaHCO3、1.3g水解乳蛋白、3g酵母提取物,用Millipore超纯水溶解,稀HCl调节pH至6.2后,0.22mm滤芯除菌过滤;使用时添加10%热灭活胎牛血清(Hyclone)。
1.1.3 检测试剂 葡萄糖检测试剂盒(南京建成)
1.1.4 主要设备 激流式生物反应器(AP20型,杭州安普生物工程有限公司),细胞计数仪(Count Start),紫外分光光度计(国产美谱达)。
1.1.5 其他 压缩空气、CO2。
1.2 方法
激流式反应器可以通过自动控制方式调节各项培养参数,让细胞的生长环境始终处于一种稳定状态,与平板静态培养的主要区别在于反应器转速、DO、接种密度等的不同。sf 9细胞的平板培养工艺较为成熟,其确定的某些常规参数可直接应用于反应器,如培养温度28℃,pH6.2[3]。现在需要摸索分析的是接种密度、反应器转速、DO3项工艺参数。
反应器悬浮培养sf 9细胞的主要流程为:调好反应器的各项参数,将摇瓶中处于对数生长期,状态良好的sf 9细胞应用细胞计数仪计数,计算接种量后,无菌接种至反应器内,初始培养体积为1L。细胞接种后每隔24h取样1次,进行细胞计数,观察细胞状态,测定葡萄糖含量,并根据样品的检测结果补加新鲜培养基,直至总培养体积5L为止。
1.2.1 细胞接种密度梯度试验 将细胞接种密度分为低密度(0.2×105cells/ml)、中密度(1.0×105cells/ml)、高密度(5.0×105cells/ml)三个梯度,其他工艺参数设置为培养温度28℃,pH6.2,转速40rpm,DO60%,进行sf 9细胞的反应器大规模培养,观察在不同细胞接种密度情况下的细胞生长情况。
1.2.2 转速梯度实验 将转速分为低转速(30rpm)、中转速(50rpm)、高转速(80rpm)三个梯度,其他工艺参数设置为培养温度28℃,pH6.2,DO50%,细胞接种密度1.0× 105cells/ml,进行sf 9细胞的反应器大规模培养,观察在设置不同转速情况下的细胞生长情况。
1.2.3 DO梯度实验 将DO分为低DO(30%)、中DO (60%)、高DO(90%)三个梯度,其他工艺参数设置为培养温度28℃,pH6.2,转速50rpm,细胞接种密度1.0×105cells/ml,进行sf 9细胞的反应器大规模培养,观察在设置不同DO情况下的细胞生长情况。
2 结果
2.1 细胞接种密度梯度 如图1,在低密度接种情况下,细胞生长缓慢,尤其在细胞生长前期。在高密度接种情况下,生长前期增殖迅速,但随后生长速度趋缓。在中密度接种情况下,细胞也能较快的进入对数生长期,而且曲线平稳,在生长后期甚至可超过高密度接种,细胞状态良好。考虑到细胞种准备工作等因素,确定中密度接种参数较优。
2.2 反应器转速梯度 如图2,在低转速条件下,整个培养流程中细胞生长数量均低于其他两种方式,后期取样镜检有较多细胞粘连现象。在高转速条件下,细胞前期生长情况正常,但是中后期的生长速度明显低于中转速,并且取样的培养液中细胞碎片较多。中转速条件下细胞生长速度正常,镜检状态良好,确定中转速参数较优。
2.3 DO梯度 如图3,在3种梯度DO的条件下,细胞生长情况正常,曲线走向基本一致,无明显的变化。
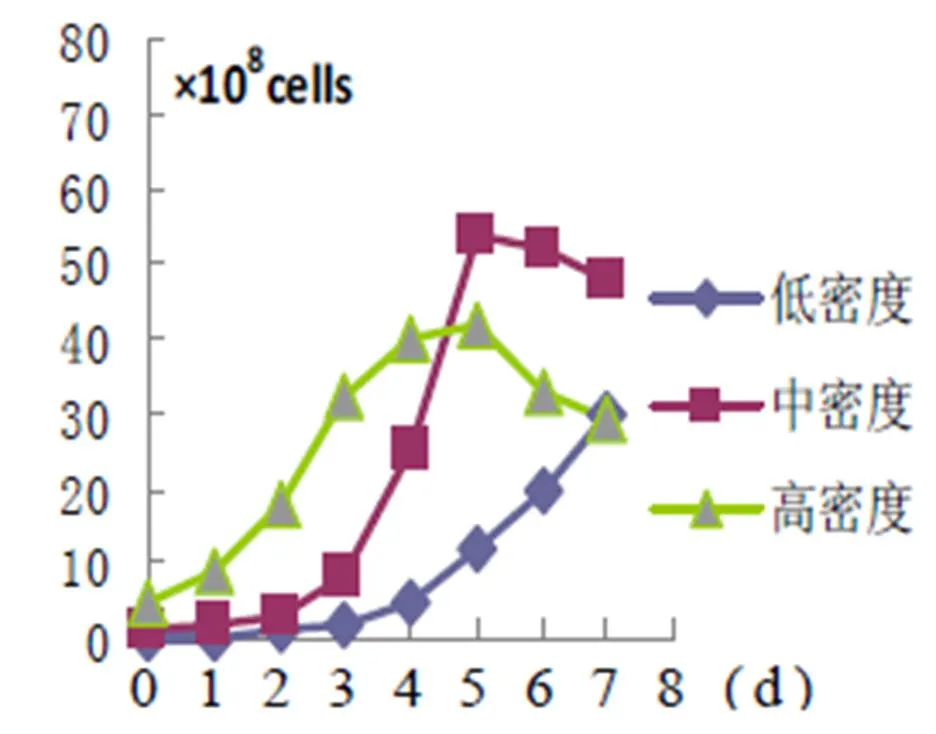
图1
图2
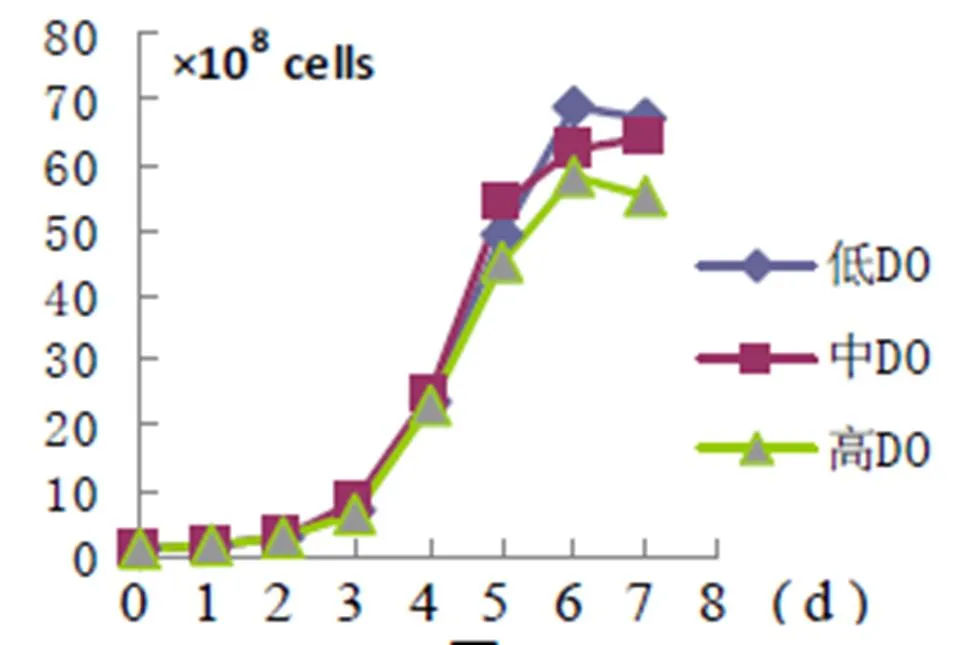
图3
(注:上述3图中,纵轴表示反应器内的细胞总量,单位(×108 cells),横轴为培养天数,单位d)
3 讨论
3.1 密度与生长关系 细胞有群体生长优势的特点,不断分泌有益于本身的物质,如促生长因子等,营造对本身生长的有利环境。所以,细胞接种密度的高低,将直接影响进入对数生长期的时间。有文献报道,sf 9细胞的平板接种密度若低于104cells /ml,细胞甚至不会正常生长[3]。细胞在分泌有益物质的同时,还会排泄有害的代谢产物,如氨、乳酸等[4]。这些代谢产物的不断积累,对细胞的生长会产生消极影响。所以细胞高密度接种的最终效果不一定能够达到最优。
3.2 转速与细胞增殖 激流式生物反应器没有搅拌桨,运行时以整体摇动的方式带动其内部的培养液摇动,从而达到混和、溶氧的效果。该种混合方式剪切力相应降低,溶氧效率更高。Sf 9细胞的个体体积较大,本身脆弱,易受剪切力的影响。从图3中可以看出,在高转速条件下,早期由于细胞密度较低,高转速产生的高剪切力只对少量的细胞产生不利影响,细胞生长尚正常,但随着细胞的不断增殖,高剪切力的破坏力也越大。另外高转速产生的培养液泡沫更多,其破裂产生的表面张力对细胞也有很大的破坏力。在两方面作用下,部分细胞死亡,分裂后的细胞碎片又对正在生长的细胞产生不利影响,如此反复循环,导致培养后期的活细胞密度反而不高,培养液中杂质增多。在低转速时,剪切力虽然更低,但由于低转速的混合效果不好,营养难以均一,溶氧不充分,细胞生长状况并不理想。同时低转速也令细胞的分散度降低,细胞结团的现象增多。中转速则兼顾了混合均一与低剪切力的优势,同时满足了溶氧要求,保证细胞的正常快速增殖。
3.3 DO梯度与细胞形态 Sf 9对溶解氧浓度的要求方面与哺乳动物细胞相似,只要保证其最低溶解氧浓度,即可进行正常的生长代谢活动,即使将DO提升至90%,对细胞的增值时间并没有产生显著影响。在实验中我们也发现,根据细胞密度的不同,细胞培养所需的最低DO也会不同。细胞密度越高,所需的最低DO也将相应上升。如果低于所需的最低DO,生长速度将很快下降,甚至停止。由于没有做高DO对sf 9细胞生理代谢方面影响的实试验,根据以往其他细胞大规模培养的经验,可将反应器培养sf 9细胞的DO设定在50%~60%。
本试验中,作为反应器供氧的来源,只需要压缩空气即可满足sf 9细胞的耗氧要求。但要培养同样规模的其他悬浮细胞,如BHK-21、HEK293等,在培养中后期则必须通入纯氧气方能保证DO的稳定。由此可见,相比其它哺乳动物细胞,应用反应器悬浮培养sf 9细胞的耗氧量并不突出。从设定的参数来看,本梯度试验中的参数设定最接近优化后的组合,从图3看细胞生长曲线,在第2天进入对数生长期,平均倍增时间约22~26h,细胞接种后5~6d。细胞密度即可达到峰值1.0~1.5×106cells /ml(总体积5L),细胞状态良好,与所接细胞种的形态基本无差别。
本试验过程中,细胞培养液的pH表现的非常稳定,即使在细胞培养后期,也极少补加NaHCO3进行调节,这可能与sf 9细胞在代谢过程中利用乳酸有关[5]。
4 结论
本文中对应用激流式生物反应器大规模悬浮培养sf 9细胞的几项关键工艺参数进行了初步研究,确定优化后的工艺参数为培养温度28℃,pH6.2,转速50rpm,细胞接种密度1.0×105cells/ml,DO50%,并通过相关试验证明了上述参数的可行性。上述参数可通过相似的试验再次优化,以期得到最佳效果。同时,该结果也可以作为进一步规模放大的依据。
[1] lain R.Cameron Trendsin Biotechnology. 1989.7: 66-70.
[2] 金小红, 孟哲峰, 陈存国. 小牛血清和胎牛血清对Sf 9细胞生长和重组蛋白表达影响的比较[J]. 中国病理生理杂志, 2006(2).
[3] 王晓迟, 戚艺华, 欧阳帆. Sf 9细胞的培养工艺[J]. 化工冶金, 1998, 19(4): 277-280.
[4] 赵佼, 谭文松, 周燕等. 昆虫细胞(Sf21)悬浮培养过程中生长限制性基质间歇补加技术的应用[J]. 生物工程学报, 2000, 16(3): 357-362.
[5] 徐殿胜, 陈国豪, 陆兵等. 昆虫细胞(Sf 9)培养中葡萄糖、乳酸的影响[J]. 生物工程学报, 1996, 12(4): 508-511.
(2012–06–29)
Q962
A
1007-1733(2012)08-0012-02
