蜂蜜中链霉素多种检测方法比较
2012-11-20赵晓凤新疆兽药饲料监察所乌鲁木齐830000何方洋汪善良张禹李勇田甜陈连星北京勤邦生物技术有限公司
赵晓凤 (新疆兽药饲料监察所 乌鲁木齐 830000) 何方洋 汪善良 张禹 李勇 田甜 陈连星 (北京勤邦生物技术有限公司)
蜂蜜中链霉素多种检测方法比较
赵晓凤 (新疆兽药饲料监察所 乌鲁木齐 830000) 何方洋*汪善良 张禹 李勇 田甜 陈连星 (北京勤邦生物技术有限公司)
采用胶体金免疫层析法、酶联免疫法与液相色谱-串联质谱法三种常用分析方法对蜂蜜中残留的链霉素进行检测,考察了三种方法的符合率。结果表明,胶体金免疫层析法具有操作简便、快速、直观的特点,酶联免疫法灵敏度高适合作为快速筛选方法,液相色谱-串联质谱法可进行阳性样品的确证和精确定量。
链霉素 胶体金免疫层析法 酶联免疫法 液相色谱-串联质谱法 蜂蜜
链霉素(Streptomycin, SM)是一种常见的氨基糖苷类抗生素,是目前我国畜牧业和水产业中的常用药物之一。但其耐药性强,毒副作用较大,若动物性食品中有过量的链霉素残留,则可能对人造成严重危害。为了保障动物源性食品的安全,欧盟2377/90/EEC(703/2007修订) 规定动物性食品肌肉、脂肪、肝脏中链霉素最大残留限量(MRLs)为500μg/kg,肾脏中为1000μg/kg,奶中为200μg/kg[1]。我国农业部第235号文件《动物性食品中兽药最高残留限量》中规定链霉素在牛奶中残留限量为200μg/L,在肌肉、脂肪、肝中为600μg/kg,在肾中为1000μg/kg。
目前链霉素残留的检测方法主要包括微生物法、免疫学法、液相色谱法、质谱法、毛细管电泳法等[2-12]。如化学发光法检测水产品中链霉素检出限为0.05μg/g[4];高效液相色谱柱后衍生物法测定蜂王浆中的链霉素检出限0.005mg/kg[5];双柱固相萃取净化-液相色谱-串联质谱测定牛奶和奶粉中链霉素和双氢链霉素,牛奶检出限为4μg/kg,奶粉检出限为30μg/kg[6];超高效液相色谱-串联质谱法测定奶粉中链霉素与双氢链霉素,检出限为0.01mg/kg[7];HPLC-MS/MS测定蜂蜜中链霉素和双氢链霉素,链霉素检出限0.002mg/kg,双氢链霉素0.001mg/kg[8];提取净化及液相色谱检测方法检测蜂王浆中链霉素检出限为10μg/kg[9];亲水作用色谱-串联质谱法测定蜂蜜中的链霉素和双氢链霉素,最低定量限分别为0.5μg/kg和1.0μg/kg[10];以HPLC为代表的色谱技术已被证明为最有效的确证性检测食品中农兽药残留的手段之一。但由于仪器较昂贵、费用高,不适合进行大规模现场检测,而免疫学方法具有灵敏度高、成本低、大规模检测等优点,应用胶体金免疫层析技术研制出链霉素残留快速检测试纸,检测限为8μg/L[11]。采用ELISA法检测牛奶中链霉素残留量检测限可达20μg/L或以下,符合快速筛选方法的要求[12]。免疫测定方法的建立是未来抗生素残留检测的主要研究方向,而多方面技术的结合与应用将是主要的研究手段[3]。
本文采用胶体金免疫层析法、酶联免疫法、液相色谱-串联质谱法三种方法对蜂蜜中链霉素的检测进行了比较,结果表明这三种方法具有很好的符合率,能满足不同的检测要求。
1 材料与方法
1.1 试剂和仪器
链霉素标准品,Sigma公司生产;磷酸、十二水合磷酸氢二钠、二水合磷酸二氢钠、磷酸氢二钾、中性氧化铝分析纯、庚烷磺酸钠、甲酸、甲醇、乙腈色谱纯、链霉素快速检测试纸条、链霉素ELISA检测试剂盒均由北京勤邦生物技术有限公司提供。
KS-Ⅱ振荡器,上海跃进医疗器械厂;DSY-Ⅲ氮吹仪,北京金科精华苑科技有限公司;QL-901漩涡混合器,海门市其林贝尔仪器制造有限公司;Anke GL-20G-Ⅱ高速离心机,上海安亭科学仪器有限公司;2000SBL电子天平,美国Setra公司;MK3酶标仪和微量移液器(单道20~200μl、100~1000μl,多道50~ 300μl),美国Thermo公司;Acquity液相色谱串联质谱仪(配有电喷雾离子源)及Xcalibur1.2数据处理系统,美国Waters公司。
1.2 试验方法
1.2.1 胶体金免疫层析法 (1)样品前处理:准确称取0.5g蜂蜜到4ml离心管中,加入样本提取液1.5ml,涡动1min,混匀待检。(2)检测方法:吸取100μl待检样本溶液于微孔中,缓慢抽吸使其充分与微孔中试剂混匀。将标记好的试纸条插入微孔中,印有“MAX”线端朝下,使之充分浸入溶液中。室温(20~25℃)孵育5min后,取出试纸条,根据示意图判定结果。(3)检测结果分析:当样品为阴性(-)时,检测线(T线)显色强于质控线(C线)显色或与C线显色无明显差异,表示蜂蜜样本中不含有链霉素或其浓度低于检测限。当样品为阳性(+)时,T线显色明显弱于C线显色或T线不显色,表示蜂蜜样本中链霉素浓度等于或高于检测限。当C线不显色时,表明不正确的操作过程或试纸条已失效。
1.2.2 酶联免疫法 (1)样品前处理:方法一:称取1.0g蜂蜜样本至50ml聚苯乙烯离心管中,加入10ml提取缓冲液(参见产品说明书),用振荡器振荡10min至蜂蜜全部溶解,4000r/min室温(20~25℃/68~77℉)离心10min,直至清亮。用RIDA C18柱(纯化提取物),用2ml甲醇洗柱子,流速为60滴/min;用2ml去离子水洗柱子,流速为60滴/min;取2ml样本以流速为15滴/min过柱;用3ml去离子水洗柱子,45滴/min;用空气吹干柱子;除去柱中水分,用1ml甲醇洗脱样本,流速为15滴/min;在40~50℃水浴氮气流下完全蒸发溶剂;用2ml提取工作液(参见说明书)溶解干燥的残留物;取50μl进行分析。方法二:称取1.0g蜂蜜样本至50ml聚苯乙烯离心管中,加入5ml 提取工作液,用振荡器振荡10min至蜂蜜全部溶解,4000r/min室温(20~ 25℃/68~77℉)离心10min,直至清亮;取200μl清亮上清液,加入600μl提取工作液中混匀;取50μl进行分析。(2)检测方法:按照北京勤邦生物技术有限公司链霉素ELISA检测试剂盒说明书进行检测。(3)检测结果分析:标准品或样本的百分吸光率等于标准品或样本的吸光度值的平均值(双孔)除以第一个标准(0标准)的吸光度值,再乘以100%。以标准品百分吸光率为纵坐标,以链霉素标准品浓度的对数为横坐标,绘制标准曲线图。将样本的百分吸光率代入标准曲线中,从标准曲线上读出样本所对应的浓度,乘以其对应的稀释倍数即为样本中链霉素实际残留量。
1.3 液相色谱-串联质谱法
1.3.1 标准工作溶液的配制 称取链霉素配制成100μg/ml的标准储备溶液,再用空白样品溶液将标准储备液稀释成0μg/L、20μg/L、50μg/L、100μg/L、150μg/L的标准工作溶液。
1.3.2 样品溶液的制备 参考“GB/T 22995-2008 蜂蜜中链霉素、双氢链霉素和卡那霉素残留量的测定液相色谱-串联质谱法”标准方法中的7.1步骤进行蜂蜜样品制备。
1.3.3 色谱及质谱条件 (1)色谱条件:Acquity UPLC®BEH C18柱(2.1×100mm,粒径1.7μm);柱温为30℃;流动相为A相:0.1%七氟丁酸,B相:乙腈;流速0.2ml/min;进样量5μl。流动相及梯度洗脱条件见表1。(2)质谱条件:离子源为电喷雾离子源;扫描方式为正离子扫描;检测方式为多反应监测;电离电压0.5KV;离子源温度150℃;脱溶剂温度 350℃;碰撞气流速 0.15ml/min;锥孔气流速50L/hr;脱溶剂气流速550L/hr。(3)检测结果分析:采用外标法对样品中残留的链霉素进行定量分析。以链霉素药物标准品的相对丰度为纵坐标,以不同浓度梯度的标准品工作液浓度(μg/L)为横坐标,绘制标准曲线。将样品中相对丰度代入标准曲线中,从标准曲线上读出对应的链霉素药物的浓度,即为样品中链霉素药物实际残留量。

表1 流动相及梯度洗脱条件 (min,%)
2 结果与分析
2.1 标准曲线绘制
2.1.1 酶联免疫法标准曲线 分别测定链霉素标准品浓度为0ng/L、50ng/L、150ng/L、450ng/L、1350ng/L、4050ng/L的吸光度,建立链霉素标准曲线如图1,IC50值为152.0ng/L。
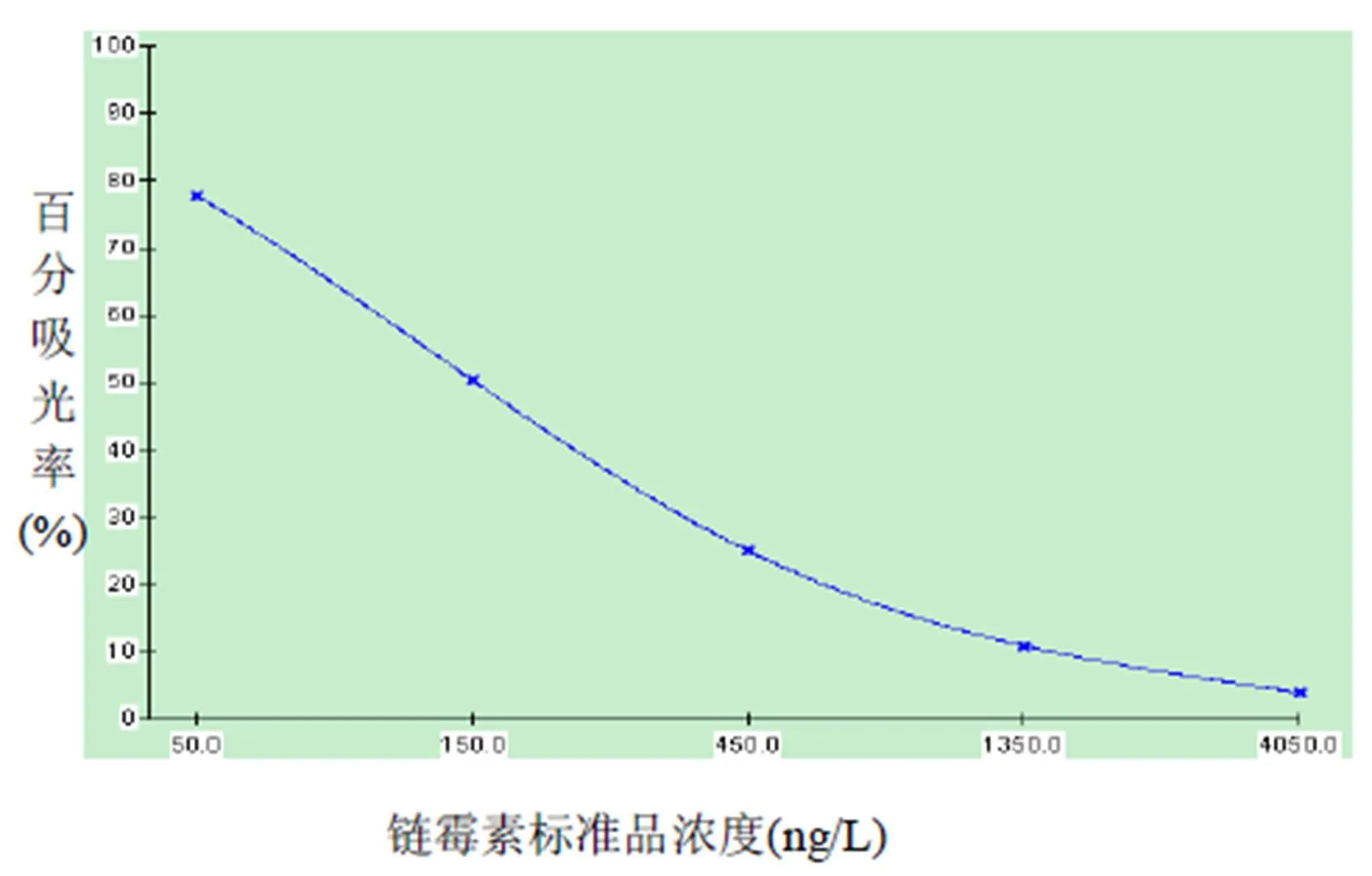
图1 链霉素ELISA标准曲线
2.1.2 LC-MS/MS法标准曲线 分别取链霉素标准品浓度为0μg/L、20μg/L、50μg/L、100μg/L、150μg/L,经LC-MS/MS法分析,标准曲线见图2,标准曲线y=27.31x +0.698,R2=0.998。
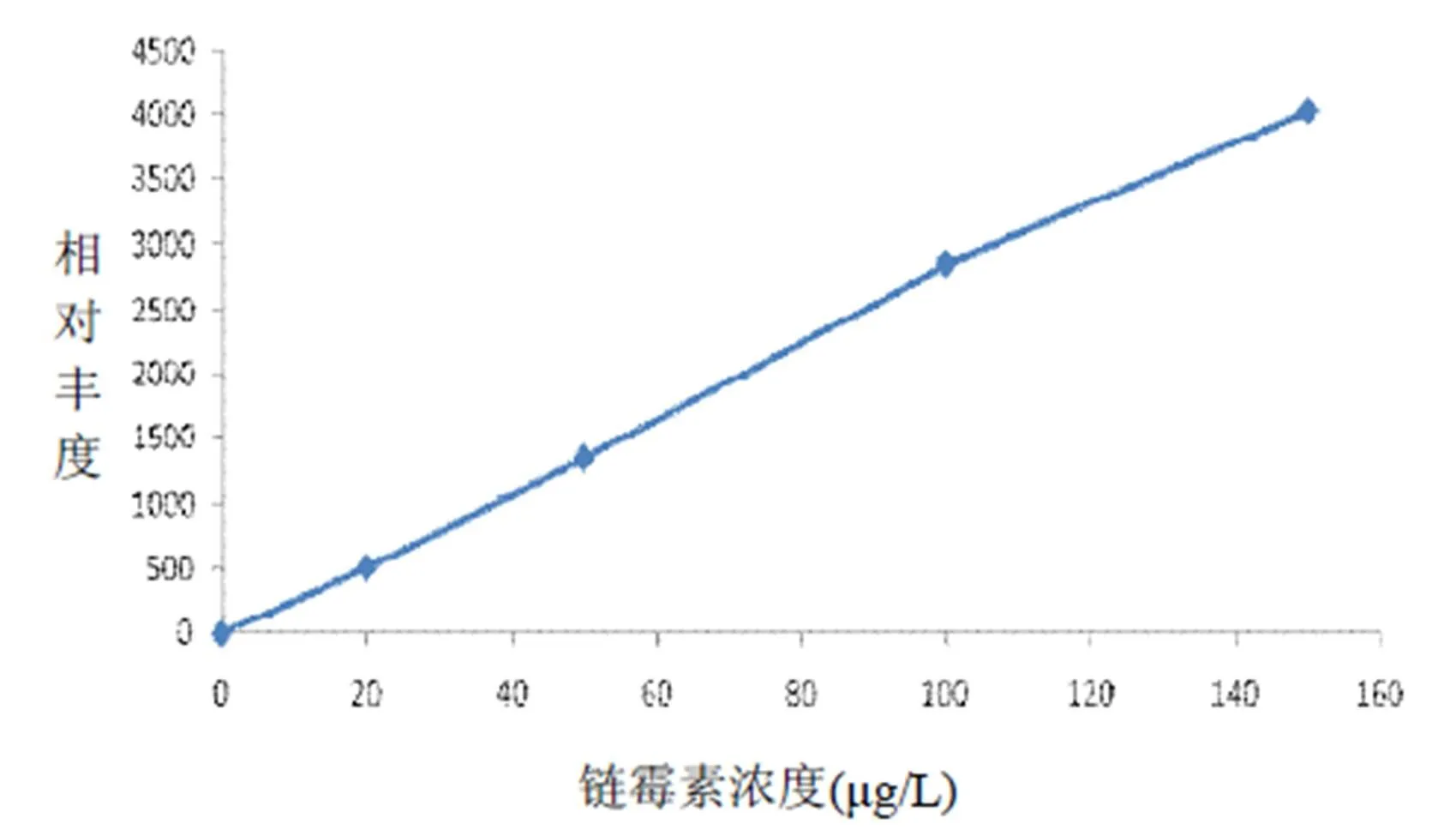
图2 链霉素LC-MS/MS标准曲线
2.2 检测限
2.2.1 胶体金试纸条检测限 在空白蜂蜜样品中分别添加链霉素标准品至终浓度为:10μg/kg、20μg/kg、40μg/kg;取试纸条进行测试,每个浓度测定5个重复,验证试纸条的最低检测限。检测结果显示:在蜂蜜样品中添加链霉素至终浓度为10μg/kg时试纸条检测结果均显示阴性,当蜂蜜样品中添加链霉素至终浓度为20μg/kg、40μg/kg时试纸条检测结果均显示阳性;可判读链霉素胶体金试纸条在蜂蜜样品中的检测限为20μg/kg。

2.2.3 液相色谱及串联质谱法检测限 最低检测限按照定量离子信噪比3:1计算,得该方法在蜂蜜样品中检测限为5.0μg/kg。
2.3 三种方法检测实际样品结果比较
运用三种方法对20份蜂蜜样品进行检测,三种方法测定的结果基本一致。其中检测出一份阳性样本,ELISA检测结果为310.8μg/kg,LC-MS/MS法检测结果为301.9 μg/kg,链霉素标准品质量色谱图如图3,检测出的阳性样品质量色谱图如图4。

图3 链霉素标准品(50μg/L)质量色谱图

图4 阳性样品质量色谱图
3 结论
本试验采用三种方法对蜂蜜中残留的链霉素进行了检测,如果蜂蜜样品中有结晶,需要置于不高于60℃水浴中温热,待蜂蜜全部融化后搅拌均匀,冷却至室温后进行检测。在ELISA检测的洗涤过程中,要用吸水纸拍干以保证完全除去微孔中的液体,从而避免影响后续测试。
采用三种方法对蜂蜜样品进行检测,检测结果显示基本一致。胶体金试纸条是一种基于免疫反应的快速检测方法,该方法简便(不需要,或只进行简单的前处理,操作简单易掌握)、快速,性能稳定,重复性好,适合于进行现场样品的快速筛选,但由于其通过肉眼判断颜色色度进行结果判断,不能测定药物的准确含量故只能用于定性粗筛。酶联免疫试剂盒重复性好、准确度高,比试纸条灵敏度高,也适合作为快速筛选方法。LC-MS/MS方法是实验室常用的检测方法之一,具有较高的灵敏度和稳定性,可以对样品进行确证和精确定量,但由于对样品前处理要求较高,需要先进的分析仪器,成本也较高。因此在实际检测中可以选择胶体金试纸条等快速检测方法作为对样品的快速初筛方法,再将筛查的阳性样品采用仪器方法进行确证和精确定量。
[1] 2377/90/EC: Council Regulation(EEC)of 26 June 1990 laying down a Community Procedure for the establishment of maximum residue limits of veterinary medicinal products in foodstuffs of animal orgin, Brussels, Belgium[J]. Off J Eur Commum, 1990, 224: 1-124.
[2] 吕青, 朱咏梅, 刘勇等. 食品中链霉素检测方法研究进展[J]. 安徽农业科学, 2009, 37(17): 7850-7851.
[3] 张桂贤. 链霉素单克隆抗体的制备及其初步应用研究[D]. 西南大学, 2006.
[4] 王立, 江洁, 张莹等. 化学发光法测定水产品中链霉素残留[J]. 广西师范大学学报:自然科学版, 2007,25(3): 83-87.
[5] 张晓燕, 徐锦忠, 沈崇钰等. 高效液相色谱柱后衍生法测定蜂王浆中的链霉素[J]. 色谱, 2008,26(3):395-397.
[6] 刘晓茂, 张进杰, 张守军等. 双柱固相萃取净化-液相色谱-串联质谱法测定牛奶和奶粉中链霉素和双氢链霉素残留量[J]. 分析试验室, 2010, 29(10):40-44.
[7] 何强, 孔祥虹, 赵洁等. 奶粉中链霉素与双氢链霉素残留量的超高效液相色谱-串联质谱法测定[J]. 分析测试学报, 2010, 29(7): 691-694.
[8] 刘晓茂, 赵淑军, 张进杰等. 蜂蜜中链霉素与双氢链霉素残留量的液相色谱串联质谱法测定[J].分析测试学报, 2008,27(12):1351-1354.
[9] 薛晓锋, 吴黎明, 陈兰珍等. 蜂王浆中链霉素残留的提取、净化及液相色谱测定方法研究[J]. 食品科学, 2008, 29(11):487-489.
[10] 杜玥, 杨慧元, 徐伟东. 亲水作用色谱-串联质谱法测定蜂蜜中的链霉素和双氢链霉素[J]. 中国抗生素杂志(英文), 2009, 34(11):669-677.
[11] 范国英, 陈永耀, 王顺岗等. 链霉素快速检测试纸的研制及其性能测定[J]. 西北农业学报, 2010, 19(2):40-44.
[12] 黄耀凌, 刘智宏, 叶妮等. ELISA法检测牛奶中链霉素残留量[J]. 中国乳品工业, 2007, 35(2): 54-56.
(2012–06–16)
S859.79+6
A
1007-1733(2012)08-0001-04
