泼尼松龙对脂多糖诱导的BV2细胞NO、iNOS及p38表达的影响
2012-11-20徐德军朴花子延边大学基础医学院吉林延吉33002
王 丹 徐德军 朴花子 (延边大学基础医学院,吉林 延吉 33002)
小胶质细胞在老年性痴呆、帕金森病等中枢神经系统退行性疾病中有重要作用〔1~4〕,是广泛分布于中枢神经系统(CNS)的一类重要免疫效应细胞,在维持神经元生存和生命活动中起着重要作用,它具有免疫和炎症的双向调节功能。脂多糖(LPS)即内毒素,是革兰阴性菌的主要致病成分,当LPS攻击巨噬细胞时,可激活巨噬细胞内p38丝裂原激活的蛋白激酶(p38 MAPK)信号通路,促使诱导型一氧化氮合酶(iNOS)等表达增加,产生大量NO,参与炎症反应。泼尼松龙是中效肾上腺皮质激素药,属于甾体类抗炎药。对多种原因所致的炎症反应(如感染性炎症、物理性炎症、化学性炎症、免疫性炎症及无菌性炎症)均有效,所以临床上广泛应用于各种原因所致的过度炎症性疾病,如过敏性疾病、严重细菌感染、肿瘤治疗、器官移植免疫排斥反应及对糖皮质激素敏感的眼部炎症等。BV2细胞属于小胶质细胞株,本实验观察p38 MAPK信号通路在泼尼松龙干预后NO、磷酸化p38(p-p38)及iNOS蛋白表达变化和iNOS mRNA表达变化中的调控作用,来探讨其在LPS所致的小胶质细胞炎症反应中的作用。
1 材料与方法
1.1 实验试剂 泼尼松龙与LPS均为美国Sigma公司产品,细胞培养液DMEM(Dulbeccos modified Eagles media)和TRIZOL试剂为美国 Gibco公司产品。p38 MAPK、P-p38、ERK1/2、p-ERK1/2、JNK、p-JNK、iNOS 抗体为 Santa Cruz公司产品,小鼠BV2小胶质细胞株由韩国梨花女子大学神经科学研究所提供。
1.2 细胞培养 小鼠小胶质细胞株BV2用含10%小牛血清的DMEM培养液(含青霉素100 U/ml和链霉素100 μg/ml)培养,37℃,5%CO2恒温箱培养,细胞单层生长,达80%左右时传代。细胞接种到培养板后均孵育过夜,泼尼松龙在LPS使用前1 h加入。
1.3 分组与处理 细胞接种于48孔培养板(3.5×105细胞/ml,0.2 ml/孔)12 h后实验。实验分为空白对照组、LPS(100 μg/L)组、泼尼松龙(10、20、30 μmol/L)组和 LPS 加泼尼松龙组,继续培养24 h后,Greiss法测定培养液中NO含量。
1.4 iNOS mRNA测定 细胞接种于60 mm培养皿(2×106细胞/ml)中培养12 h后,分别添加泼尼松龙 (10 μmol/L)和LPS(500 μg/L)。继续培养6 h,按说明书用Trizol试剂抽提RNA,计算总RNA浓度,取总RNA 2 μg进行逆转录。再以逆转录反应液2 μl作为模板,加入相应引物(β-actin内参照)进行PCR扩增,总反应体积50 μl。所用iNOS引物序列上游引物5'-TCA CTG GGA CAG CAC AGA ATG-3',下游引物 5'-AAC TGG GTG AAC TCC AAG GT-3',扩增产物684 bp;β-actin上游引物5'-TGA ACC CTA AGG CCA ACC-3',下游引物5'-CCA CAG GAT TCC ATA CCC-3',扩增产物489 bp。PCR条件为94℃预变性4 min,94℃变性 45 s,53℃复性 45 s,72℃延伸 45 s,30 个循环,最后72℃延伸5 min。1.5%琼脂糖电泳PCR扩增产物,Quantity One软件分析二者PCR产物光密度值,以目的mRNA与内参β-actin的RT-PCR产物光密度比值作为目的mRNA相对表达量。
1.5 Western印迹法测定BV2细胞iNOS和p-p38蛋白表达细胞接种于6孔培养板(9×105细胞/ml),分别添加泼尼松龙(10 μmol/L)和 LPS(500 μg/L)。细胞培养 24 h 后,用冰冷的PBS终止刺激并洗涤细胞2次,用细胞刮子将细胞刮下,按说明书提取细胞总蛋白,BCA法测定蛋白浓度。取50 μg样品煮沸变性后进行SDS-PAGE电泳(5%浓缩胶和10%分离胶)、转膜、5%脱脂奶粉37℃封闭1 h,分别添加抗iNOS、P-p38/p38、p-ERK1/2/ERK1/2、p-JNK/JNK 和(或)抗 β-actin一抗(1∶1 000)4℃孵育过夜,洗膜、加辣根过氧化物酶标记的二抗稀释液(1∶2 000),37℃下孵育1 h,化学发光法显影,用图像分析系统分析目标带光密度值,以目的蛋白与内参β-actin蛋白光密度比值作为目的蛋白相对表达量。
2 结果
2.1 泼尼松龙对LPS诱导NO含量的影响 细胞培养液中添加 LPS(100 μg/L)和泼尼松龙(0.1、1、10 μmol/L)处理细胞后培养24 h。LPS组与空白对照组比较,NO含量高达404%,而泼尼松龙可明显抑制由LPS诱导NO分泌,各剂量泼尼松龙组NO含量分别为292%、176%、115%,有剂量依赖性,泼尼松龙1、10 μmol/L组与LPS组比较差异显著(P<0.05)。
2.2 泼尼松龙对LPS诱导的iNOS表达影响 无LPS刺激情况下BV2细胞不表达iNOS基因,同时单纯泼尼松龙对iNOS表达无影响。但是用LPS刺激后,BV2细胞iNOS mRNA和蛋白表达显著增高,而泼尼松龙明显抑制LPS诱导的BV2细胞iNOS mRNA和蛋白表达,而且明显低于单独使用LPS组(图1)。
2.3 泼尼松龙对LPS诱导的P-p38/p38、p-ERK1/2/ERK1/2和p-JNK/JNK蛋白表达的影响 用LPS刺激后,BV2细胞P-p38和p-ERK1/2表达显著增高,而泼尼松龙明显抑制LPS诱导的BV2细胞P-p38的表达,而对p-ERK1/2/ERK1/2和p-JNK/JNK表达没有明显影响(图2)。
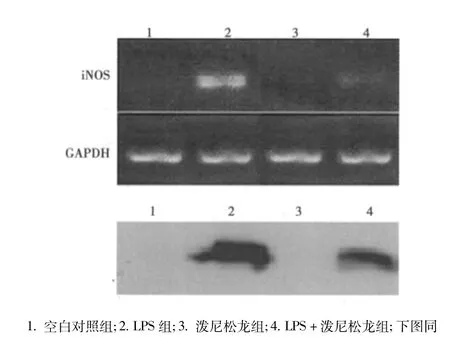
图1 泼尼松龙对LPS诱导小胶质细胞的iNOS mRNA(A)和iNOS蛋白(B)表达的影响

图2 泼尼松龙对LPS诱导的小胶质细胞P-p38/p38、p-ERK1/2/ERK1/2和p-JNK/JNK蛋白表达的影响
3 讨论
某些病理条件下,如感染、外伤、缺血、毒性物质侵害等情况下,小胶质细胞可被激活,活化后的小胶质细胞在脑内充当第一道防线,调节与免疫相关的某些分子表达,释放细胞因子和趋化因子等,同时发挥机械吞噬功能,吞噬入侵的病原体、有害物质及死亡的神经细胞残骸核,对神经元起到一定保护作用;而另一方面,小胶质细胞长期持续活化,会分泌一系列毒性物质和前炎性因子,如氧自由基、白细胞介素-1β(IL-1β)、IL-6、肿瘤坏死因子(TNF)-α、NO等。这些物质与小胶质细胞活化互为因果,相互作用,使CNS炎症反应放大、毒性产物进一步增多,导致相应脑区神经元变性坏死,从而引起相应疾病。目前,已经公认的是某些神经退行性疾病发生与中枢神经系统炎症反应密切相关,例如阿尔茨海默病、多发性硬化和创伤后脑缺血损伤等疾病都与炎症相关。持续活化的小胶质细胞产生大量 NO、TNF-α、IL-β、自由基等致炎因子和细胞毒性因子,从而引发中枢神经系统炎症反应,这种炎症反应是神经变性疾病发展中的早期主要事件,并且过量生成、积聚的炎症因子与神经细胞死亡也有关。因此,抑制小胶质细胞激活可能是抑制神经炎症反应的关键所在。本研究首次证明了泼尼松龙通过MAPK信号通路抑制LPS激活的BV2细胞中NO/iNOS表达。
NO是一种具有高反应活性的小分子活性物质,在多种生理条件下及病理活动中发挥重要作用。正常情况下NO是一种细胞内信使分子,对机体发挥着有益的调节作用,但当炎症发生时,会使iNOS表达增高并合成过量的NO,此时NO起细胞毒素分子的作用。LPS是刺激小胶质细胞表达iNOS的最有效刺激物之一,激活的小胶质细胞正是通过iNOS过表达而合成过量的NO,从而造成神经元细胞损伤。有研究报道LPS能高度激活小胶质细胞,并产生 NO、TNF-α、IL-β、自由基及类花生酸类等致炎物质,从而引起神经元损伤〔5,6〕。
MAPK是真核细胞中丝氨酸/苏氨酸激酶,可激活其他蛋白激酶,可调节转录因子活性。MAPK家族包括p38MAPK、ERK和JNK等重要成员。其中多位学者已通过实验证实p38MAPK参与调控LPS诱导的iNOS表达和NO的产生〔7〕。其中p38MAPK信号通路已被证实是控制炎症反应的最重要成员之一,p38蛋白磷酸化是确保此通路活化和执行转导功能的必要条件〔8〕。
泼尼松龙是中效肾上腺皮质激素药,属于甾体类抗炎药。临床上广泛应用于各种原因所致的过度的炎症性疾病,如过敏性疾病、严重细菌感染、肿瘤治疗、器官移植免疫排斥反应及对糖皮质激素敏感的眼部炎症等。白宇等〔9〕报道,甲泼尼龙对急性脑衰竭有显著治疗作用。本实验结果提示,泼尼松龙可能通过抑制p-p38MAPK活化途径下调iNOS表达和NO产生,从而起抗LPS作用。由于LPS信号转导通路复杂,涉及信号分子众多,因而明确泼尼松龙抗LPS机制尚需深入研究。
1 Liu B,Hong JS.Role of microglia in inflammation mediated neurodegenerative diseases:mechanisms and strategies for therapeutic intervention〔J〕.Pharmacol Exp Ther,2003;304(1):1-7.
2 刘之荣,李露斯.小胶质细胞与脑缺血〔J〕.国外医学·脑血管疾病分册,2000;8(1):15-7.
3 Wong A,Luth HJ,Deuther-Conrad W,et al.Advanced glycation endproducts co-localize with inducible nitric oxide synthase in Alzheimer's disease〔J〕.Brain Res,2001;920(1):32-40.
4 Murphy A,Sunohara JR,Sundaram M.Induction of protein kinase C substrates,Myristoylated alanine-rich C kinase substrate(MARCKS)and MARCKS-related protein(MRP),by amyloid β-protein in mouse BV-2 microglial cells〔J〕.Neurosci Lett,2003;347(1):9-12.
5 贾丽艳,拓西平,朱嘉琦,等.Aβ对小胶质细胞中IL-1β及iNOS mRNA 水平的影响〔J〕.实用老年医学,2005;19(3):132-4.
6 Kim WG,Mohney RP,Wilson B,et al.Regional difference in susceptibility to lipopolysaccharide-induced neurotoxicity in the rat brain:role of microglia〔J〕.Neuroscience,2000;20(16):6309-16.
7 Kaminska B.MAPK signaling pathways as molecular targets for anti-inflammatory therapy-from molecular mechanisms to therapeutic benefits〔J〕.Biochim Biophys Acta,2005;1754(1-2):253-62.
8 夏晓东,吴立琴,徐 慧,等.罗红霉素通过诱导型一氧化氮合酶/一氧化氮途径抑制哮喘大鼠气道炎症〔J〕.中国药理学通报,2009;25(9):1223-6.
9 白 宇,侯郁青.甲基泼尼松龙治疗急性脑衰竭临床应用研究〔J〕.临床急诊杂志,2001;2(5):228-9.
