血管紧张素转化酶的微小RNA调控及其在冠心病治疗中的应用
2012-11-20郭威早航天中心医院高干二科北京00049
郭威早 佟 倩 (航天中心医院高干二科,北京 00049)
冠心病是我国居民死因构成中上升最快的疾病〔1〕。遗传易感性是冠心病发病的重要因素,然而目前对冠心病的致病基因及其作用机制仍然没有定论〔2〕。在冠心病众多的候选基因中,血管紧张素转化酶(angiotensin converting enzyme,ACE)是被研究得最为深入和广泛的发病相关基因之一〔3〕。但是,关于ACE的研究结果在不同的人群中不尽相同。既往的研究也提示基因-基因以及基因-环境相互作用是一个值得深入的研究方向〔4〕。微小RNA(microRNA,miRNA)是生物体中内源性的由基因表达产生的短链RNA分子,长度为22个核苷酸左右,通过与相关的信使RNA(mRNA)结合抑制其翻译或诱发其降解〔5〕。miRNA通过基因调控,在细胞的生长、发育、分化以及对环境的适应中发挥着非常重要的作用〔6〕。如果将miRNA机制纳入ACE的基因调控,则可以合理地建立基因与环境的相互作用,更好地符合冠心病的宏观模型。基于上述背景,本研究对ACE的miRNA调控机制进行探讨和分析。
1 材料与方法
1.1 调节ACE基因的miRNA预测 根据“种”序列匹配原理,利用美国麻省理工学院(MIT)TargetScan数据库(2011年11月第6版)进行,对人ACE基因1 014 bp(根据NCBI编号为NM_152830参考序列)的3'-UTR进行了候选miRNA的预测。具体操作方法根据该数据库的在线操作指南进行。
1.2 大鼠心肌细胞培养 大鼠心肌细胞株H9c2(2-1)购自美国ATCC公司,在Forma-3110型二氧化碳温箱中,参照本课题组此前报道的方法〔7〕进行培养。培养基及胎牛血清购自美国Invitrogen公司。基本步骤:采用DMEM培养基加10%胎牛血清,在5%CO2、37℃条件下培养。每轮培养3 d。阶段培养结束后,采用0.25% 胰蛋白酶合并0.53 mmol/L EDTA溶液处理10 min,细胞脱壁收集后按1∶4的比例分盘继续培养。
1.3 miRNA的增强和抑制 增强剂和抑制剂均从美国ABI公司购买。miR-27a/27b增强剂为合成的双链RNA分子;miR-27a/27b抑制剂为化学修饰的单链核酸,可以特异地结合miR-27a/27b而产生抑制效应。此外,以Pre-miR(增强)/Anti-miR(抑制)阴性对照1号作为阴性对照。为了将miR-27a/27b增强剂、抑制剂及阴性对照导入培养的H9c2(2-1)大鼠心肌细胞,实验采用美国Neuromics公司iFect转染试剂盒,具体操作按照该试剂盒说明书进行。每种miRNA转染剂量在前期预实验的基础上,按有效最低剂量原则选择为20 nmol/L。细胞在转染后状态继续培养48 h。
1.4 蛋白免疫印迹杂交 参照文献报道〔7〕方法进行,作了少许简化和修改。具体步骤:将收集的约106个心肌细胞在1 ml冰冷的裂解缓冲液中重悬,细胞裂解缓冲液购自北京博大万兴科技有限公司。匀浆后通过Virtis超声细胞粉碎仪进行超声剪切(设置2.0,处理1 s×10次);然后,以Eppendorf-5417R离心机于4℃,12 000 r/min,离心5 min去除不溶性沉渣。蛋白浓度测定采用Pierce公司BCA蛋白试剂盒进行。等量的蛋白加入到8%~16%SDS-PAGE进行电泳分离,然后电转移至硝酸纤维素膜。硝酸纤维素膜上的非特异结合通过以下杂交液屏蔽。杂交液包括Tris缓冲盐水,0.1%吐温-20,5%脱脂牛奶。兔抗人ACE抗体购自美国Santa Cruz生物技术公司,该抗体除可用于人源性ACE蛋白的检测,亦可以用于大鼠和小鼠ACE蛋白的检测。实验中采用1∶200的比例稀释。次级抗体为辣根过氧化物酶耦联的抗兔抗体,购自北京翰谱生物医药研究所。免疫复合物用Amersham ECL加强型试剂盒检测。免疫印迹的定量分析采用Syngene凝胶建档及分析系统进行。
1.5 统计学分析 一元ANOVA采用SPSS11.5软件进行。
2 结果
2.1 调节人ACE基因的miRNA预测结果 共有218个miRNA具有和人类ACE基因3'-UTR结合并调节该基因的理论可能性。在ACE基因与心血管疾病关系的研究中,许多疾病模型均建立于动物如大鼠〔8〕,这种研究的前提就是大鼠和人在ACE基因调控方面具有基本的一致性。依照这个前提,本研究对miRNA的种系恒定性(conservation)进行了进一步的分析,采用两个种系恒定性的标准,即miRNA自身的种系恒定性以及在ACE上所预测的结合位点的种系恒定性,两种恒定性的标准均采用MIT所开发的TargetScan数据库第6版的相关标准。具体的分析及分类结果见表1。
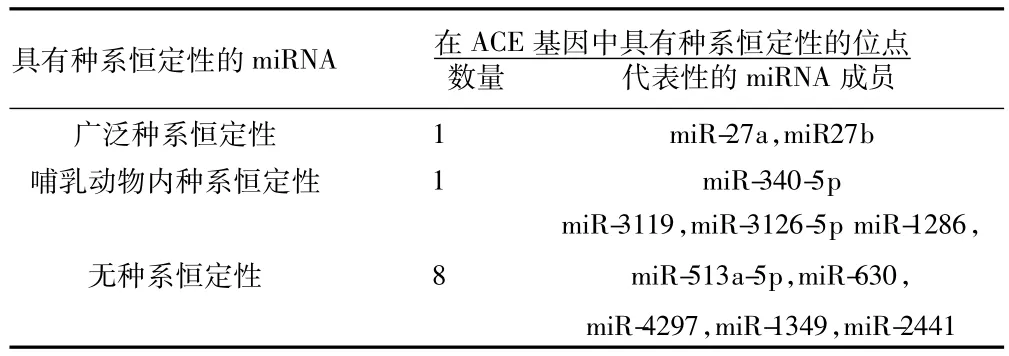
表1 ACE基因3'-UTR候选miRNA的种系恒定性
根据表1的结果,miR-27a和miR-27b两个miRNA自身具有广泛的种系恒定性(从灵长类到鱼类都存在),且在ACE基因的结合位点上也具有种系恒定性(由进化树推导),因此被作为候选miRNA,进行进一步的实验验证。
2.2 miR-27a/miR-27b的增强和抑制对ACE蛋白表达水平的影响 图1可见,与预计完全一致,使用相应的前体对miR-27a和miR-27b进行功能增强显著地减低了ACE的蛋白水平,而使用相应的抑制剂对miR-27a和miR-27b进行抑制则显著地增加了ACE的蛋白水平。以miR-27a和miR-27b前体处理心肌细胞48 h后分别使ACE蛋白水平降低了30.32%(P=0.027)和36.35%(P=0.008);同时,以miR-27a和miR-27b抑制剂处理心肌细胞48 h分别导致ACE蛋白水平提高了42.06%(P=0.026)和65.39%(P=0.001)。在调节ACE蛋白水平方面,miRNA-27a和miR-27b二者之间无显著性差异,无论是在其功能增强(P=0.834)还是在其功能抑制(P=0.280)的状态下。
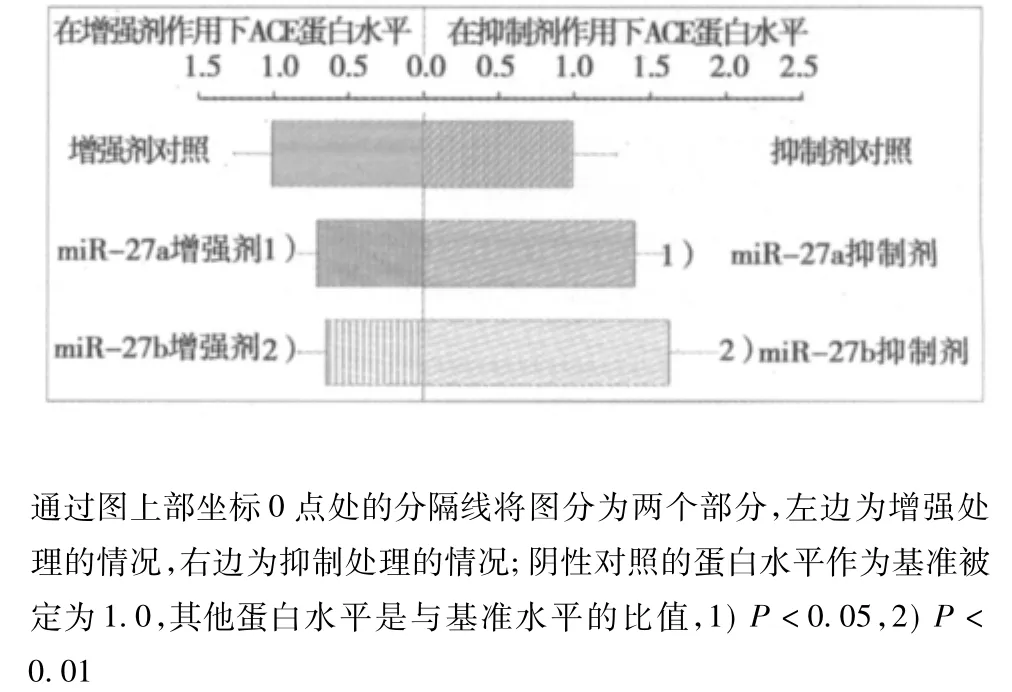
图1 在miR-27a和miR-27b功能增强和功能抑制的情况下,ACE蛋白表达水平的变化
3 讨论
冠心病与众多的基因具有相关性〔9〕,而其中相当一部分基因又有很多的miRNA参与调节〔10〕,因此这一领域的研究产生了较多的盲目性,需要一种研究手段对众多的因素进行进一步的甄别和比较,以便使后续研究更具有针对性。本文采用了一个比较新颖的策略,就是一个基因的种系稳定性,也就是所谓的保守性越好,则该基因具备的功能性可能就越基础、越重要,这一策略借鉴了基因进化的某些研究成果〔11〕。
本文选取了冠心病中一个极为重要的候选基因—ACE基因,对可能参与其调节的miRNA进行了预测,预测的依据是miRNA“种子区”(seed region)学说,这一学说多次被国际一流研究杂志报道,也获得学术界较为广泛的认同。由于miRNA和被调节基因之间没有特定的、严格的对应关系,具有“一对多、多对一”的特点,直接的实验验证难度和成本巨大,因此对调节特定基因的miRNA进行预测尤为必要。本研究的预测依据一种组合策略〔12〕,这一策略有两个候选条件:(1)从miRNA 5'端第一或第二碱基算起的7个连续碱基的“核”序列或“种子”序列与被调节基因3'端非转录区(UTR)部分序列构成完全Watson-Crick匹配(即符合碱基配对原则的匹配);(2)上述“核”序列和3'-UTR对应序列之间可以具有不匹配的碱基,只要两者结合的自由能不增加并且不含G∶U配对。一个miRNA只要与某一基因具备上述情形之一,则可以认为该miRNA具有调节该基因的可能。预测的结果显示,200多个miRNA可能对ACE基因具有调节作用,根据miRNA自身的种系稳定性以及在人类ACE基因3'非转录区(UTR)所预测的结合位点的种系稳定性,最后确认miR-27a和miR-27b是最有可能对ACE基因产生调节作用的候选miRNA。利用大鼠心肌细胞,在对miR-27a和miR-27b进行增强和抑制的同时,本文观察了ACE基因编码的蛋白表达水平的变化。与理论预计一致,在miR-27a和miR-27b被增强时,ACE的表达水平明显降低;而在miR-27a和miR-27b被抑制时,ACE的表达水平则明显升高。
目前,有许多ACE抑制剂用于高血压的治疗,研究显示ACE抑制剂在冠心病治疗中的前景也是令人瞩目的〔13〕。从机制而言,miR-27a和miR-27b可以通过抑制ACE基因表达从而作为内源性的ACE抑制剂,其作用可以模拟ACE抑制剂的药理作用。更重要的是,miRNA是机体自身的生理产物,没有副作用,所以这一研究值得深入。
1 吴锡桂.我国人群冠心病流行现况与趋势〔J〕.中国慢性病预防与控制,2003;11(4):190-2.
2 Zintzaras E,Kitsios G.Identification of chromosomal regions linked to premature myocardial infarction:a meta-analysis of whole-genome searches〔J〕.J Hum Genet,2006;51(11):1015-21.
3 Bonnici F,Keavney B,Collins R,et al.Angiotensin converting enzyme insertion or deletion polymorphism and coronary restenosis:meta-analysis of 16 studies〔J〕.BMJ,2002;325(7363):517-20.
4 Agema WR,Jukema JW,Zwinderman AH,et al.A meta-analysis of the angiotensin-converting enzyme gene polymorphism and restenosis after percutaneous transluminal coronary revascularization:evidence for publication bias〔J〕.Am Heart J,2002;144(5):760-8.
5 Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function〔J〕.Cell,2004;116(2):281-97.
6 Hatfield SD,Shcherbata HR,Fischer KA,et al.Stem cell division is regulated by the microRNA pathway〔J〕.Nature,2005;435(7044):974-8.
7 郭威早,佟 倩,曹立新,等.微小RNA对心肌细胞C反应蛋白功能水平的调节〔J〕.中国实验诊断学,2010;14(12):1900-3.
8 Kim S,Yoshiyama M,Izumi Y,et al.Effects of combination of ACE inhibitor and angiotensin receptor blocker on cardiac remodeling,cardiac function,and survival in rat heart failure〔J〕.Circulation,2001;103(1):148-54.
9 Humphries SE,Cooper JA,Talmud PJ,et al.Candidate gene genotypes,along with conventional risk factor assessment,improve estimation of coronary heart disease risk in healthy UK men〔J〕.Clin Chem,2007;53(1):8-16.
10 Rajewsky N.MicroRNA target predictions in animals〔J〕.Nat Genet,2006;38 Suppl:S8-13.
11 Dermitzakis ET,Clark AG.Evolution of transcription factor binding sites in Mammalian gene regulatory regions:conservation and turnover〔J〕.Mol Biol Evol,2002;19(7):1114-21.
12 Krek A,Grun D,Poy MN,et al.Combinatorial microRNA target predictions〔J〕.Nat Genet,2005;37(5):495-500.
13 Liu X,Lukasova M,Zubakova R,et al.Kallidin-like peptide mediates the cardioprotective effect of the ACE inhibitor captopril against ischaemic reperfusion injury of rat heart〔J〕.Br J Pharmacol,2006;148(6):825-32.
