脑组织匀浆诱导人脐带间充质干细胞分化为神经样细胞
2012-11-20王宪英吴红海秦亚斌侯艳宁河北医科大学河北石家庄05007
王宪英 吴红海 秦亚斌 侯艳宁 (河北医科大学,河北 石家庄 05007)
脑组织匀浆诱导人脐带间充质干细胞分化为神经样细胞
王宪英 吴红海1秦亚斌 侯艳宁1(河北医科大学,河北 石家庄 050017)
目的 模拟体内微环境,研究人脐带间充质干细胞(hUCMSCs)在脑组织匀浆诱导下向神经样细胞的分化程度。方法 体外分离、培养、扩增hUCMSCs,流式细胞仪鉴定其表面抗原CD29、CD44、CD45、CD105、CD34、HLA-DR;制备大鼠脑组织匀浆与hUCMSCs共培养,在倒置显微镜下观察细胞形态变化,并应用免疫细胞化学技术检测共培养3 d后细胞内神经干细胞表面标志物巢蛋白(nestin)、神经元特异性烯醇化酶(NSE)及胶质纤维酸性蛋白(GFAP)的表达。结果 脑组织匀浆培养hUCMSCs后,细胞表达nestin、NSE及GFAP,而正常培养的hUCMSCs不表达。结论 脑组织匀浆可以诱导hUCMSCs向神经样细胞分化。
脑组织匀浆;脐带间充质干细胞;神经样细胞
人脐带间充质干细胞(hUMSCs)同骨髓间充质干细胞(MSCs)、脐带血间充质干细胞等一样是一类具有自我更新和多向分化潜能的多能干细胞,其分化具有可塑性,分化方向受所处微环境的影响。有学者通过改变hUCMSCs的微环境,促进其向神经样细胞分化以期解决神经细胞再生难题,但大多为化学方法,限制了应用于临床的可能〔1,2〕。本研究采用体外模拟脑内微环境,将大鼠的脑组织匀浆与hUMSCs共培养,诱导hUMSCs向神经样细胞分化,为临床上神经创伤及神经退行性变所致神经损伤提供新的思路和方法。
1 材料与方法
1.1 动物
220 ~250 g,合格证编号:1009115。
1.2 药品和试剂
DMEM/F12、胎牛血清(FBS)(Hyclone公司);0.25%胰蛋白酶/EDTA(Solarbio公司);鼠抗人巢蛋白(nestin)、神经元特异性烯醇化酶(NSE)单克隆抗体及兔抗人胶质纤维酸性蛋白(GFAP)多克隆抗体(北京中杉金桥生物技术有限公司);二抗MaxVision试剂盒(福州迈新生物技术开发有限公司);小鼠抗人CD105-PE单克隆抗体(eBioscience公司);小鼠抗人 CD29-FITC、CD44-FITC、CD45-PC5、CD34-PE 及HLA-DR-FITC单克隆抗体(Beckman Coulter公司)。
1.3 仪器
3131型水套式CO2培养箱(美国Thermo Forma公司);BX-41显微成像系统(日本Olympus公司);XDZ-2型倒置显微镜(重庆精密仪器厂);超净工作台(北京半导体设备一厂);EPICS-XL4流式细胞仪(Beckman Coulter公司)。
1.4 方法
1.4.1 hUMSCs的分离与培养 在无菌条件下收取健康检测合格的足月新生儿脐带置于无菌瓶中(产妇及家属知情同意),
SD大鼠,由河北省实验动物中心提供,雄性,体重PBS冲洗脐带中残留的血液,将脐带剪至4~5 cm的小段,区分三根血管的位置(含两条动脉,一条静脉),从血管间隙剪开脐带,选取华尔通胶(Wharton胶),剪碎至1 mm3大小,置于75 cm2培养瓶中,加入培养基置于37℃,体积分数为5%的CO2培养箱中培养。1 w后首次换液,弃去未贴壁细胞,之后每3~4天换液一次。倒置显微镜下观察,待细胞生长至80% ~90%融合后,用0.25%胰酶/EDTA混合消化液消化,按1∶3传代。
1.4.2 流式细胞学鉴定细胞表面标志物 取生长状态良好的P3代hUMSCs,消化后用PBS清洗3次,进行细胞计数,调整细胞密度,使每管样品中细胞密度为5×105个/100 μl,分为A、B、C管,A样品中加入HLA-DR-FITC、CD34-PE和 CD45-PC5单克隆抗体,B样品中加入CD29-FITC和CD105-PE单克隆抗体,C样品中加入CD44-FITC单克隆抗体,同时每管样品设立同型阴性对照。4℃避光孵育30 min,PBS洗涤3次,应用流式细胞仪进行分析。
1.4.3 大鼠脑组织匀浆的提取〔3〕大鼠断头取出脑组织,置于冰上,称取湿重,按150 g/L加入DMEM/F12培养基,用匀浆器将脑组织匀浆,离心后吸取上清液,用0.22 μm微孔滤膜过滤除菌后储存于-80℃冰箱中备用。
1.4.4 脑组织匀浆诱导hUMSCs分化 将培养的第3代hUMSCs制成单细胞悬液,以1×105/ml的细胞密度接种于24孔板中,制备细胞爬片,孔内预先铺有经多聚赖氨酸处理的盖玻片,待细胞贴壁伸展后加入诱导液,并以正常培养的细胞作对照。倒置显微镜下观察细胞形态变化。于培养后的第3天,取出盖玻片进行免疫细胞化学染色鉴定nestin,NSE及GFAP的表达。
1.4.5 分化细胞的鉴定 吸弃24孔板中的培养液,取细胞爬片,PBS冲洗3次,每次3 min,4%多聚甲醛固定30 min。过氧化氢室温孵育10 min,以阻断内源性过氧化物酶的活性,PBS冲洗;滴加一抗工作液(nestin、NSE、GFAP,1∶50 稀释)室温放置1 h后置4℃冰箱过夜,PBS冲洗;滴加MaxVision二抗工作液,室温孵育15 min,PBS冲洗;DAB显色;苏木精复染,自来水冲洗;1%盐酸酒精分色;1%氨水中和;梯度酒精脱水干燥;二甲苯透明;中性树胶封片。
2 结果
2.1 hUMSCs表面抗原鉴定
经流式细胞仪检测高度表达间质细胞标志CD44、CD29和 CD105,其阳性率分别为86.0%、95.2%、93.0%,不表达造血细胞标志CD45、CD34以及人白细胞表面抗原HLA-DR,其阳性率分别为4.7%、3.8%、0.7%。
2.2 正常培养hUMSCs的增殖及形态特征
原代培养约1 w后可见大量圆形透亮细胞及贴壁生长的成纤维样细胞。首次换液后,细胞团块增值较快,以集落形式生长为主,10 d左右细胞达到80%~90%融合,主要以纺锤形细胞为主。传代后细胞生长更加迅速,24 h内即可完全贴壁,5~7 d即可达到80% ~90%融合,细胞形态均一,整体呈漩涡状,辐射状排列。见图1A。
2.3 脑组织匀浆培养对hUMSCs形态的影响
hUMSCs经脑组织匀浆培养24小时后,细胞形态即发生变化,细胞质向核收缩,胞体变小,呈不规则形或圆形。培养第3天,部分细胞可见两个或多个突起伸出,类似神经细胞,有的呈简单的双极或多极。3 d后细胞形态不再发生明显变化,见图1B。正常培养细胞未见细胞形态明显变化。
2.4 脑组织匀浆培养hUMSCs后其神经样细胞表面标志物的表达脑匀浆培养的hUMSCs经免疫细胞化学染色后在镜下可观察到:部分细胞分别呈nestin、NSE及GFAP阳性表达(细胞质呈黄色或棕黄色着色),见图2,正常培养的细胞未见表达。

图1 hUMSCs形态变化(×100)
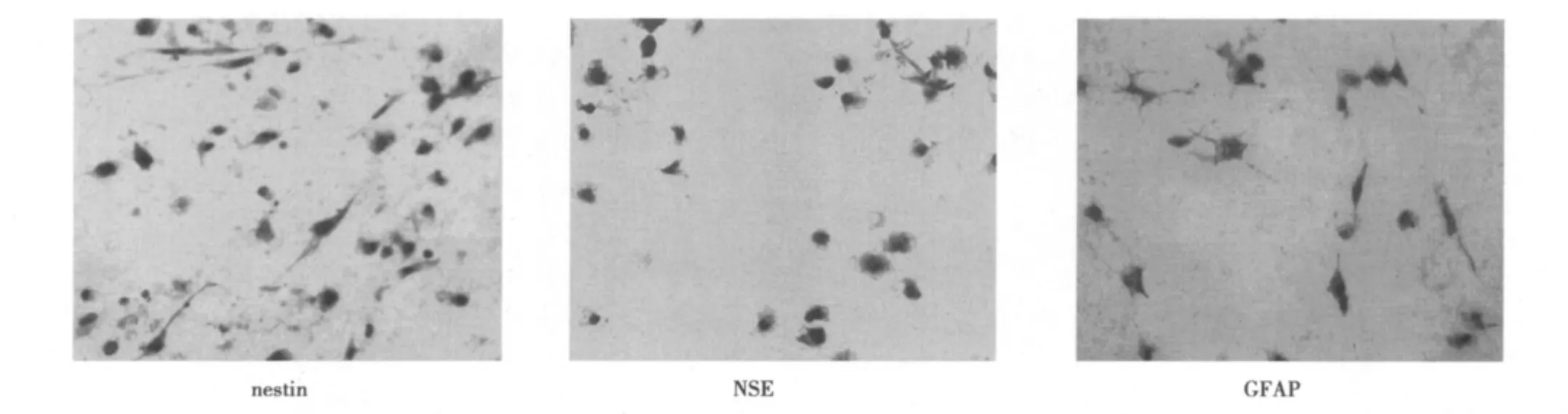
图2 诱导后部分细胞nestin、NSE、GFAP免疫表达(DAB,×400)
3 讨论
目前,在实验和临床研究中间充质干细胞的主要来源是骨髓和脐血,但均存在其自身局限性。含量很低而且细胞数量及增殖分化潜能随供着年龄的增大而下降,且骨髓的采集给供者带来痛苦,同时还存在着病毒污染的可能,因此来源受到限制。脐血来源充足,但分辨率较低,而且脐血间充质细胞所占的比例远较骨髓低〔4,5〕,限制了其在组织工程和细胞治疗中的广泛应用。脐带作为分离培养MSCs的取材来源,具有采集方便,免疫原性低,病毒污染率低,不涉及社会、法律及伦理方面争议等优点,同时研究表明脐带中干细胞的含量远远高于骨髓中的含量〔6,7〕,因此,hUMSCs成为组织工程和细胞治疗中更为理想的种子细胞。
干细胞所处的微环境决定了其增殖、分化的进程及方向〔8,9〕。国内外一些学者应用组织匀浆模拟体内局部微环境诱导间充质干细胞向特定方向分化〔10~13〕。间充质干细胞在脑组织匀浆培养条件下可向神经样细胞分化,同时分化方向正像一些学者所提出的MSCs是先分化为神经干细胞再向神经元样细胞或星型胶质细胞分化〔14〕。脑组织匀浆液中含有多种生长因子、神经营养因子、神经递质及神经甾体等活性物质,如碱性成纤维细胞生长因子、脑源性神经营养因子、肝细胞因子及谷氨酸、甘氨酸等等,他们通过独自或相互作用刺激干细胞向神经样细胞分化〔15,16〕。
近年来,干细胞研究方兴未艾,如何在体内使其分化为目的细胞适应临床需要是大家研究的重点。我们模拟机体微环境使间充质干细胞自发向神经样细胞分化,为其应用于临床治疗神经细胞损伤、神经退行性疾病如帕金森病、老年痴呆等提供了理论依据。
1 袁 源,杨树源,韩忠朝,等.人脐带间充质干细胞体外扩增和向神经样细胞定向诱导分化的研究〔J〕.中华神经医学杂志,2006;3(5):230-6.
2 Ma L,Feng XY,Cui BL,et al.Human umbilical cord Wharton's Jelly-derived mesenchymal stem cells differentiation into nerve-like cells〔J〕.Chin Med J,2005;18(23):1987-93.
3 Chen XJ,Katakowski M,Li Y,et al.Human bone marrow stromal cell cultures conditioned by traumatic brain tissue extracts:growth factor production〔J〕.J Neurosci Res,2002;69(5):687-91.
4 迟作华,张 洹.脐血间充质干细胞研究进展〔J〕.国际生物医学工程杂志,2006;29(1):29-34.
5 Bieback K,Kern S,Kluter H,et al.Critical parameters for the isolation of mesenchymal stem cell from umbilical cord blood〔J〕.Stem Cells,2004;22(4):625-34.
6 Karahuseyinoglu S,Cinar O,Kilic E,et al.Biology of stem cells in human umbilical cord stroma;in situ and in vitro surveys〔J〕.Stem Cells,2007;25(2):319-31.
7 Rahul Sarugaser,David Lickorish,Dolores Baksh,et al.Human umbilical cord peri vascular(HUCPV)cells:a source of mesenchymal progenitors〔J〕.Stem Cells,2005;23(2):220-9.
8 Spradling A,Drummond-Barbosa D,Kai T.Stem cells find their niche〔J〕.Nature,2001;414(6859):98-104.
9 Fuchs E,Tumbar T,Guasch G.Socializing with the neighbors:stem cells and their niche〔J〕.Cell,2004;116(6):769-78.
10 邓方阁,张秀英,王心蕊,等.体外模拟心肌微环境中人骨髓间充质干细胞向心肌细胞的分化〔J〕.吉林大学学报(医学版),2007;33(2):257-9.
11 王显振,蔡文清,宋永周,等.膀胱匀浆上清在大鼠骨髓间充质干细胞诱导分化为平滑肌样细胞中的作用〔J〕.中国组织工程研究与临床康复,2008;12(8):1422-5.
12 Jang YY,Collector MI,Baylin SB,et al.Hematopoictic stem cells convert into liver cells within days without fusion〔J〕.Nat Cell Biol,2004;6(6):532-9.
13 Choi KS,Shin JS,Lee JJ,et al.In vitro trans-differentiation of rat mesenchymal cells into insulin-producing cells by rat pancreatic extract〔J〕.Biochem Biophys Res Commun,2005;330(4):1299-305.
14 陈增海,马万里,高春正,等.人脐血干细胞培养及其向神经元样细胞定向诱导分化的研究〔J〕.山东大学学报(医学版),2006;44(11):1085-9.
15 Wang JM,Johnston PB,Ball BG,et al.The neurosteroid allopregnanolone promotes proliferation of rodent and human neural progenitor cells and regulates cell-cycle gene and protein expression〔J〕.J Neurosci,2005;25(19):4706-18.
16 Huang W,Miao ZN,Chen L,et al.Brain-derived neurotrophic factor,ciliary neurotrophic factory and their combination for in vitro differentiation of human umbilical blood-derived mesenchymal stem cells into nervelike cells〔J〕.J Clin Rehabil Tiss Engineering Res,2010;14(19):3606-10.
R329.24 〔
A
1005-9202(2012)07-1439-03;
10.3969/j.issn.1005-9202.2012.07.053
1 中国人民解放军白求恩国际和平医院
侯艳宁(1957-),女,博士,教授,博士生导师,主要从事神经及临床药理学研究。
王宪英(1973-),女,在读博士,副主任药师,主要从事神经药理学研究。
〔2011-05-20收稿 2011-10-12修回〕
(编辑 曹梦园)
