ICU重型颅脑损伤合并呼吸机相关肺部感染的临床研究
2012-11-20朱自修
朱自修
四川省泸州医学院附属中医院ICU,四川 泸州 646100
ICU重型颅脑损伤合并呼吸机相关肺部感染的临床研究
朱自修
四川省泸州医学院附属中医院ICU,四川 泸州 646100
目的:研究分析ICU重型颅脑损伤合并呼吸机相关肺部感染的相关因素及防治措施。方法:收集整理自2009年至2010年我院收治入重症监护病房的重型颅脑损伤患者150例,在行机械通气48h后,采用一次性无菌吸痰管在气管插管下采集的呼吸道分泌物,做细菌培养、鉴定及药敏试验。结果:本组重型颅脑损伤患者150例,感染VAP患者76例 (50.7%),其中死亡患者39例 (51.3%);无感染VAP患者63例 (42%),其中死亡患者17例 (27%),明显低于VAP感染组 (P<0.05)。呼吸道脓性分泌液细菌培养分离出病原菌284株,其中细菌241株,占84.9%。G+菌为57株,全部为金黄色葡萄球菌,其中MRSA为43株 (15.1%)。G-菌为184株,其中大部分为大肠埃希菌、铜绿假单胞菌肺炎克雷伯菌,其中大肠埃希菌为48株,其中ESBLs为37株 (13%)。真菌感染为白色假丝酵母菌43株,占15.1%。结论:ICU重型颅脑损伤行机械通气的患者并发呼吸机相关肺部感染的几率较高,且病原菌多以为革兰氏阴性菌为主。采取综合防治措施,可以有效减低重型颅脑损伤合并呼吸机相关肺部感染的发生率和病死率。
重型颅脑损伤;呼吸机相关肺部感染;相关因素
ICU重型颅脑损伤患者通常病情危重,易发生误吸及气道阻塞等,而机械通气在临床上得到广泛应用[1]。但由此引发的呼吸机相关性肺炎 (VAP)并发症为临床治疗重型颅脑损伤患者带来新的困难。为探究ICU重型颅脑损伤合并呼吸机相关肺部感染的相关因素及防治措施,我院收集整理自2009年1月至2010年12月我院收治入重症监护病房的重型颅脑损伤VAP患者150例进行细菌培养、鉴定及药敏试验。现将结果总结如下。
1 一般资料
1.1 临床资料 自2009年1月至2010年12月我院重症监护病房收治的重型颅脑损伤需行机械通气的患者150例,男94例,女56例;年龄15~50岁,平均年龄35.7岁,所有患者均住院大于48h。脑干损伤20例,脑挫裂伤或/和硬膜下血肿86例,硬膜外血肿31例,蛛网膜下腔出血13例;致伤原因:车祸伤96例,高处坠落伤19例,打击伤18例,其他伤17例。
1.2 VAP的诊断[2]所有患者入院前均无肺部感染史,患者住院应用呼吸机>48h,出现发热、呼吸道脓性分泌物,肺实变体征或/和闻及湿性啰音,外周血白细胞增高,胸部X线显示一侧或两侧肺出现新的或进行性增大的浸润性病灶,痰病原学检查阳性。
1.3 收集方法 针对重型颅脑损伤合并肺部感染患者收集呼吸道分泌物,采用琼脂进行初期细菌培养、鉴定及药敏试验,后按要求分做革兰染色和血琼脂培养,或ELISA、荧光抗体检测。采用一次性无菌吸痰管,负压管端接吸引器,在无负压状态下将吸痰管沿气管插管或套管插至患者气道远端,打开负压,见痰液收集器有分泌物后,停止负压,拔出吸痰管,密闭痰液收集器后立即送检。对病原菌分布结果进行分析,了解致病菌特点,并对可能与VAP发生相关因素进行统计学分析。
1.4 统计方法 使用SPSS16.0进行数据统计分析,以均数±标准差 (X±S)计数,数据间比较用t检验,计数数据间比较采用X2检验,检验标准为P<0.05时,数据间差异有统计学意义。
2 结果
2.1 本组重型颅脑损伤患者150例,感染VAP患者76例(50.7%),其中死亡患者39例 (51.3%)。无感染VAP患者63例 (42%),其中死亡患者17例 (27%),明显低于VAP感染组 (P<0.05)。结果见表1。

表1 重型颅脑损伤患者并发VAP及无感染VAP的发生率及病死率
2.2 病原菌构成
呼吸道脓性分泌液细菌培养分离出病原菌284株,其中细菌241株,占84.9%。培养菌中金黄色葡萄球菌57株,其中MRSA为43株。大肠埃希菌48株,其中ESBLs为37株。真菌感染为白色假丝酵母菌43株。其他呼吸道分泌物培养菌结果见表2。
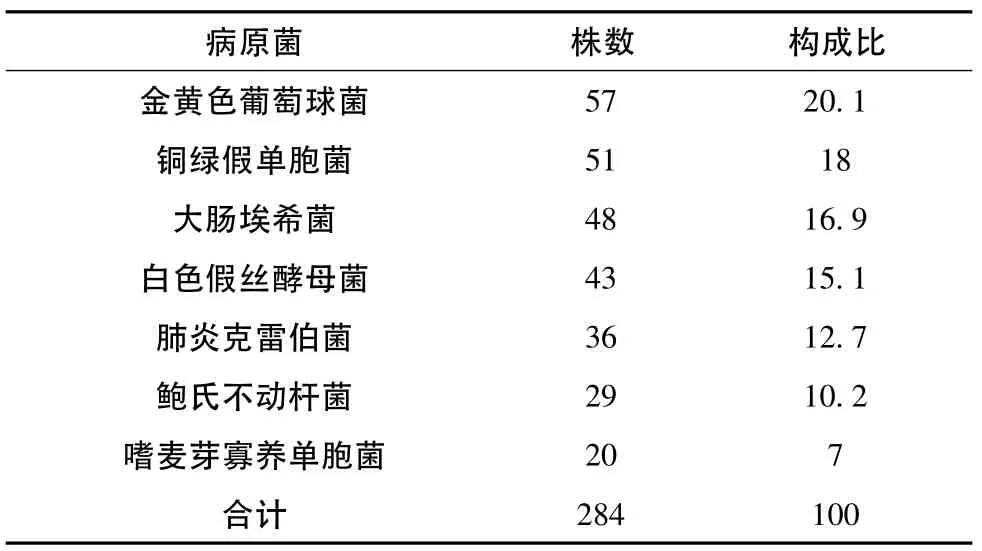
表2 呼吸道分泌物培养菌构成比 (%)
3 讨论
ICU重型颅脑损伤易合并呼吸机相关肺部感染,该并发症的发生给原发病的治疗带来了极大的困难,增加了患者的病死率[3]。有研究表明,应用持续或间歇性引流气管导管气囊上分泌物可减少早发性VAP的发生[4]。我们应尽快消除易感因素,如治疗原发病、防治交叉感染等;减少或消除内源性感染,如及时清理胃管反流物和清理口腔;增强机体免疫力,合理使用抗生素和免疫球蛋白及激素;重视病原体的鉴别和培养。
根据本研究表明,引起VAP最主要的病原菌为革兰氏阴性菌,主要是铜绿假单胞菌、大肠埃希菌、肺炎克雷伯菌、鲍氏不动杆菌。通常认为污染的细菌随呼吸机的气流形成的气溶胶或冷凝水进入气道或定值于气管插管上的病原菌是导致VAP最重要机制和途径[5]。在本研究中革兰氏阴性菌为主要致病菌,其中又以铜绿假单胞菌检出率最高,占18%。而引起VAP最多的病原菌却为金黄色葡萄球菌,而其中MRSA为43株,占15.1%。在临床工作中,一旦发现可疑病例应及早进行呼吸道分泌物检查,及早联合用药,根据检出结果进行调整。另外本研究中真菌感染所占比例较大,病原菌为白色假丝酵母菌43株,占15.1%。这与近年广谱高效抗菌药物的广泛使用、免疫抑制剂、侵入性诊疗技术的广泛应用等因素有关[6]。
综上所述,ICU重型颅脑损伤合并呼吸机相关肺部感染的发病率高,而其中主要以革兰氏阴性菌为主,我们医务人员应当密切关注,争取做到早发现,早治疗,加强医院卫生管理及药物使用。
[1]伍国强.重型颅脑损伤患者呼吸机相关性肺炎的临床特点[J].中华医院感染学杂志,2009,13(19):1649.
[2]丁青.重型颅脑损伤后呼吸机相关性肺炎的危险因素及护理[J].护理研究,2004,115(18):419.
[3]龚雅利.鲍氏不动杆菌临床分布特征及耐药性分析[J].中华医院感染学志,2008,18(3):431-433.
[4]姜悦.气管插管后气囊上液致呼吸机相关性肺炎的临床分析[J].中国危重病急救医学,2006,18(6):376.
[5]丁秀芝.重型颅脑损伤患者继发呼吸机相关肺炎的临床分析[J].现代中西医结合杂志,2010,19(25):3166-3167.
[6]孙迎娟.深部感染白色假丝酵母菌的分布及耐药分析[J].中华医院感染学杂志,2009,19(4):474-476.
ICU with severe craniocerebral injury with ventilator-related lung infection
Objective:To explore the correlation factor of the ICU with severe craniocerebral injury merger ventilator-associated lung infection and preventive measures.Methods:Collected 150 cases of severe traumatic brain injury patients in intensive care unit from 2009 to 2010,and checked the respiratory secretions after mechanical ventilation for 48h with the use of disposable sterile suction tube.Results:of 150 cases,76 of patients with VAP(50.7%),including the death of 39 patients(51.3%);63 patients(42%)was infection with VAP,in which 17 died(27%),significantly lower than that of VAP group(P <0.05).There were 284 pathogens bacteria in respiratory purulent secretion of bacterial culture,and 241 bacteria(84.9%).57 were G+bacteria all of Staphylococcus aureus,including 43 MRSA(15.1%).184 were G - bacteria,most of which were 48 Escherichia coli including 37(13%)ESBLs,Pseudomonas aeruginosa,Klebsiella pneumoniae.Conclusion:There was high risk for the patients of ICU with severe craniocerebral injury with mechanical ventilation and most were G+.Adopt comprehensive prevention and control measures can effectively reduce the incidence and mortality of severe head injury with ventilator- associated lung infections.
severe craniocerebral injury;ventilator-associated lung infections;relevant factors
R651.15
A
1007-8517(2012)15-0020-02
2012.05.18)
