婴幼儿疑似甲型H1N1重症病例及门诊流感样病例中鼻病毒的检测分析*
2012-11-20于新芬潘劲草李品艳周银燕
于新芬,潘劲草,寇 宇,李品艳,叶 榕,周银燕
2.温州医学院,温州 325035
鼻病毒(rhinovirus,RV)在分类上属小RNA病毒科,是一组单正链的RNA病毒。鼻病毒基因组约7.2kb,包括5′非编码区,一个编码衣壳蛋白(VP4、VP2、VP3、VP1)及7个非结构蛋白(2A、2B、2C、3A、3B、3C、3D)的大的开放阅读框,终止于3′UTR及聚合 A尾巴[1]。人鼻病毒(human rhinovirus,HRV)现分为3个基因型:HRV-A 、HRV-B及最新发现的HRV-C。自2006年起,美国、澳大利亚、香港等地陆续在急性呼吸道感染病例中发现了HRV-C基因型,HRV-C与 HRV-A 及 HRV-B在氨基酸水平上具有53%~57%的一致性[2-3]。
鼻病毒除感染人,还可感染马、牛等动物。人鼻病毒是引起人类病毒性呼吸道感染最常见的病原体,有120多个血清型。某些动物鼻病毒也能使人感染发病。鼻病毒可引起较大规模的暴发流行,引起哮喘、细支气管炎及致命性肺炎,具有一定的死亡率[4-5]。HRV-C感染引起的肺炎、哮喘加重、喘息的严重性较其他2个亚型具有显著性差异[6]。HRV在婴幼儿呼吸道感染及发病率方面,历史以来重视不够。但随着核酸检测技术的发展,越来越多的研究表明,HRV已在婴幼儿呼吸道感染中产生明显的疾病负担。
2009年甲型H1N1流感流行,很多疑似甲型H1N1重症病例/危重病例病原学不明,本文对杭州市部分婴幼儿疑似甲流重症病例及门诊流感样病例进行了鼻病毒的检测。鼻病毒5′端非编码区(5′UTR)及衣壳蛋白编码区VP2-VP4常用于鼻病毒的检测及鉴定。本文对其5′UTR和/或VP2-VP4基因进行了比对分析,以了解鼻病毒在不同样本中的感染、流行、分子进化及其他呼吸道病毒的合并感染情况,同时了解HRV,特别是 HRV-C在呼吸道感染病例重症化中的作用。
1 材料与方法
1.1 标本来源样本 1组为由杭州市各医院及各辖区县疾控中心采集送检的疑似甲流重症病例246份[2009年11月至2011年3月;甲型H1N1流感重症病例定义参考甲型H1N1流感诊疗方案(2009年第3版)],采集标本共计246份,其中咽拭子225份,气管吸取物14份,鼻咽吸取物7份,样本均采集于甲型流感H1N1流行期。样本2组为门诊流感样病例68份[2010年11月至2011年3月;流感样病例定义参考全国流感监测方案(2010年版)],来源于某儿童医院流感监测点,为咽拭子,采集于甲型H1N1流感流行期。两组样本均采集于冬春季节的甲型H1N1流感流行期,年龄≤6岁。样本储存于-70。C冰箱。
1.2 试剂 PrimeScript II 1st Strand cDNA Synthesis Kit(Takara),EX Taq酶(Takara),QIAGEN RNA 提 取 试 剂 盒,One Step PrimeScript○RRT-PCR Kit(Takara),QIAGEN DNA mini kit。
1.3 引物及探针 扩增引物及探针见表1,由大连Takara公司合成。

表1 引物及探针Tab.1 Primers and probes
1.4 核酸提取 使用QIAGEN DNA mini kit试剂盒提取病毒DNA,使用QIAGEN Rneasy mini提取试剂盒提取病毒RNA,操作步骤严格按照说明书进行。最后将核酸溶解于50μL ddH2O中。
1.5 逆转录及PCR检测
1.5.1 逆转录 使用 PrimeScript II 1st Strand cDNA Synthesis Kit(Takara)进行反转录反应,反应体系为:1μL 50ng/μL的6-mer随机引物,1μL dNTP(10mmol/L each),8μL提取的 RNA,混匀置65。C5min,冰上迅速冷却。再加入反应液:4μL 5×PrimeScript II Buffer,0.5μL RNase Inhibitor(40U/μL),1μL PrimeScript II RTase(200U/μL),ddH2O 4.5μL。30。C10min,42。C60min进行反转录反应,70。C15min灭活酶,置冰上冷却。cDNA保存于-30。C冰箱。
1.5.2 鼻病毒5′UTR和 VP2-VP4编码区的扩增
分别以DK001/DK004和VPF/VPR为引物进行PCR。25μL体系中加入1μL cDNA作为模板。PCR反应条件:95。C5min,95。C15s,50。C15 s,72。C60s,35 个循环。5′UTR和 VP2-VP4编码区扩增产物长度分别为390bp和547bp。
1.5.3 肠道病毒扩增 以肠道通用引物探针(EVF、EVR、EVP)进行 PCR。对鼻病毒引物DK001、DK004扩增阳性的样本,用肠道通用引物探针进行实时PCR扩增。PCR反应条件:50。C2 min;95。C2min;95。C15s,55。C30s,45个循环。于55。C检测通道的荧光信号。
1.6 其他呼吸道病毒的检测 为了解鼻病毒的合并感染情况,对鼻病毒阳性样本进行了呼吸道合胞病毒(RSV),流感病毒(IV),腺病毒(AV),副流感(PIV)1-4型以及冠状病毒(HCoV)(HKU1、OC43、229E、NL63),偏 肺 病 毒 (hMPV),博 卡 病 毒(HBoV)的筛查[10-12]。
1.7 基因测序 将鼻病毒5′端UTR及VP2-VP4编码区扩增阳性的PCR产物送上海生工进行双向测序,于NCBI上进行序列比对。
1.8 进化树分析 测序结果用Clustal X和Mega4.1软件进行拼接和分析。多序列比对使用ClustalW进行。
2 结 果
2.1 样本的流感检测情况 样本1组中流感阳性率为32.5%(80/246),其中甲型 H1N1阳性样本为73份,占流感阳性样本的91.2%(73/80),B型流感阳性样本为7份。样本2组中流感阳性率为30.8%(21/68),其中甲型 H1N1阳性为16份,B型流感阳性为1份,H3N1流感阳性为4份。
2.2 鼻病毒的检测结果及分析 使用引物DK001及DK004扩增鼻病毒5′UTR,样本1组中23份为阳性,样本2组中16份为阳性。由于该对引物可以扩增出一些肠道病毒[7],因此使用肠道通用引物探针对以上39份阳性样本进行检测,其中样本1组中2份为肠道病毒阳性。样本2组中5份为肠道病毒阳性。
本研究同时对鼻病毒5′UTR和/或VP2-VP4编码区进行了序列测定,成功测序14份样本;同时我们也对检测出的肠道病毒进行了测序,成功测序6份样本。测序鉴定结果见表2。经NCBI BLAST比对,该测序结果与核酸检测结果完全对应。对于鼻病毒的鉴定,使用引物DK001及DK004扩增5′UTR后,对阳性样本进行肠道病毒检测,肠道病毒检测阴性的样本即为鼻病毒阳性。1组样本鼻病毒阳性率为8.54%(21/246),2组样本鼻病毒阳性率为16.2%(11/68)。
本研究中12份样本对鼻病毒的5′UTR及VP2-VP4片段均进行了测序。该部分样本的5′UTR测序鉴定结果与VP2-VP4测序鉴定结果具有完全一致性。由呼吸道咽拭子样本中鉴定出的肠道病毒主要包括Echo09、柯萨奇A6、柯萨奇A10、柯萨奇B3等肠道病毒,见表2。4份样本检出HRV-C阳性,其中样本1组1份阳性,年龄6M,该样本同时合并感染甲型H1N1;样本2组中3份阳性,年龄分别为3M、13M、19M,无合并感染。
2.3 各年龄段HRV的检出情况 在样本1组中,21例阳性病例中年龄最小50d,最大6岁。1岁以下检出率最高,占HRV总阳性病例的47.6%。随着年龄的增大HRV检出率有所降低。样本2组中,11份阳性病例中年龄最小3个月,最大6岁。1岁以下阳性病例占总阳性病例的54.5%。经过χ2检验,P>0.05,样本1组和样本2组各年龄段的检出情况之间没有统计学差异。各年龄组检出情况见表3。
2.4 鼻病毒进化树分析 VP2-VP4扩增片段为547bp,对其内的430bp(EF173417,615-1044)进行了比对分析。使用Clustal X和Mega4.1软件进行拼接和进化树分析。结果见图1。

图1 鼻病毒VP2-VP4进化树分析Fig.1 Phylogenetic tree of HRV strains based on analysis of VP2-VP4

表2 测序鉴定结果表Tab.2 Sequencing results
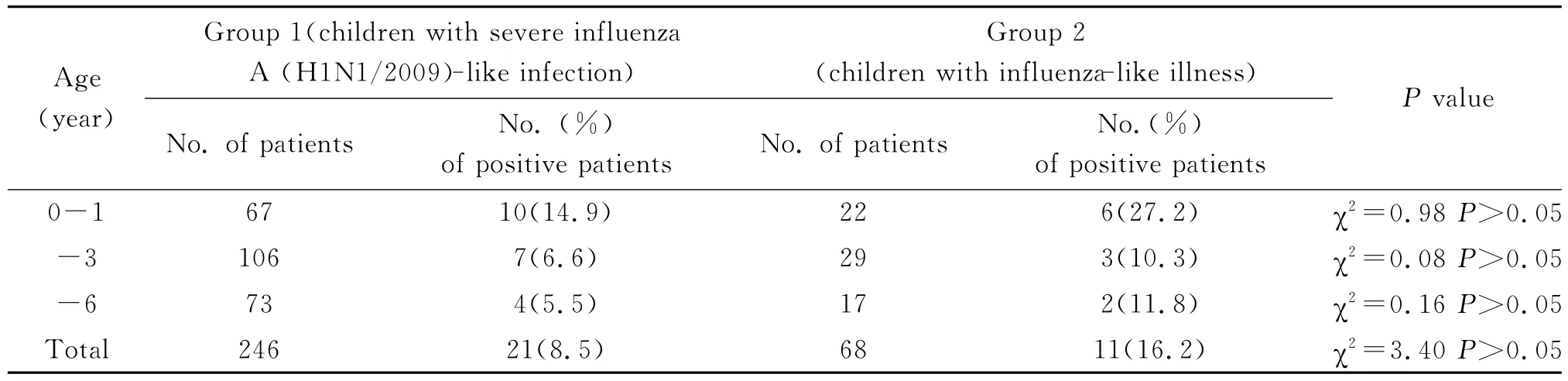
表3 二组样本各年龄段HRV的检测情况Tab.3 HRV detection analysis between the two groups according to age
通过与参考序列比对,样本09-9、09-109、09-119、10-120、09-D37、09-D60、10-919、10-921 为HRV-A基因型,各样本间的核苷酸序列一致性为60%~98%。09-54为 HRV-B基因型。09-D49、10-846、10-850、11-B3为 HRV-C基因型,各样本间的核苷酸序列一致性为67%~73%。10-896虽然只进行了5′UTR测序,但经BLAST比对为HRVA基因型。在14份成功进行HRV测序的样本中,HRV-A、HRV-B、HRV-C基因型所占比例分别为64.3%、7.1%和28.6%。
本研究测序的HRV样本中,对430bp(EF173417,615-1044)进行了多序列比对分析,HRV-A、HRV-B间的核苷酸序列一致性为58%~62%,HRV-A、HRV-C间的核苷酸序列一致性为58%~65%,HRV-B、HRV-C间的核苷酸序列一致性为55%~58%。
2.5 鼻病毒合并感染情况分析 对鼻病毒阳性样本进行了呼吸道合胞病毒(RSV)、流感病毒(IV)、腺病毒(AV)、副流感(PIV)1-4型以及冠状病毒(HCoV)(HKU1、OC43、229E、NL63)、偏肺病毒(hMPV)、博卡病毒(HBoV)的筛查。样本1组和样本2组的合并感染率分别为71.4%(15/21)、9.09%(1/11)。经过χ2检验(Fisher确切概率法),发现两组样本的合并感染情况在0~1和~6岁年龄组间均有统计学差异(P<0.05)。与鼻病毒合并感染最多的是甲型H1N1流感,其次是RSV。结果见表4。
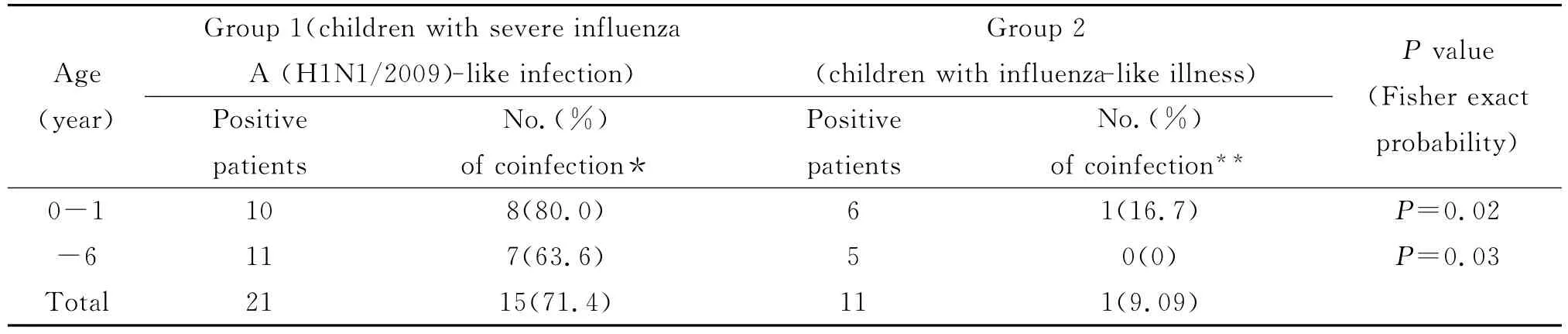
表4 两组样本鼻病毒阳性中合并其他病毒感染情况分析Tab.4 Analysis on the coinfection for HRV with the other respiratory viruses
3 讨 论
国内对HRV的感染情况研究较少。赵林清[13]、江文辉[14]等分别对北京、广州地区的儿童急性呼吸道感染中病例中进行鼻病毒的检测及分析,但均未进行HRV-C检测分析。Xiang Z等[15]从下呼吸道感染儿童病例中检测到 HRV-C型(14/258),且具有较高的合并感染率(8/14)。Jin Y等[8]也从急性呼吸道感染病例样本中检测到HRV-C型(19/406)。2009年甲型H1N1流感流行,很多疑似甲型H1N1重症病例/危重病例病原学不明,本文对杭州市部分婴幼儿疑似甲流重症病例及门诊流感样病例进行了鼻病毒的检测。
鼻病毒具有120多个血清型,核酸序列变异较大。Kiang D等报道[7],据鼻病毒5′UTR 310bp,对102个不同血清型鼻病毒的两两核酸变异性分析表明,核酸变异范围为0.3%~63.3%。本研究对VP2-VP4的430bp的序列进行两两比对,HRV在该段的核苷酸序列一致性为55%~98%。HRV核酸序列变异大,使用实时荧光RT-PCR的方法进行检测难度较大。本研究参考Kiang D等报道的引物DK001/DK004扩增5′端非编码区可检测到所有的鼻病毒,但因为鼻病毒和肠道病毒具有较近的亲缘关系,该套引物同时也扩增出部分肠道病毒。鉴于鼻病毒与肠道病毒较近的亲缘关系,有些研究将鼻病毒和肠道病毒的检测一起进行分析[11]。本研究对DK001/DK004扩增阳性的样本再使用肠道通用引物探针进行检测,肠道病毒检测阴性的样本即为鼻病毒阳性。该结果与20份样本的的测序鉴定结果完全一致。同时经测序分析,检测到Echo09、柯萨奇A6、柯萨奇A10、柯萨奇B3等肠道病毒,说明肠道病毒在呼吸道感染中的复杂性和多样性。
本文的鼻病毒分型结果为 HRV-A、HRV-B、HRV-C基因型所占比例分别为64.3%、7.1%和28.6%。样本1组中 HRV-A、HRV-B、HRV-C基因型所占比例分别75%、12.5%、12.5%。样本2组中 HRV-A、HRV-B、HRV-C基因型所占比例分别50%、0%、50%。总的来说,杭州婴幼儿疑似甲流重症病例及门诊流感样病例中HRV主要是以HRV-A、HRV-C基因型为主,HRV-B基因型相对较少。且HRV在疑似甲流重症病例中主要是以合并感染为主,合并感染率高达71.4%,且有1份是与B型流感及PIV1的三重感染。鼻病毒在疑似甲流重症病例的感染中多以合并感染为主,说明病毒合并感染在疑似甲流重症病例中的复杂性,也提示可能鼻病毒在病例的重症化中起到一定的作用。
HRV-C型是近年新发现的基因型,HRV-C病人的主要症状,有的仅表现为流感样病例症状,有的则引起支气管炎、肺炎、呼吸困难、哮喘加重、危及生命等[2-3]。本文共鉴定出4株 HRV-C型鼻病毒,1株来源于样本1组,是与甲型H1N1病毒合并感染。另外3株来源于样本2组,无合并感染,表现为流感样病例。本研究对VP2-VP4其中430bp进行分析比对,4个 HRV-C型样本中与 HRV-A 及HRV-B相比均有连续6个碱基的缺失。
Huang T等在 HRV-C中发现大量多重重组[1],HRV-A 和 HRV-C共感染可能是产生病毒重组的原因。鼻病毒重组能力将导致极大的病毒多样性,从而使鼻病毒诊断和检测更加困难。鼻病毒血清型多、基因变异大、且难以培养等原因,其部分血清型引起的严重的临床症状与发病模式之间的流行病学资料较少,有待于进一步深入研究。
[1]Huang T,Wang W,Bessaud M,et al.Evidence of recombina-tion and genetic diversity in human rhinoviruses in children with acute respiratory infection[J].PLoS One,2009,4(7):e6355.
[2]Lau SK,Yip CC,Tsoi HW,et al.Clinical features and complete genome characterization of a distinct human rhinovirus(HRV)genetic cluster,probably representing apreviously undetected HRV species,HRV-C,associated with acute respiratory illness in children[J].J Clin Microbiol,2007,45(11):3655-3664.
[3]McErlean P,Shackelton LA,Lambert SB,et al.Characterisation of a newly identified human rhinovirus,HRV-QPM,discovered in infants with bronchiolitis[J].J Clin Virol,2007,39(2):67-75.
[4]Louie JK,Yagi S,Nelson FA,et al.Rhinovirus outbreak in a long term care facility for elderly persons associated with unusually high mortality[J].Clin Infect Dis,2005,41(2):262-265.
[5]Hicks LA,Shepard CW,Britz PH,et al.Two outbreaks of severe respiratory disease in nursing homes associated with rhinovirus[J].J Am Geriatr Soc,2006,54(2):284-289.
[6]Lau SK,Yip CC,Lin AW,et al.Clinical and molecular epidemiology of human rhinovirus C in children and adults in hong kong reveals a possible distinct human rhinovirus C subgroup[J].J Infect Dis,2009,200(7):1096-1103.
[7]Kiang D,Kalra I,Yagi S,et al.Assay for 5'Noncoding region analysis of all human rhinovirus prototype strains[J].J Clin Microbiol,2008,46(11):3736-3745.
[8]Jin Y,Yuan XH,Xie ZP,et al.Prevalence and clinical characterization of a newly identified human rhinovirus C species in children with acute respiratory tract infections[J].J Clin Microbiol,2009,47(9):2895-2900.
[9]严菊英,卢亦愚,徐昌平,等.肠道病毒TaqMan荧光定量RTPCR法快速检测[J].中国公共卫生,2007,23(7):818-820.
[10]Yu XF,Pan JC,Ye R,et al.Preparation of armored RNA as a control for multiplex Real-Time Reverse Transcription-PCR detection of influenza and severe acute respiratory syndrome coronavirus[J].J Clin Microbiol,2008,46(3):837-841.
[11]Raymond F,Carbonneau J,Boucher N,et al.Comparison of automated microarray detection with Real-Time PCR assays for detection of respiratory viruses in specimens obtained from children[J].J Clin Microbiol,2009,47(3):743-750.
[12]Damen M,Minnaar R,Glasius P,et al.Marjolein Damen.Real-Time PCR with an internal control for detection of all known human adenovirus serotypes [J].J Clin Microbiol,2008,46(12):3997-4003 .
[13]赵林清,钱渊,朱汝南,等.北京地区2002-2006年急性呼吸道感染儿童中鼻病毒感染的研究[J].中华流行病学杂志,2007,28(7):683-685.
[14]江文辉,陈羿,张莹莹,等.广州地区儿童急性呼吸道鼻病毒感染的临床研究[J].中国儿童保健杂志,2008,16(4):418-419.
[15]Xiang Z,Gonzalez R,Xie Z,et al.Human rhinovirus group Cinfection in children with lower respiratory tract infection[J].Emerg Infect Dis,2008,14(10):1665-1667.
