原子吸收分光光度法测定法罗培南钠中的钯
2012-11-16周浩成砚萍崔艳吴蓓静孙虔
周浩 成砚萍 崔艳 吴蓓静 孙虔
(江苏正大天晴药业股份有限公司 江苏连云港 222006)
2008年2月21日EMEA/CHMP/SWP颁布了金属残留量限度的指导文件,并于2008年9月1日在欧盟实施,文件认为,在原辅料合成中用到的金属催化剂或金属试剂可能在原料药中残留并带入制剂中,这些残留金属通常无治疗作用,基于安全性需要进行严格控制。EMA把金属催化剂按风险级别分类管理[1],钯作为第1类金属1A亚组,有显著安全担忧,规定注射用原料药中不得过1μg·g-1。本公司生产的法罗培南钠在合成工艺中使用钯/炭催化剂,如用ChP重金属检查法[2],测定的是总重金属,无法单控钯残留量,需采用专属性更强的原子吸收分光光度法[3]。为此,对钯残留测定方法进行研究并制定标准,同时为其它种类原辅料中的钯残留测定提供技术参照。
1 仪器与试药
岛津AA-6800型原子吸收分光光度计,ASC-6100型自动进样器。
钯标准液(上海市计量测试技术研究院,0.100g·L-1,批号:1004)
法罗培南钠原料药(正大天晴,批号090701、090702、090703)
2 原子吸收分光光度法
2.1 光谱参数和原子化条件
钯空心阴极灯,检测波长:247.6nm;背景校正:D2灯;狭缝宽度:0.5nm;石墨炉原子化器;热解石墨管;高纯氩气,采用石墨炉升温程序。
2.2 专用溶剂
配制1%盐酸并含0.2%EDTA的溶液,即得。
2.3 供试品溶液
取样品50mg,精密称定,置10mL量瓶中,溶解并稀释至刻度,摇匀,即得(含法罗培南钠5mg·mL-1)。
2.4 标准品溶液
精密量取钯标准液(0.100g·L-1)1.0mL,置200mL量瓶中,稀释至刻度,摇匀,作为对照品储备溶液(500ng·mL-1)。
精密量取标准品储备溶液适量,再稀释制成规定浓度的溶液,作为标准品溶液。
2.5 专属性
(1)选择钯空心阴极灯,检测波长:247.6nm,本身就是钯吸收的专属特性。
(2)取过量样品,用专用溶剂反复清洗烘干后制备阴性对照溶液,结果阴性对照溶液基本无吸收,表明法罗培南钠本身无干扰。
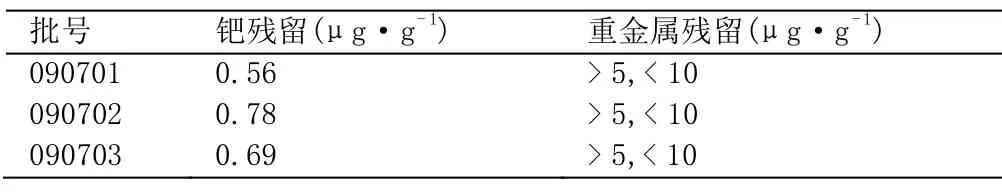
表1 样品测定结果
2.6 检测限
取标准品溶液(10ng·mL-1),逐级稀释,分别测定,当吸光度为专用溶剂吸光度(0.0054)的2~3倍时的溶液浓度,作为钯的检测限,结果检测限为1.25ng·mL-1。
2.7 线性关系
取钯标准品溶液(浓度C分别为2、10、20、30、40、50ng·mL-1),分别测定吸光度(A),结果钯进样浓度2~50ng·mL-1内线性良好,线性方程A=0.0043C+0.0014r=0.9991。
2.8 系统精密度
取钯标准品溶液(20ng·mL-1)连续测定6次,结果RSD=0.8%,表明本法系统精密度良好。
2.9 方法重复性
取样品(批号:090701),制备5份供试品溶液,分别测定,结果钯平均残留量0.56μg·g-1,RSD=1.2%,表明本法重复性良好。
2.10 回收率
分别精密称取样品(批号:090701)6份各约25mg,分别加入标准品溶液(50ng·mL-1)0.25mL,置10mL量瓶中,溶解并稀释至刻度,分别测定,结果平均回收率=100.7%(n=6),RSD=1.40%,明回收率良好。
2.11 样品测定
对本公司生产的共3批样品进行了测定,同时参照ChP测定总重金属,结果见表1。
3 讨论
(1)目前ChP中还没有钯残留的单独控制方法,本法经开发,有利于提高药品安全性,也可以为其它原料药提供方法参照。
(2)注射用原料药要求钯残留不得过1μg·g-1,总重金属限度为10μg·g-1,仅仅测定总重金属,不能保证样品的安全性。
[1]EMEA/CHMP/SWP/4446/2000 (final).Guideline on the specification limits for residues of metal catalysts ormetal reagents.Committee for Medicinal Products for Human Use (CHMP)[J].London,2008.
[2]ChP(中国药 典)(二部)[S].2010.Appendix(附录)IV D:24.
[3]石克,谢静,罗立骏,等.原子吸收分光光度法测定制何首乌中的铁黑[J].药物分析杂志,2011,31(3):583~585.
