单耐利福平结核分枝杆菌耐药分子机制研究
2012-11-16逄宇李桂莲王玉峰宋媛媛李强欧喜超董海燕赵雁林
逄宇 李桂莲 王玉峰 宋媛媛 李强 欧喜超 董海燕 赵雁林
结核病是全世界范围内最主要的传染病之一[1]。半个世纪前,由于使用了抗结核药物,结核病疫情得到一定的控制[2]。然而,由于耐药结核病,特别是耐多药(multi-dr ug resistant,MDR)结核病的出现影响了结核病的有效治疗和控制[3]。因此,理解Mtb耐药机制对于解决上述问题具有重要意义。目前已经有大量研究揭示了Mt b的分子生物学和遗传学的耐药机制,包括利福平(r poB)、异烟肼(kat G、inh A 等)、链 霉 素 (rsp L、rrs 等)、喹 诺 酮(gyr A 和gyr B)等[4]。
RFP是目前最主要的一线抗结核药物,同时也是组成有效治疗方案并决定治疗效果的关键因素,文献表明对RFP耐药的菌株中大多数也对INH耐药[5],因此研究Mtb对RFP的耐药机制对结核病,尤其是是耐RFP和MDR患者的治疗有着重要意义。RFP通过与Mtb RNA聚合酶的β亚基(由r poB编码)相结合从而抑制RNA的合成。文献报道表明约有90%以上的RFP耐药性是由于r poB基因的81-bp(编码密码子507-533位)的RFP耐药决定区(rifampicin resistance deter mining region,RRDR)的突变引起[6]。但是携带RRDR区不同位点突变的菌株最低抑菌浓度(mini mu m inhibitor y concentration,MIC)存在较大差别。本研究通过选取单耐RFP菌株探究不同r poB的突变类型与MIC的关系,同时在单耐药菌株中确定与RFP耐药有关的药物外排泵基因。
材料和方法
一、菌株和培养条件
本研究菌株来自2007—2008年全国结核病耐药基线调查[1],总计约4000株菌株中分离获得单耐RFP菌株23株。所有分离株存放于10%甘油的苏通培养基,并置于-70℃冰箱中。在进行药敏实验前将冻存菌株在改良中性罗氏培养基上复苏4周。
二、罗氏培养基比例法药物敏感度实验和菌种鉴定
罗氏培养基比例法药物敏感度实验和分枝杆菌菌种鉴定参照文献[1]进行。培养基内药物的终浓度分 别 为:INH 0.2μg/ml、RFP 40μg/ml、S 4μg/ml、EMB 2μg/ml、Km 30μg/ml、Of x 2μg/ml。利用对硝基苯甲酸生长实验和噻吩-2-羧酸肼生长实验对分枝杆菌菌种进行鉴定,培养基内药物浓度为:对硝基苯甲酸500μg/ml、噻吩-2-羧酸肼5μg/ml。
三、DNA标本制备
无菌生理盐水洗下菌株新鲜培养物,吸取菌悬液1 ml于无菌Eppendorf扣盖离心管中,80℃30 min灭活,离心去上清,菌体沉淀用500μl TE缓冲液(p H 8.0)充分悬浮,95℃水浴1 h,10 000×g离心15 min,取上清即为PCR扩增模板。
四、r poB基因的扩增和测序
用表1所示引物扩增rpoB基因,PCR产物大小为450 bp,含81 bp的RRDR区。扩增体系如下:5μl PCR Buffer,2 mmol MgSO4,200μmol d NTP,两条引物各0.2μmol,2μl基因组 DNA 及0.5μl Trans Hi Fi Taq酶。反应条件:预变性94℃5 min;循环94℃1 min,60℃1 min,72℃30 s 35个循环;72℃ 延伸10 min。PCR产物送擎科公司用ABI3730测序仪进行测序。测序结果采用在线比对软件http://blast.ncbi.nl m.nih.gov/Blast.cgi与标准敏感株H37 Rv基因序列进行比对。

表1 本研究中用于PCR扩增和测序的引物

续表1
五、Mt b MIC测定
按照文献[7]所述选用微孔板Alamar Blue法进行检测。
六、细菌总RNA的制备及反转录合成c DNA
Mtb在7 H9液体培养基上37℃培养28~32 d后,收集菌体,参照文献[8],采用Trizol法提取总RNA,并反转录成c DNA。
七、real-ti me PCR
采用SYBR法real-ti me PCR试剂盒(全式金生物技术有限公司生产)试剂盒,反应体系为20μl,按照文献[9],选用表1所述引物对扩增目的基因。内参基因为DNA聚合酶编码基因pol A[8]。
八、大肠埃希菌表达载体构建及转化
扩增Rv2936、Rv0783和Rv0933完整读码框,将片段连入p EASY-E1原核表达载体中,阳性克隆送擎科公司测序验证。阳性克隆转化入大肠埃希菌BL21菌株。
九、大肠埃希菌MIC测定
[10],采用微孔板Alamar Blue法进行检测。
结 果
一、菌株耐药相关基因的测序结果
选取的23株单耐RFP菌株,发生r poB突变16株,突变率69.6%,其中包括531、526和511等3种突变位点类型,其所占比例分别为39.1%(9/23)、26.1%(6/23)和4.3%(1/23)。根据突变密码子的改变情况,531 TCG(Ser)→TTG(Leu)9株(39.1%);526CAC(His)→GGC(Gly)和526CAC(His)→GAC(Asn)各2株(8.6%);526CAC(His)→CTC(Leu),526CAC(His)→CGC(Ar g)和 533 CTG(Leu)→CCG(Pr o)各1株(4.3%),见表2。
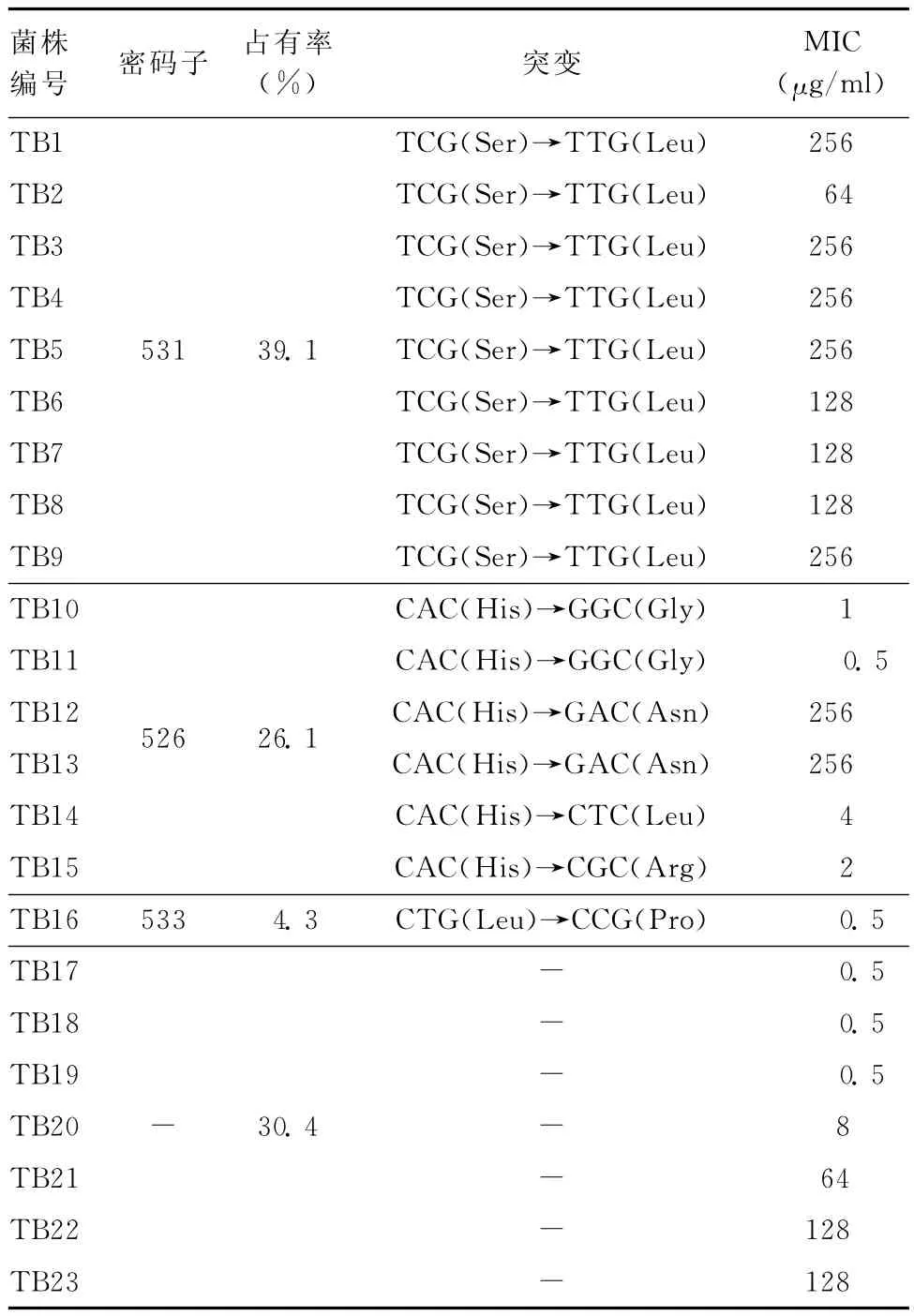
表2 单耐RFP菌株中的突变和MIC统计表
二、不同r poB突变类型对RFP耐药情况的影响
根据不同突变类型密码子的改变情况,笔者统计了不同突变对RFP MIC的影响,结果如表3所示。其中突变类型Ser531Leu、His526 Asp表现为高浓度耐药,其MIC分别为192μg/ml和256μg/ml;而突变类型 His526Gly、His526Leu、His526 Ar g和Leu533Pr o表现为低浓度耐药,其MIC分别为0.75μg/ml、4μg/ml、2μg/ml和0.5μg/ml。
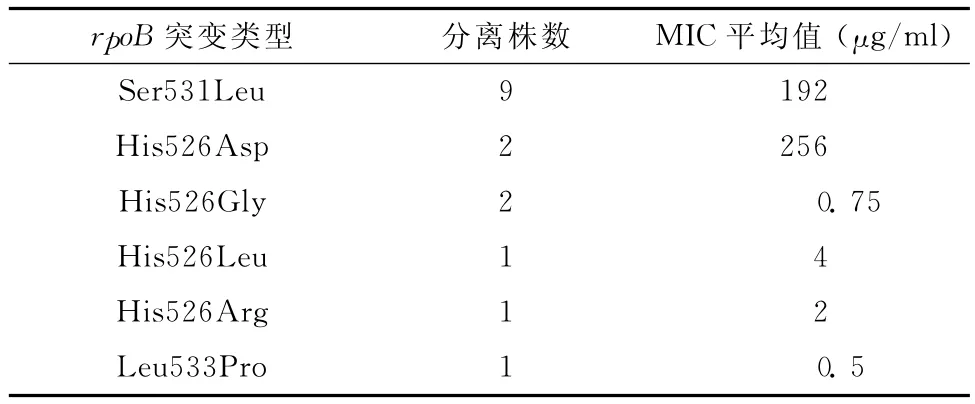
表3 不同r poB突变类型对RFP耐药的影响
三、不同药物外排泵基因在7株r poB无突变耐药株中的表达差异
与标准株H37Rv相比,各耐药株按照其MIC由低到高排列。如图1所示,real-ti me PCR结果表明随着耐药程度的升高,20个药物外排泵基因表现出不同的转录谱,其中Rv2936、Rv0783和Rv0933的转录水平与MIC正相关,高浓度耐药的TB22和TB23两株菌株中,上述3个基因的表达水平明显高于其他菌株;而其他17个药物外排泵基因的转录水平与MIC浓度无明显关系。

图1 不同菌株外排泵基因转录水平分析
四、转基因细菌对RFP耐药情况的改变
在转入p EASY-E1的对照组中,大肠埃希菌对RFP表现出一定的天然耐药性,其MIC为8μg/ml,分别转入p EASY-E1-Rv2936和p EASY-E1-Rv0783的大肠埃希菌的MIC均有不同程度的提高,分别为32μg/ml和16μg/ml,而转入p EASY-E1-Rv0933的大肠埃希菌 MIC为8μg/ml,见表4。

表4 过表达Rv2936、Rv0783和Rv0933对大肠埃希菌RFP MIC的影响
讨 论
RFP是目前应用最为广泛的抗结核药物,其作用靶标为Mtb中DNA依赖的细菌RNA聚合酶β亚基,通过与其结合,干扰并抑制细菌RNA的合成,进而抑制细菌的生长繁殖导致细菌的死亡[6,11]。r poB突变,特别是RRDR区的突变导致Rpo B蛋白的结构改变,从而影响了RFP与药物靶标的结合效果,进而使Mt b产生耐药性。本次选取23株单耐RFP的研究中,有16株检测到r poB基因突变,其中包括3种突变类型,涉及6种氨基酸变化。在所有检测到r poB突变的菌株中,531位点和526位点突变率之和为93.8%(15/16),这2个位点在耐RFP菌株中的突变频率较高,这与其他研究结果类似[6,12-13]。
此外,本研究发现r poB基因不同位点的突变导致的耐药水平是不同的,这在先前有过报道。首先,对于531位点而言,丝氨酸变为亮氨酸导致Mt b高浓度耐药。丝氨酸属于极性中性氨基酸,而亮氨酸属于非极性疏水性氨基酸,2种氨基酸在生化性质方面存在较大差异,因此推测可能对RpoB蛋白结构影响较大,从而诱发高浓度耐药。其次,本研究中526位点突变包括4种类型,其中野生型526位点应为组氨酸,组氨酸为一种碱性氨基酸,当其突变为极性中性的天冬酰胺时,产生的突变菌株的MIC达到256μg/ml;而当组氨酸突变为非极性疏水性的亮氨酸和脯氨酸或突变为碱性的精氨酸时,突变菌株的MIC均低于4μg/ml,上述结果提示对于526位点,由碱性氨基酸突变为极性中性氨基酸时对rop B蛋白质结构影响要大于突变为非极性疏水性氨基酸或其他碱性氨基酸;再次,对于533位点,当由非极性疏水性的亮氨酸突变为同类型的脯氨酸时,对MIC的影响较小。以上的结论仅是基于耐药菌株的耐药表型的推测,需要得到结构生物学的研究结果的进一步证实。
药物外排泵是微生物耐药的一种重要机制,细菌外排泵的功能和结构生物学研究是目前热点之一,然而对 Mt b外排泵研究还处于探索阶段[4,14]。目前已有研究克隆获得部分可能与非结核分枝杆菌耐药相关的外排泵基因,其中包括与喹诺酮耐药相关 的 Lf r A[15]和 Rv2686-Rv2687-Rv2688[16],与INH 耐药相关的 mmp L-7[17]和ini A[18],与氨基糖苷类耐药相关的P55[19]等,此外也有文献报道Rv1410和Rv2136与INH、RFP或S的联合耐药相关[9,20]。本研究选用单耐RFP菌株,目的在于寻找RFP耐药相关的药物外排泵基因,通过对r poB基因的测序,排除了药物靶标基因改变对耐药性影响。进一步对20个外排泵基因转录水平进行研究,发现Rv2936、Rv0783和Rv0933在高耐药菌株中的表达水平高于低耐药菌株及敏感株H37 Rv,推测上述3个药物外排泵基因可能与RFP耐药相关;进一步通过转基因实验研究证实,Rv2936和Rv0783可能将RFP从菌体泵出致使菌内浓度减少,从而使Mtb对RFP的耐药性增加。有研究表明,在r poB 531突变的菌株中,伴有Rv0783转录水平显著提高(与全敏感组相比)。本研究进一步证实Rv0783和Rv2936可能是RFP耐药相关的药物外排泵基因,其中首次报道Rv2936作为RFP耐药相关的药物外排泵。Rv0933属于ABC家族转运蛋白,该家族蛋白在原核细胞和真核细胞中均有发现,并且负责跨膜转运多种分子,包括离子、氨基酸、多肽、抗生素、多糖等各种分子[19]。有研究表明Rv0933可能与磷酸盐的转运相关[21-22],磷酸盐对于Mtb的生长具有重要作用,因此推测Rv0933可能通过改善菌体的营养状况而在RFP耐药表型中发挥一定辅助作用,但上述作用必须与药物外排泵协同发挥作用,仅高水平表达Rv0933的菌株不能表现为耐药。
本研究仅在大肠埃希菌中完成了转基因功能验证试验,希望后续工作可以在耻垢分枝杆菌中展开,并从生物化学及结构生物学角度证实上述外排泵的功能;本研究中存在的另一个不足为仅在r poB未突变菌株中研究了药物外排泵的功能,而药物外排泵与耐药基因突变2种机制可能在耐药过程中协同发挥作用,下一步研究将围绕上述问题开展。最后,对Rv0783和Rv2936启动子区进行研究将有助于理解Mt b外排泵基因表达调控与耐药性之间的关系。
参 考 文 献
[1]逄宇,夏辉,姜广路,等.中国结核分枝杆菌寡核苷酸基因分型及其耐药性分析.中华检验医学杂志,2011,34(11):1023-1028.
[2]Wade MM,Zhang Y.Mechanisms of dr ug resistance in Mycobacteriu m tuberculosis.Fr ont Biosci,2004,9:975-994.
[3]Bolotin S,Alexander DC,Chedore P,et al.Molecular characterization of dr ug-resistant Mycobacteriu m tuberculosis isolates fr o m Ontario,Canada.J Anti micr ob Chemot her,2009,64(2):263-266.
[4]Louw GE,Warren RM,Gey van Pittius NC,et al.A balancing act:efflux/influx in mycobacterial drug resistance.Antimicrob Agents Chemother,2009,53(8):3181-3189.
[5]Somoskovi A,Parsons L M,Salfinger M.The molecular basis of resistance to isoniazid,rifa mpin,and pyrazina mide in Mycobacteriu mt uberculosis.Respir Res,2001,2(3):164-168.
[6]Ma X,Wang H,Deng Y,et al.r poB Gene mutations and molecular characterization of rifa mpin-resistant Mycobacteriu m t uberculosis isolates fro m Shandong Pr ovince,China.J Clin Micr obiol,2006,44(9):3409-3412.
[7]Leonard B,Cor onel J,Siedner M,et al.Inter-and intra-assay repr oducibility of micr oplate Ala mar bl ue assay results f or isoniazid,rifa mpicin,et ha mbutol,strepto mycin,ciprofloxacin,and capreomycin drug susceptibility testing of Mycobacterium tuberculosis.J Clin Microbiol,2008,46(10):3526-3529.
[8]Gupta AK,Katoch VM,Chauhan DS,et al.Microarray analysis of efflux pu mp genes in multidrug-resistant Mycobacterium t uberculosis during stress induced by co mmon anti-tuberculous dr ugs.Micr ob Dr ug Resist,2010,16(1):21-28.
[9]李桂莲,王撷秀,谢彤,等.药物外排泵基因表达与结核分枝杆菌耐药关系的探讨.中华检验医学杂志,2011,34(7):605-611.
[10]Baysarowich J,Koteva K,Hughes DW,et al.Rifa mycin antibiotic resistance by ADP-ribosylation:Str ucture and diversity of Arr.Pr oc Natl Acad Sci U S A,2008,105(12):4886-4891.
[11]孙勇,李传友,许绍发.结核分枝杆菌耐药机制的研究进展.国际呼吸杂志,2010,30(24):1501-1505.
[12]崔运勇,王峰,刘小立,等.深圳市耐多药结核分枝杆菌流行株耐药基因序列分析.中国防痨杂志,2011,33(5):257-262.
[13]王海英,徐勇,邓云峰,等.山东省耐利福平结核分枝杆菌rpoB基因突变的研究.中国防痨杂志,2005,27(5):289-292.
[14]胡志东,张雪莲,王洪海.结核分枝杆菌外排泵及其抑制剂的研究进展.中国感染控制杂志,2010,9(4):294-296.
[15]Liu J,Takiff HE,Nikaido H.Active effl ux of fluoroquinolones in Mycobacteriu m s megmatis mediated by Lfr A,a multidr ug efflux pu mp.J Bacteriol,1996,178(13):3791-3795.
[16]Pasca MR,Guglierame P,Arcesi F,et al.Rv2686c-Rv2687c-Rv2688c,an ABC fl uor oquinolone effl ux pu mp in Mycobacteriu m t uberculosis.Anti microb Agents Chemot her,2004,48(8):3175-3178.
[17]Pasca MR,Guglierame P,De Rossi E,et al.mmp L7 gene of Mycobacterium tuberculosis is responsible f or isoniazid efflux in Mycobacteriu m smeg matis.Anti microb Agents Chemother,2005,49(11):4775-4777.
[18]Colangeli R,Hel b D,Sridharan S,et al.The Mycobacteriu m t uberculosis ini A gene is essential f or activity of an efflux pu mp t hat confers dr ug tolerance to both isoniazid and et ha mbut ol.Mol Microbiol,2005,55(6):1829-1840.
[19]Ra món-García S,Martin C,Tho mpson CJ,et al.Role of t he Mycobacteriu m t uberculosis P55 efflux pu mp in intrinsic dr ug resistance,oxidative stress responses,and growt h.Anti micr ob Agents Chemot her,2009,53(9):3675-3682.
[20]Jiang X,Zhang W,Zhang Y,et al.Assess ment of efflux pu mp gene expression in a clinical isolate Mycobacteriu m tuberculosis by real-ti me reverse transcription PCR.Microb Drug Resist,2008,14(1):7-11.
[21]Målen H,De Souza GA,Pathak S,et al.Comparison of membrane proteins of Mycobacterium tuberculosis H37Rv and H37Ra strains.BMC Microbiol,2011,11:18.
[22]Betts JC,Lukey PT,Robb LC,et al.Evaluation of a nutrient starvation model of Mycobacteriu m t uberculosis persistence by gene and pr otein expression profiling.Mol Micr obiol,2002,43(3):717-731.
