柠檬黄素在淀粉凝胶内的扩散特性研究
2012-11-15赵学伟李国愉
赵学伟,李国愉
(郑州轻工业学院食品与生物工程学院,河南郑州450002)
柠檬黄素在淀粉凝胶内的扩散特性研究
赵学伟,李国愉
(郑州轻工业学院食品与生物工程学院,河南郑州450002)
测定了在4℃和35℃条件下柠檬黄素在3种浓度的小麦﹑小米淀粉凝胶内的扩散系数。结果表明,在相同条件下,与小麦淀粉凝胶相比,柠檬黄在小米淀粉凝胶内的扩散较慢。扩散系数随着凝胶浓度的减小而增大,随着温度升高而升高。与改变浓度相比,降低温度更能有效地降低柠檬黄在淀粉凝胶内的扩散速度。
淀粉凝胶,柠檬黄,扩散系数
对于一个液态食品体系,添加淀粉的浓度较低时起到增稠作用,浓度高时因受热成胶而起胶凝作用。所以,淀粉常用作增稠剂和胶凝剂。淀粉也是构成很多食品的基质材料。与其它常用的胶凝剂相比,淀粉价格低廉,来源广泛。为增强某些食品(如果冻)的感官吸引力,有时要求其一定部位有颜色,而周围保持无色。如果有色部位的色素进入无色区域,就会降低产品品质。这时,了解色素在凝胶基质中的扩散特性就十分重要。温度和凝胶浓度是影响扩散速度的两个主要因素[1],了解它们对扩散系数的影响有利于选定合理的凝胶浓度和存放温度。测定扩散系数的方法包括:吸附动力学法、扩散室法、浓度-距离法、干燥速率法[1]。其中扩散室法[2]和浓度-距离法[3]在测定凝胶内的物质扩散方面较为常用。采用浓度-距离法,只进行一次实验就可求出扩散系数,已用于研究nisin[3]、色素[4]、水分[5-6]在食品凝胶内的扩散。本研究采用该方法。在求解扩散系数时需要知道扩散物质的浓度,可以直接测定扩散物质的含量,也可以采用间接物理量来反映扩散物质的含量。对于色素扩散,可以根据色泽参数来测定扩散物质的含量,但要先建立色泽参数与扩散物质浓度的关系[7]。柠檬黄是最为常用的食用色素,本文拟研究其在4℃和35℃条件下在不同浓度的2种谷物淀粉凝胶内的扩散系数。
1 材料与方法
1.1 材料与仪器
小麦淀粉 购于超市;小米淀粉 自制,采用0.2% NaOH溶液去蛋白,淀粉中剩余蛋白的含量为0.52%;柠檬黄 天津市凯通化学试剂有限公司生产。小麦淀粉是较为常用的商业淀粉,淀粉粒较大;小米淀粉为小粒淀粉。选择淀粉粒大小明显不同的两种淀粉有助于了解淀粉粒在决定扩散特性方面所起的作用。
1.2 实验方法
1.2.1 淀粉凝胶的制备 采用浓度-距离法测定扩散系数时需要两种凝胶,一种含有柠檬黄,另一种不含。本研究选定凝胶中淀粉的浓度为14%、19%、25%。含柠檬黄凝胶中柠檬黄的浓度选定为0.02%。
精确称量所需淀粉,加入经煮沸并冷却至60℃左右的水中。前期实验表明,采用煮沸的水可以避免在加热淀粉成胶的过程中出现气泡。在充分搅匀的情况下将淀粉悬浮液吸入25mL塑料注射器(已拔去金属针头),用面筋密封注射器的吸入口。将装有淀粉悬浮液的注射器放入90℃水浴锅中加热20min。加热过程中要不停搅动注射器(尤其是前5min)以防淀粉沉淀导致凝胶不均匀。然后取出注射器室温静置冷却24h。制作含有柠檬黄的凝胶时,在悬浮液中加入所要量的柠檬黄即可。
1.2.2 扩散实验 取含柠檬黄和不含柠檬黄淀粉凝胶的注射器各一支,用单面刀片切去带针头一端的塑料底,并尽量保证切口平整。将含柠檬黄的凝胶推出一半,切去推出部分。两针筒的切口端对接,将不含柠檬黄的淀粉凝胶小心推入另一针筒,注意保证推的过程中两段凝胶柱界面紧密接触。推不动时用刀片沿两针筒的界面将多余凝胶切去。用塑料薄膜包裹针筒的开口端并用胶带缠绕,保证密封。用记号笔在注射器外表面标注两凝胶的界面位置。
本研究测定淀粉凝胶在4℃和35℃的扩散系数,4℃是食品低温存放的常用温度,35℃是高温存放时食品所经受的较高温度。将注射器分别放置在4℃冰箱或35℃的恒温箱内。4℃存放的样品78h后取出,35℃存放的样品120h后取出。将注射器与一钢尺平行放置在桌面上,用照相机拍照。参见图1。
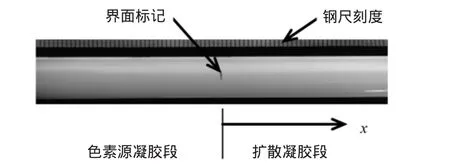
图1 14%小麦淀粉凝胶4℃下放置120h后的照片Fig.1 Photos of 14%wheat starch gel placement at 4℃after 120h
采用IJ1.24图像处理软件,根据图中钢尺的刻度以及注射器上的凝胶界面标记,可以求出离界面不同距离处凝胶的灰度值。此前,先制作一组柠檬黄浓度(0.00001%~0.05%)已知的凝胶,并测出其灰度值,然后建立灰度值与浓度之间的经验关系式。根据该经验式即可求出离界面不同距离处凝胶内的柠檬黄浓度。
1.2.3 扩散系数求解 认为柠檬黄在淀粉凝胶内的扩散过程遵循Fick第二扩散定律,对于一维扩散,则有[8]:

其中,D:扩散系数(m2/s),t:扩散时间(s),C:柠檬黄的浓度,x:距凝胶界面的距离。
假设凝胶段为半无限介质(即满足:Dt/L<0.05,L为扩散凝胶段的长度),则存在如下初始和边界条件:
在t=0且x≥0时,C=Cin=0
在t≥0且x=xmax时,C=0
在t≥0且x=0时,C=C0
其中,Cin:淀粉凝胶中柠檬黄的初始浓度,本研究中Cin=0;xmax:从界面到凝胶另一端的最大距离,本研究中xmax=40mm;C0:色素源凝胶段内柠檬黄的浓度,本研究中C0=0.02%。如果D与凝胶柠檬黄的浓度无关,则式(1)在上述初始和边界条件下存在如下解析解[9]:

其中,erf函数为误差函数:

对于一个扩散过程,在进行t时间后,根据测得的多组C-x对应值,就可根据式(2)回归求出D值。由于式(2)是一个以积分上限为变量的方程,采用一般的方法难以回归求解,我们编制程序后运用Matlab软件求得D的值。
2 结果与分析
2.1 灰度值与色素浓度的关系
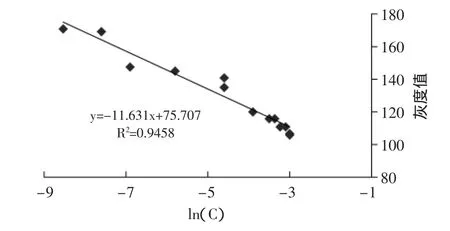
图2 灰度值与柠檬黄浓度之间的关系Fig.2 Relationship between gray value and tartrazine
图2为凝胶中的柠檬黄浓度与凝胶灰度值之间的关系,其中x=lnC。R2接近0.95,说明灰度值与lnC之间基本呈线性关系。在测得凝胶的灰度值后,我们根据回归方程y=-11.631lnC+75.707计算其中柠檬黄的含量。
2.2 淀粉浓度和温度对柠檬黄扩散系数的影响
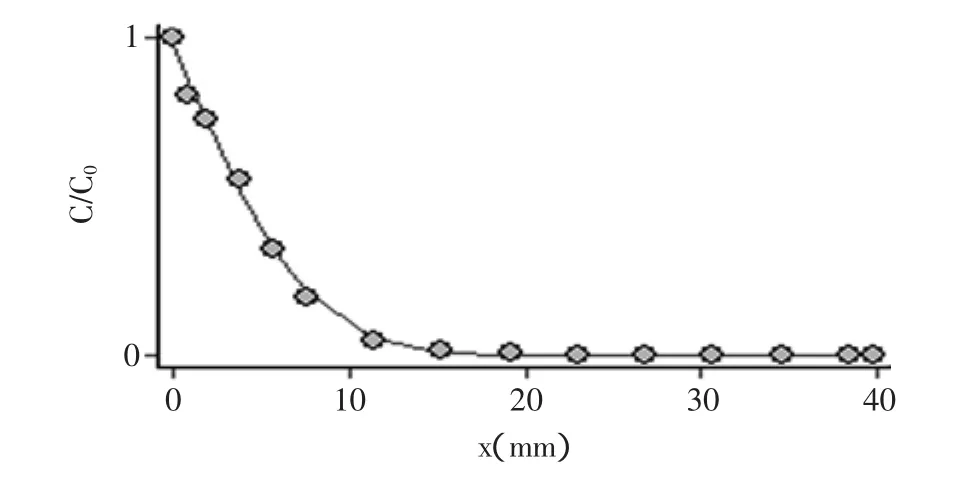
图3 采用式(2)拟合14%小麦淀粉凝胶4℃下的色素扩散数据Fig.3 Pigment diffusion data of 14%wheat starch gel at 4℃fitting by type(2)
图3为14%小麦淀粉凝胶在4℃下存放120h后测得的距界面不同位置处柠檬黄的含量,其中的曲线为根据式(2)得到的拟合曲线。可以看出曲线与实验数据点拟合得很好。由于扩散时间t已知,通过拟合可求出扩散系数D的值。
图4给出了在4℃条件下柠檬黄在两种淀粉凝胶内的扩散系数。可以看出,随凝胶中淀粉浓度提高,扩散系数降低。浓度从14%增大到25%时,小麦、小米淀粉凝胶内的扩散系数分别从8.64×10-11、3.96×10-11m2/s接近线性降低到4.00×10-11、1.18×10-11m2/s。另外,在相同浓度时小米凝胶内的扩散速度比小麦淀粉凝胶内的要低。这可能与小米淀粉粒较小,糊化后形成的凝胶较为“密实”有关。
图5为两种淀粉凝胶在35℃条件下的水分扩散系数。凝胶浓度和淀粉种类对扩散系数的影响趋势与4℃条件下的基本一致。比较图4、图5可以发现,升高温度可以导致扩散系数快速增大。例如:19%的小麦淀粉凝胶在4℃时的扩散系数为6.19×10-11m2/s,35℃时扩散系数增大到2.581×10-10m2/s,扩散速度增大为原来的4倍多。
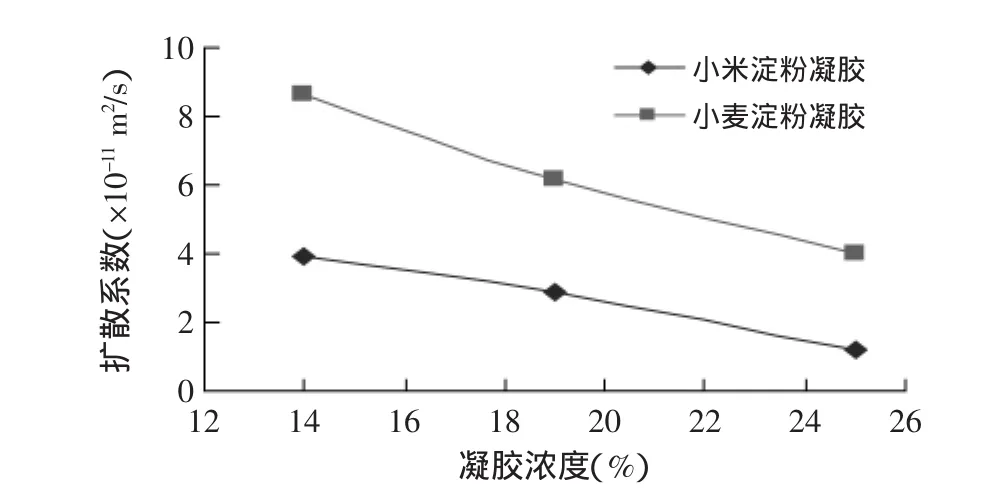
图4 4℃下柠檬素在2种淀粉凝胶内的扩散系数Fig.4 Diffusion coefficient of tartrazine in 2 kinds of starch gel at 4℃
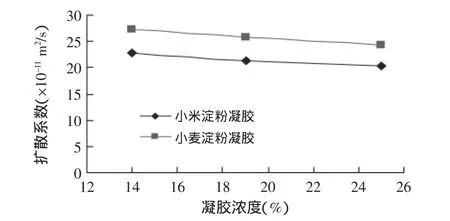
图5 35℃下柠檬黄在2种淀粉凝胶内的扩散系数Fig.5 Diffusion coefficient of tartrazine in 2 kinds of starch gel at 35℃
所以,为了控制柠檬黄在淀粉凝胶内的扩散,首先要选择合理的淀粉种类,另外,降低温度比提高凝胶浓度更为有效。
关于柠檬黄在淀粉凝胶中的扩散系数,尚未见相关报道。柠檬黄在7℃条件下在2%低酯果胶+40%蔗糖所形成的凝胶中的扩散系数为6.0×10-11m2/s[4],与本研究中5℃条件下的测定结果在一个数量级上。水在25%浓度的糯玉米淀粉胶中的扩散系数在10-10m2/s数量级上[9],比本研究中柠檬黄素高很多。估计由于水分子较小,容易扩散;另外,该研究采用的是糯玉米淀粉,糊化后很少有直链淀粉析出,使得凝胶基质中淀粉浓度较低,水分子扩散变得容易。
最后,对于4℃下的扩散,扩散时间为78h,最大扩散系数为8.64×10-11m2/s,可以算出Dt/L=0.0233;对于35℃下的扩散,扩散时间为120h,最大扩散系数为2.738×10-10m2/s,则Dt/L=0.0481。都小于0.05,说明前面关于半无限介质扩散的假设是可以接受的。
3 结论
在相同条件下,柠檬黄在小米淀粉凝胶内的扩散速度比在小麦淀粉凝胶内的要低。提高淀粉凝胶的浓度或降低温度都使得扩散速度降低,但降低温度对扩散速度的影响更为明显。
[1]Saravacos G D.Chapter 8 Mass Transfer Properties of Foods. In:Rao M A,Rizvi S S H,and Datta A K.Engineering Properties of Foods[M].CRC Press,2005.
[2]Axelsson A,Persson B.Determination of effective diffusion coefficients in calcium alginate gel plates with varying yeast cell content[J].Appl Biochem Biotechnol,1988,18:231-250.
[3]Ripoche A C,Chollet E,Peyrol E,et al.Evaluation of nisin diffusion in a polysaccharide gel:Influence of agarose and fatty content[J].Innov Food Sci Emerg Technol,2006(7):107-111.
[4]Nongonierma A B,Cayot P,Springett M,et al.Transfers of small analytes in a multiphasic stirred fruit yoghurt model[J]. Food Hydrocolloids,2007(21):287-296.
[5]Boudhrioua N,Bonazzi C,Daudin J D.Estimation of moisture diffusivity in gelatin-starch gels using time-dependent concentration-distance curves at constant temperature[J].Food Chem,2003,82:139-149.
[6]Boudhrioual N,Broyart B,Bonazzi C,et al.Validation of a method of determination of apparent diffusivity versus composition in solids[J].Drying Technol,2005(23):2313-2335.
[7]Kemp M R,Fryer P J.Enhancement of diffusion through foods using alternating electric fields[J].Innov Food Sci Emerg Technol,2007(8):143-153.
[8]Cranck J.The Mathematics of diffusion[M].London W:Oxford University Press,1975.
[9]Karathanos V T,Vagenas G K,Saravaco G D.Water diffusivity in starches at high temperatures and pressures[J].Biotechnol Prog,1991(7):178-184.
Study on diffusion of tartrazine in starch gels
ZHAO Xue-wei,LI Guo-yu
(School of Food and Biological Engineering,Zhengzhou Institute of Light Industry,Zhengzhou 450002,China)
The diffusivity of tartrazine in wheat and millet starch gels of three starch concentrations was determined in 4℃ and 35℃.The results showed that with same temperature and starch concentration the diffusion of tartrazine in millet starch gel was slower than that in wheat starch gel.The diffusivity increased with decreasing starch concentrations or increasing temperature.Compared with decreasing starch concentration,increasing temperature was more effective in decreasing the diffusivity.
starch gel;tartrazine;diffusivity
TS201.7
A
1002-0306(2012)05-0303-03
2011-03-18
赵学伟(1969-),男,副教授,研究方向:谷物食品加工。
郑州轻工业学院博士基金项目(000100)。
