卷心菜中叶黄素提取工艺研究
2012-11-15陈红梅杨吉彬
谢 翎,陈红梅,杨吉彬,黄 勃
(1.安庆师范学院生命科学学院,安徽安庆246011;2.安徽农业大学微生物防治省重点实验室,安徽合肥230036;3.安庆龙麟农业生态博览园发展有限公司,安徽安庆246003)
卷心菜中叶黄素提取工艺研究
谢 翎1,2,陈红梅1,杨吉彬3,黄 勃2,*
(1.安庆师范学院生命科学学院,安徽安庆246011;2.安徽农业大学微生物防治省重点实验室,安徽合肥230036;3.安庆龙麟农业生态博览园发展有限公司,安徽安庆246003)
采用超声波辅助提取卷心菜中的叶黄素,高效液相色谱法检测叶黄素含量。在单因素实验的基础,通过正交实验确定卷心菜中叶黄素的最优工艺条件为:丙酮为提取剂,超声波功率为500W,超声提取时间为30min,料液比为1∶30,提取温度为60℃。卷心菜干粉中叶黄素含量约为5.6mg/100g。研究结果对叶黄素的生产与商业化应用将具有重要意义。
卷心菜,高效液相色谱法,叶黄素,超声波
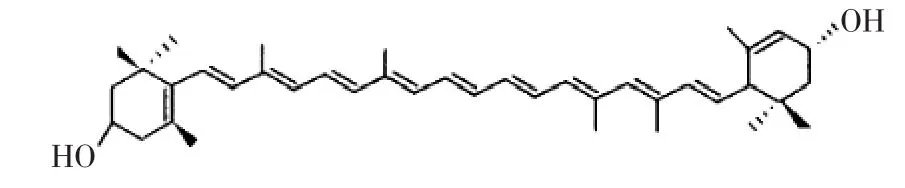
图1 全反式异构体叶黄素分子结构图Fig.1 The structure of trans isomer lutein
叶黄素(lutein)是一种天然色素,又称植物黄体素,属于“类胡萝卜素”类物质,最早是由Wihelm与Wackenroder两位科学家于1831年发现的[1]。叶黄素分子量为568.9,其分子碳架,主要由两个六元环和一个多聚烯链共同组成。虽然,在理论上叶黄素有多种同分异构体,但自然条件下叶黄素主要还是以全反式异构体的形式存在[2](图1)。由于具有色泽鲜艳、着色力强、安全无毒、富含营养等特点,叶黄素越来越受到人们的重视,从而在食品、保健品及医药领域被广泛的应用。随着对叶黄素相关研究的不断深入,人们发现叶黄素其实是一种优良的抗氧化剂[3],在预防年龄相关性视黄斑退化[4-5],降低结肠癌发病率[6],预防心血管疾病的发生等方面有着显著的效果。目前,国际上对叶黄素的需求量日益增大,价格不断提升。因此,研究开发新的具有潜力的叶黄素植物源具有重要的商业价值。卷心菜(Brassica oleracea L.var. capitata L.),又名球甘蓝,属于甘蓝的变种,我国各地都有栽培。卷心菜口味清香,脆嫩,四季都能吃到,是主要的蔬菜品种之一。近年,西方一些国家的学者们发现它在抗衰老和防止心脑血管疾病、癌症等方面显现了奇异功效[7]。卷心菜在我国的产量非常高,且价格较低。通过卷心菜来提取叶黄素是一种非常理想的选择。本研究就是在前人工作的基础上,探索和优化卷心菜叶黄素提取工艺。由于常规叶黄素提取都是通过皂化方法,工艺较为复杂;本文采用超声波辅助有机溶剂提取卷心菜中叶黄素,旨在获得卷心菜中叶黄素的高效能提取法。
1 材料与方法
1.1 材料与仪器
卷心菜 购于本地农贸市场,叶片洗净后切碎,经24h冻干后粉碎,卷心菜干粉用于后续叶黄素提取(卷心菜干粉可过50目筛);叶黄素标样 德国Sigma公司;丙酮、二氯甲烷、乙酸乙酯、氯仿 均为国产分析纯;甲醇 国产色谱纯。
Waters600高效液相色谱仪、分析型色谱柱(5μm,4.6×250mm,ODS2) 美国Waters公司;FreeZone12冷冻干燥系统 美国Labconco公司;SENCO R-502旋转蒸发仪 上海申胜生物技术公司;KH5200DB超声波清洗器 昆山禾创超声仪器有限公司。
1.2 实验方法
1.2.1 提取液的确定 由于叶黄素易溶于二氯化碳、氯仿以及酯类。因此选取二氯化碳、氯仿、乙酸乙酯,以及常用有机试剂丙酮作为候选萃取液,以筛选合理的叶黄素提取溶剂。
精确称量5.0g卷心菜干粉,分别用二氯化碳、氯仿、乙酸乙酯以及丙酮定容至100mL,在超声波清洗器中400W功率下振荡60min(振动处理温度50℃)。振荡结束后,对样品在5000×g下离心5min。将澄清提取液旋转蒸干后,统一用丙酮定容至10mL。样品再次在5000×g下离心5min,进HPLC检测。另外,用丙酮分别配制叶黄素标准样品溶液5、10、20、50、100μg/mL。
1.2.2 超声波振动功率的确定 称取卷心菜干粉5.0g,用丙酮定容至100mL,分别在200、300、400、500、600W功率的超声波下振动60min(振动处理温度50℃)。振荡结束后,对样品离心。将澄清提取液浓缩后,用丙酮定容至10mL。样品再次离心后,进HPLC检测。
1.2.3 超声波振动时间的确定 称取卷心菜干粉5.0g,用丙酮定容至100mL,50℃下分别在超声波500W下振动10、30、60、90、120min(振动处理温度50℃)。振荡结束后,对样品离心。将澄清提取液浓缩后,用丙酮定容至10mL。样品再次离心后,进HPLC检测。
1.2.4 料液比的确定 称取卷心菜干粉5.0g,分别用25、50、100、150、200mL丙酮定容,50℃下在超声波500W下振动30min(振动处理温度50℃)。振荡结束后,对样品离心。将澄清提取液浓缩后,用丙酮定容至10mL。样品再次离心后,进HPLC检测。
1.2.5 超声波处理温度的确定 称取卷心菜干粉5.0g,用150mL丙酮定容,分别于40、50、60、70℃用超声波500W功率振动30min。振荡结束后,对样品离心。将澄清提取液浓缩后,用丙酮定容至10mL。样品再次离心后,进HPLC检测。
1.2.6 液相色谱条件 Waters高效液相色谱仪,检测波长446nm,色谱柱ODS2反向C18柱,柱温25℃,色谱时间20min,平衡时间5min,流动相为纯甲醇(流速0.5mL/min),进样量20μL。所有样品检测处理,均重复三次。
1.2.7 统计学处理 HPLC峰面积表达结果为平均值±标准差,使用DUCAN多重比较法[8]进行多个均数间两两比较。数据分析均使用DPS数据处理系统软件[9]。
1.2.8 正交实验设计 在单因素实验基础上,继续选择超声波处理功率、处理时间、处理温度及料液比为考察因素,以叶黄素HPLC检测出峰面积为指标,采用L9(34)正交实验(见表1),优化出卷心菜中叶黄素提取的最佳工艺参数。
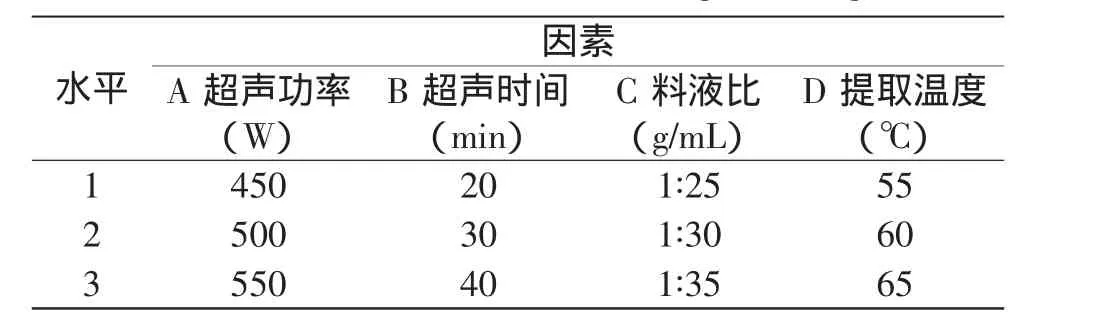
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal design
2 结果与讨论
2.1 标准曲线的建立
通过叶黄素标样进HPLC所得峰面积,在浓度5~100μg/mL范围内,以叶黄素浓度为横坐标,以峰面积为纵坐标,得到回归方程:y=548.4x+711.76,R2=0.9992。通过各处理样品与标样出峰时间对比,可以确定在4min左右所出峰为同一物质,即叶黄素。将各样品峰面积代入上述回归方程,即可获得卷心菜干粉中叶黄素含量。
2.2 单因素实验
2.2.1 提取试剂的确定 从表2可以看出,用丙酮作为提取溶剂提取的叶黄素量最多,其次为二氯甲烷和氯仿,乙酸乙酯提取量最低,且差异极显著。
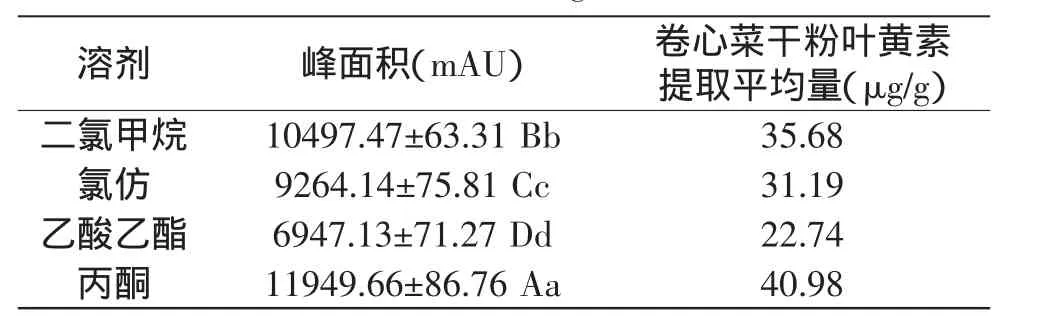
表2 不同溶剂处理对卷心菜中叶黄素提取量的影响Table 2 Effect of solvents on extraction yield of lutein from cabbage
2.2.2 超声波振动功率的确定 选择丙酮作为提取溶剂,在不同的超声波功率处理下振荡60min。从表3可以看出,随着超声波振动功率的上升,在60min内叶黄素的出峰面积呈现明显的波动。200W时,叶黄素的出峰面积最小,只有7537.48mAU。当超声功率升到500W,峰面积达到最大值,为13573mAU。当超声波功率超过500W继续上升时,叶黄素的出峰面积开始降低。方差分析表明,各处理出峰面积差异极显著。
2.2.3 超声波振动时间的确定 选择丙酮作为提取溶剂,在500W超声波功率处理下振荡不同时间。从表4可以看出,超声处理30min时,叶黄素的出峰面积保持在最大值13536mAU。方差分析表明,超声处理30min与60min峰面积差异不明显。另外,当超声处理超过60min后,叶黄素的出峰面积明显开始下降。当振荡2h后,叶黄素的出峰面积下降至12182mAU。
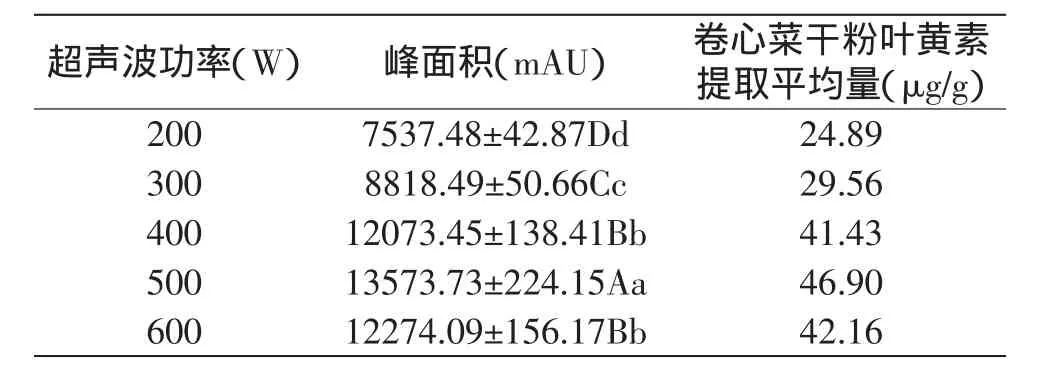
表3 不同功率的超声振荡对卷心菜中叶黄素提取量的影响Table 3 Effect of ultrasonic power on extraction yield of lutein from cabbage

表4 不同时间超声处理对卷心菜中叶黄素提取量的影响Table 4 Effect of ultrasonic treatment time on extraction yield of lutein from cabbage
2.2.4 料液比的确定 选择不同体积的丙酮作为提取溶剂,取5g冻干卷心菜粉,在500W超声波功率处理下振荡30min。从表5可以看出,5g干粉选用150mL丙酮抽提时(即料液比为1∶30),其平均叶黄素出峰面积最大,为15226mAU。方差分析表明,料液比为1∶30与1∶40时叶黄素出峰面积差异极不明显,说明继续增加溶剂量可能已无法提高叶黄素的抽提效率。
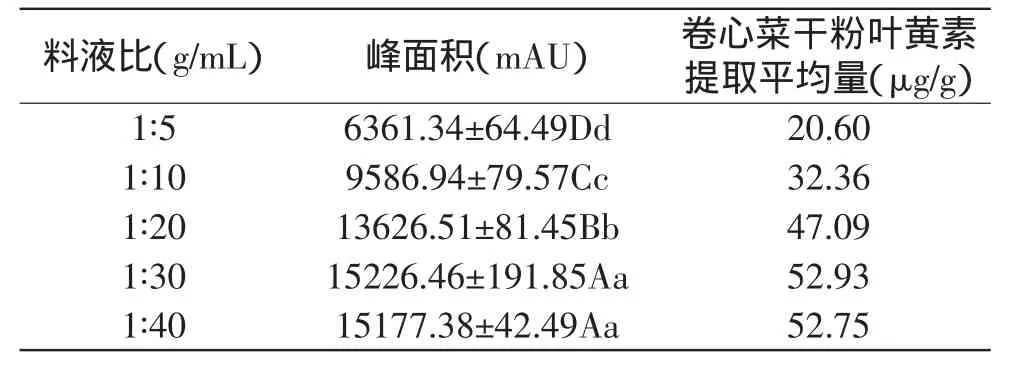
表5 不同料液比处理对卷心菜中叶黄素提取量的影响Table 5 Effect of solid to liquid ratio on extraction yield of lutein from cabbage

表6 不同温度处理对卷心菜中叶黄素提取量的影响Table 6 Effect of temperature during ultrasonic on extraction yield of lutein from cabbage
2.2.5 超声处理温度的确定 选择150mL的丙酮作为提取溶剂,取5g冻干卷心菜粉,在500W超声波功率处理下,于不同温度下用超声波500W功率振荡30min。从表6可以看出,方差分析说明50℃与60℃下处理时,峰面积数据差异并不明显。但60℃下抽提时,其平均叶黄素峰面积与叶黄素提取平均值都高于50℃处理。因此,后续正交实验应对温度处理条件进行进一步的优化。
2.3 正交实验优化
单因素实验表明,当提取试剂为丙酮时,超声振动功率、超声振动时间、料液比、处理温度对卷心菜干粉中叶黄素的提取量都具有影响。为寻求最佳工艺,在单因素实验的基础上设计正交实验,选取超声振动功率、振动时间、料液比和处理温度为考察因素,以叶黄素提取量为指标,取三水平按L9(34)设计正交实验。
表7表明,极差RB>RC>RD>RA。极差越大,该因素水平变动时,单位材料中叶黄素提取量变化越大。即因素B(超声作用时间)对叶黄素提取量影响最大,其次是因素C(料液比),因素D(提取温度)次之,因素A(超声功率)对提取量影响最小。
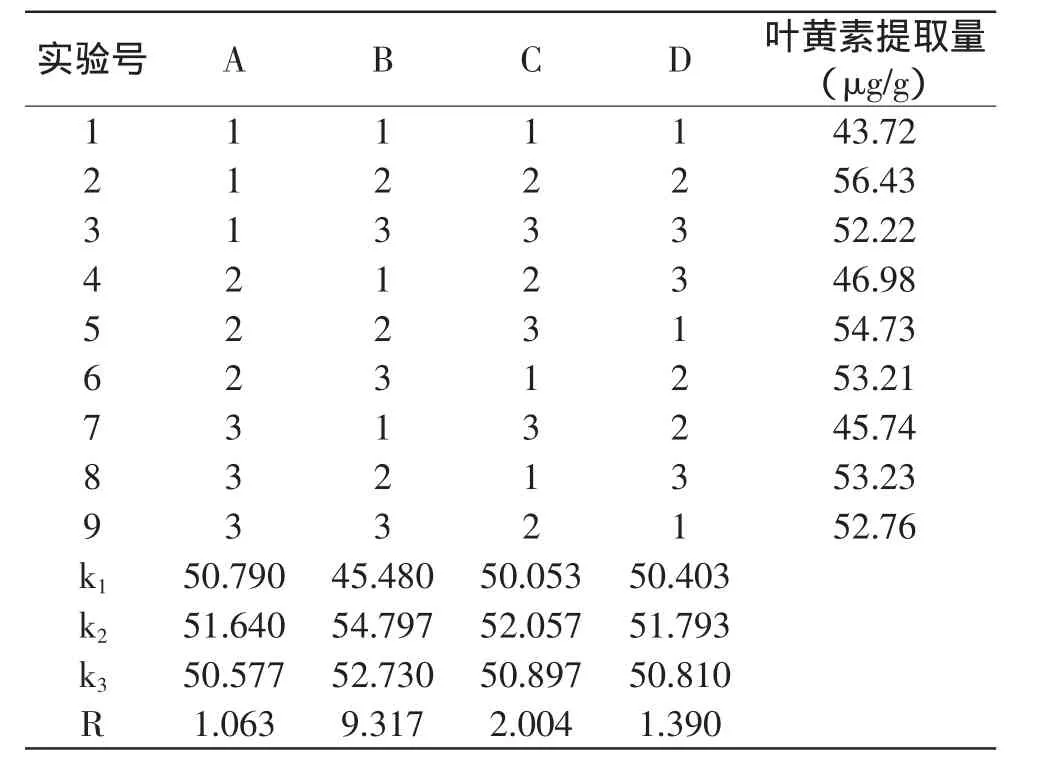
表7 卷心菜叶黄素提取正交实验设计及结果Table 7 Orthogonal array matrix and experimental results
以叶黄素提取量为指标,进行方差分析。表8方差分析显示,FA<FD<FC<FB<F0.05=4.460,说明本实验选取各因素对叶黄素提取量的影响均表现为不显著。
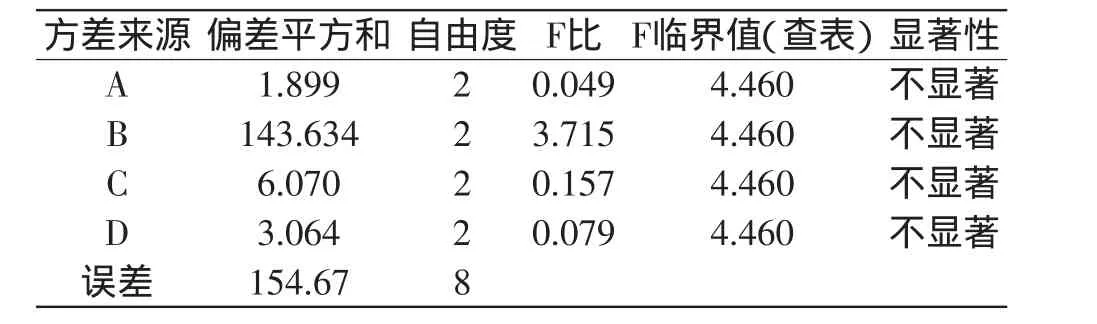
表8 正交实验方差分析结果Table 8 Variance analysis for extraction yield of lutein with various extraction conditions
结合表7与表8可以得出,采用丙酮为提取试剂,卷心菜干粉中叶黄素的最佳提取工艺条件为超声功率500W,超声处理时间30min,料液比1∶30,处理温度60℃。在此条件下进行验证,卷心菜干粉中叶黄素含量约为:5.6mg/100g。
3 讨论与结论
叶黄素是自然界中一种重要生物活性物质,它在食品与保健品生产领域具有重要的作用。能够从低价的食物源原料中,通过简单易行的方法提取叶黄素,并进行精确定量定性分析,是目前叶黄素产业化研究的热点。本研究以国内产量巨大且价格偏低的常见蔬菜-卷心菜为材料,探索了叶黄素经济可行的新的提取方法和原料来源。
对于叶黄素的分析和检测,国内外之前已经有很多的方法,例如:薄层层析法(TLC)、分光光度法等[10]。由于TLC分析效果较差,且无法对产物精确定量。而分光光度法则对单一叶黄素测定结果会产生一定偏差[11]。因此,人们迫切希望能探索出精确分析叶黄素的新方法。近些年来,发展起来的HPLC就是一种精确的物质分析技术。由于其试剂消耗少、样品预处理简单,因此在植物组织活性物质分离分析方面具有独特优势[12-13]。所以,HPLC技术也是目前叶黄素提取工艺研究中较为理想的产物分析方法[14-15]。
我们通过有机试剂的直接强化提取,并借助超声波处理,简化了常规的叶黄素皂化提取分离工艺。结果表明,通过丙酮萃取抽提,在优化了超声波处理等条件后,卷心菜中的叶黄素能够高效率的被提取出来。每100g卷心菜干粉中,能获得5.6mg左右的叶黄素。
从研究结果中,我们也发现超声波的生物学效应十分复杂,不同的作用条件下其生物学作用是不同的。虽然理论上,提取时间越长,样品破碎越充分,则细胞中内含物被抽提的效率将会越高。但我们的实验结果表明,在超声波萃取叶黄素的过程中,在抽提一定时限后,即可将绝大多数水溶性成分提出。过多地延长提取时间,不仅破碎效率不会相应提高,甚至会对已生成的产物有破坏作用。另外,料液比合适时也可以提高叶黄素的产量,并减少不必要的浪费。
[1]廖萍泰,惠伯棣,裴凌鹏,等.叶黄素的体外抗氧化功能[J].食品与发酵工业,2005,31(4):46-49.
[2]Britton G.Carotenoids[M].Birkhauser,1995:27-29.
[3]Holick C N,Michaud D S,Stolzenberg-Solomon R,et al.Dietary carotenoids,serum beta-carotene,and retinol and risk of lung cancer in the alpha-tocopherol,beta-carotene cohort study[J]. American Journal of Epidemiology,2002,156(6):536-547.
[4]Carpentier S,Knaus M,Suh M Y.Associations between lutein,zeaxanthin and age-related macular degeneration:An overview [J].Critical Reviews in Food Science and Nutrition,2009,49:313-326.
[5]Johnson E J,Chung H Y,Caldarella S M,et al.The influence of supplemental lutein and docosahexaenoic acid on serum,lipoproteins,and macular pigmentation[J].American Journal of Clinical Nutrition,2008,87:1521-1529.
[6]孙震,姚惠源.叶黄素的抗癌作用及其研究现状[J].生物技术通讯,2005,16(1):84-86.
[7]雨辰.卷心菜的奇特功效[J].食品与健康,2005(3):38.
[8]杜荣骞.生物统计学[M].北京:高等教育出版社,海德堡:施普林格出版社,1999:113-115.
[9]唐启义,冯明光.实验统计分析及其DPS数据处理系统[M].北京:科学出版社,2002:159-162.
[10]惠伯棣.类胡萝卜素化学及生物化学[M].北京:中国轻工业出版社,2005:257.
[11]石晋,栾雨时,王静云,等.HPLC法测定甘薯叶片中的叶黄素[J].植物研究,2008,28(6):767-769.
[12]郑春英,平文祥,刘松梅,等.HPLC-ELSD法在刺五加药材糖类成分分析中的应用[J].植物研究,2007,27(3):376-379.
[13]Marinova D,Ribarova F.HPLC determination of carotenoids in bulgarian berries[J].Journal of Food Composition and Analysis,2007,20(5):370-374.
[14]王琦,许洪高,高彦祥.叶黄素分析方法研究进展[J].中国食品添加剂,2007(6):100-105.
[15]Christopher Y,Ei-Sayed M A A,Iwona R,et al.Identification of synthetic regioisomeric lutein esters and their quantification in a commercial lutein supplement[J].Journal of Agricultural and Food Chemistry,2007,55(13):4965-4972.
Study on extraction technology of lutein from cabbage
XIE Ling1,2,CHENG Hong-mei1,YANG Ji-bin3,HUANG Bo2,*
(1.School of Life Science,Anqing Teachers College,Anqing 246011,China;2.Anhui Provincial Key Laboratory for Microbial Pest Control,Anhui Agricultural University,Hefei 230036,China;3.Anqing Long Ling Agro-ecological Exposition Development Co.,Ltd.,Anqing 246003,China)
Lutein from cabbage was extracted by ultrasonic,and the production was determined by HPLC.The extraction process was optimized by the orthogonal-array-design on the basis of a series of single-factor experiments.Experimental results showed that the optimal condition was as follows:acetone as extraction solvent,the power of ultrasonic 500W,treatment time of ultrasonic 30min,the extraction ratio of solid to liquid 1∶30,extraction temperature 60℃.Under the optimum conditions,about 5.6mg lutein could be extracted from 100g dried powder of cabbage.This experimental conclusion had great significance for production and commercial application of lutein.
cabbage;high performance liquid chromatography;lutein;ultrasonic
TS255.1
B
1002-0306(2012)03-0269-04
2011-10-17 *通讯联系人
谢翎(1980-),男,讲师,博士,研究方向:生物化学与分子生物学。
安徽省高校省级自然科学项目(KJ2010B091);安庆市重点科技项目(20100808);安庆师范学院科研启动项目(044-K05000000281)。
