甜叶菊随机扩增多态性DNA技术优化及亲缘关系研究
2012-11-15胡能兵何克勤张子学隋益虎崔广荣
胡能兵,何克勤,张子学,林 平,隋益虎,崔广荣,2,*
(1.安徽科技学院植物科学学院,安徽凤阳233100;2.安徽省甜叶菊工程技术研究中心,安徽蚌埠233000)
甜叶菊随机扩增多态性DNA技术优化及亲缘关系研究
胡能兵1,何克勤1,张子学1,林 平1,隋益虎1,崔广荣1,2,*
(1.安徽科技学院植物科学学院,安徽凤阳233100;2.安徽省甜叶菊工程技术研究中心,安徽蚌埠233000)
以甜叶菊为试材,对影响其随机扩增多态性DNA标记反应体系的7个因子进行优化,同时对来自国内外的12个品种进行亲缘关系分析。结果表明,20μL的优化体系包括:双蒸水13.6μL,10×Buffer(含15mmol/L MgCl2)溶液3μL,2.5mmol/L的dNTPS 1.2μL,10μmol/L的引物1μL,20ng的模板DNA 1μL,1U Taq聚合酶;热循环程序为:94℃预变性4min,94℃变性30s,35℃退火30s,72℃延伸1min,40个循环,最后72℃延伸7min。聚类图结果表明,品种间的遗传距离变异范围为0.12~0.88,在遗传距离为0.37时,8个引物可将12个品种分为四大类,来自日本的2个品种与国内品种关系较远。
甜叶菊,随机扩增多态性DNA,优化,亲缘关系
甜叶菊(Stevia rebaudiana Bertoni)简称甜菊、甜草、甜茶、蜜菊等,为菊科甜叶菊属多年生草本植物,原产南美巴拉圭一带,中国于1976年引种成功[1]。甜叶菊富含糖苷类物质,其糖苷具有高甜度(为蔗糖250~450倍)、低热量(仅为蔗糖的1/300)的特点,在体内不参与代谢、不蓄积、无毒性,被誉为是继甘蔗、甜菜之后的世界第三大糖源。甜叶菊具有一定的药理作用,对糖尿病、心脏病和高血压等有较好的疗效,现已广泛应用于保键饮料、低热量食品和医药行业中[2]。目前,甜叶菊在国内外的研究仍然处于起步阶段,如栽培、离体快繁、糖苷鉴定及优良单株筛选、品种选育等方面[2-8],而日新月异的分子技术在甜叶菊上的研究,如优异基因的分子标记、种质资源指纹图谱构建却鲜有报道,这给从事甜叶菊研究的各类人员,特别是期望品种得到保护的育种家提出新的课题。因此,在分子水平上开展这方面的研究已成为当前的首要任务。鉴于随机扩增多态性DNA标记(RAPD)技术具有操作简便、快速、省时省力等优点,一经问世便在诸多植物的品种鉴定、种属特异性研究、易混淆品种鉴别等方面发挥重要作用。本文拟首先对影响甜叶菊RAPD技术体系的7个主要因素进行优化,建立稳定的RAPD反应系统,既为品种的指纹图谱构建奠定前期基础,也为其它分子技术的优化乃至后期的应用提供参考。
1 材料与方法
1.1 实验材料
甜叶菊杂交新品种“皖甜1号”等6个亲本株 由蚌埠永生农业科技有限公司提供;RAPD体系中使用的Mg2+、dNTPS和Taq酶 购自北京康为世纪公司;引物 由上海Invitrogen公司合成;用于亲缘关系分析的品种材料 见表1。

表1 不同甜叶菊品种及来源Table 1 Different cultivars and origins of Stevia rebaudiana Bertoni
1.2 实验方法
1.2.1 DNA提取 采用胡能兵的CTAB法[9]。取2μL DNA于0.8%的琼脂糖凝胶板上进行电泳检测。
1.2.2 实验设计 PCR体系优化采用单因素实验,按照下面顺序依次开展:模板DNA浓度、dNTPS和Mg2+浓度、引物浓度、退火温度、Taq酶浓度和循环次数等,上述因子的处理水平见表2,下一个因子的优化是基于上一个因子在实验范围内获得理想结果的基础上进行。
1.2.3 基本反应体系 用于RAPD反应的20μL基本反应体系为:双蒸水12.2μL,10×Buffer(含15mmol/L MgCl2)溶液4μL,2.5mmol/L的dNTPS 1.6μL,10μmol/L的引物1μL,20ng的模板DNA 1μL,1U Taq聚合酶。其中,用于优化反应的RAPD引物分别为AZ:5'AGGCTAGGCT3'和BG:5'CGCAGACAGT3'。
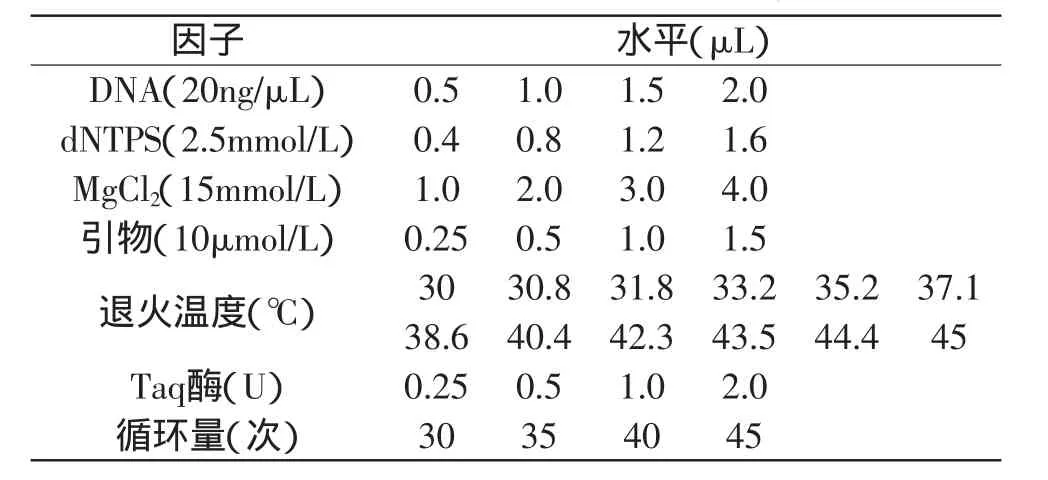
表2 RAPD体系的因子及其水平Table 2 Factors and levels of RAPD system
1.2.4 PCR扩增反应 基本的热循环程序为:94℃预变性4min,94℃变性30s,35℃退火30s,72℃延伸1min,40个循环,最后72℃延伸7min。扩增产物用0.5× TBE在1.5%琼脂糖凝胶板上电泳,加样量为6μL。电泳结束后用BIORAD凝胶成像系统进行拍照。
1.2.5 引物筛选 用日本品种“守甜3号”和国内品种“ST”对100条RAPD引物进行筛选,入选的是两品种同时能够扩增及“守甜3号”未扩增出条带而“ST”能扩增出条带的引物。
1.2.6 亲缘关系分析 用上述引物对12个品种同时进行扩增,对扩增后的条带进行0、1标记,有带的记为1,无带的记为0,形成0/1矩阵。根据Nei和Li(1979)的方法,用DPS统计软件中的类平均法(UPGMA)计算甜叶菊品种的亲缘关系。
2 结果与讨论
2.1 DNA提取质量结果
随机取6个亲本单株的叶片提取DNA后进行琼脂糖检测。由图1可知,所提取的DNA带型整齐,纯度高,无降解现象,经紫外分光光度计检测,DNA纯度较高,其浓度达到20ng/μL。

图1 利用CTAB法提取的DNA电泳图Fig.1 DNA electrophoresis map by CTAB method
2.2 RAPD反应体系的优化分析
2.2.1 模板DNA和dNTPS浓度的优化 以AZ、BG2个引物对4种不同浓度的模板DNA、dNTPS进行筛选,结果见图2、图3。在10ng的DNA浓度下,AZ引物所扩增的条带较为模糊,呈弥散状,而AZ、BG在其余浓度下表现条带数目一致、产量相当,故入选20ng的模板DNA浓度;不同dNTPS浓度对RAPD条带数目、产量影响较大。当dNTPS(2.5mmol/L)为0.4μL时,AZ引物未能扩增出条带,当dNTPS为1.6μL时,AZ引物扩增的条带类型减少(图3箭头所示),综合比较0.8、1.2μL时的dNTPS在两种引物的表现,以后者更为合适。

图2 不同DNA浓度对AZ引物带型的影响Fig.2 Effect of different DNA density on RAPD band

图3 不同dNTPS浓度对AZ引物带型的影响Fig.3 Effect of different dNTPS density on RAPD band
2.2.2 Mg2+和引物浓度的优化 分别用4种Mg2+和引物浓度对引物AZ、BG进行扩增,结果见图4、图5。随着Mg2+(15mmol/L)、引物浓度(10μmol/L)添加量的增加,条带数和产物量也随之增加,但3.0μL和4.0μL的Mg2+之间无明显差异,低浓度的AZ引物会导致条带缺失(图5箭头所示),当引物为1.0μL和1.5μL时,处理的产物量相当,故选择3.0μL的Mg2+和1μL的10μmol/L引物为佳。
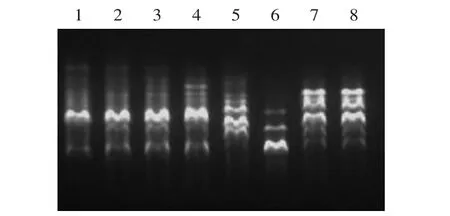
图4 不同Mg2+浓度对带型的影响Fig.4 Effect of different Mg2+density on RAPD band AZ(1~4)、BG(5~8)

图5 不同引物浓度对带型的影响Fig.5 Effect of different primer density on RAPD band AZ(1~4)、BG(5~8)
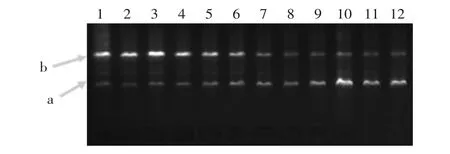
图6 不同退火温度对AZ引物带型的影响Fig.6 Effect of different annealing temperature on RAPD band

图7 不同Taq浓度对带型的影响Fig.7 Effect of different Taq density on RAPD band under temperature of 35℃(35℃)AZ(1~4)、BG(5~8)
2.2.3 退火温度及Taq浓度的优化 12种退火温度的优化结果见图6。在实验区间内,随着退火温度的提高,条带数减少(图6箭头所示a),产物量降低(图6箭头所示b)。为了进一步验证退火温度对反应体系的稳定性,结合Taq浓度进行体系的优化,选择了35、37℃这两种温度和4种Taq浓度进行实验,结果见图7、图8。从退火温度方面考虑,随着温度的提高,小片段比例增加,大片段比例减少,且体系不稳定,表现为条带的缺少(图8箭头所示c、d),而35℃条件下体系稳定;从Taq浓度考虑,当Taq为0.25U时,都未能扩增出条带,当Taq为0.5U,引物AZ未能扩增出条带,引物BG的条带模糊,说明扩增的产物量较少,综合比较1.0U和2.0U的表现,确定前者为适合的Taq浓度。
2.2.4 循环数的优化 设计4个不同次数的循环进行扩增,在2种引物中的表现见图9。当循环数为30时,引物AZ未扩增出条带,而引物BZ扩增出3条带,将循环数提高至35时,2种引物都扩增出条带,数目与40、45次循环一致,但产物量明显减少,而40次循环和45次循环扩增在2种引物中未见差异,故选择40次循环。
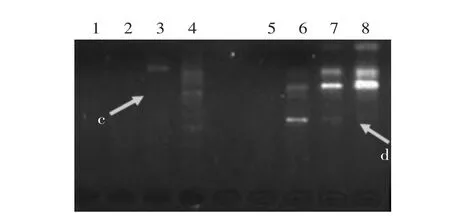
图8 不同Taq浓度对带型的影响(37℃)Fig.8 Effect of different Taq density on RAPD band under temperature of 37℃AZ(1~4)、BG(5~8)
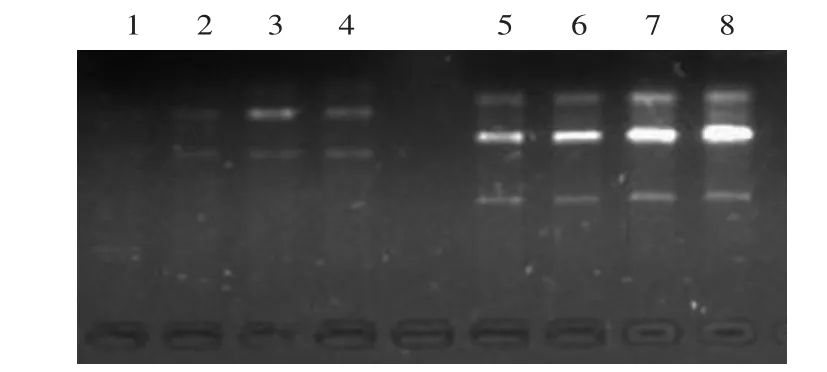
图9 不同循环数对RAPD带型的影响Fig.9 Effect of different cycles on RAPD band AZ(1~4)、BG(5~8)
2.2.5 引物筛选及扩增结果 由表3及图10、图11可知,8个引物共扩增出36条带,多态性条带数为35,多态性比例为97.2%,这主要是由于日本品种与国内育种家所选育的品种亲缘关系较远所致。同时,由于引物AZ未能在d品种“守甜3号”中扩增出引物(图11箭头所示),故利用该引物可在分子水平上鉴别“守甜3号”与其它11个品种。
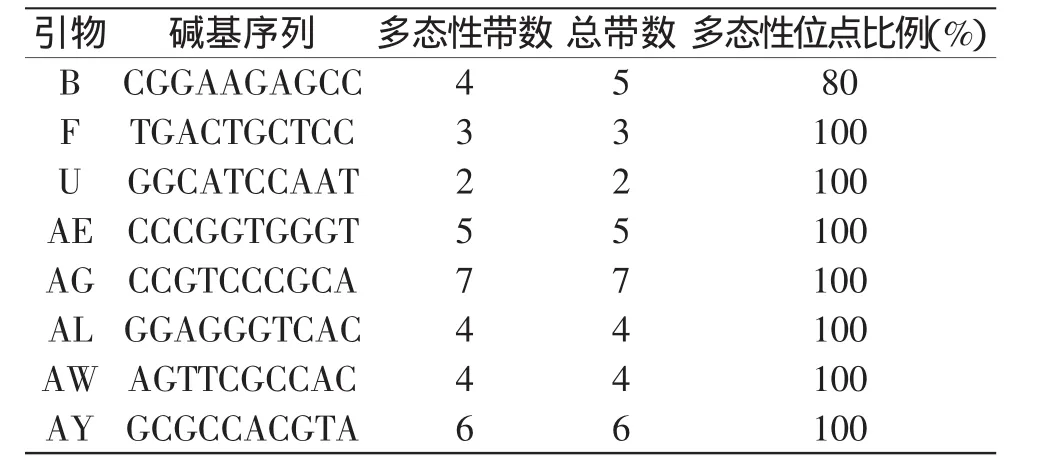
表3 引物的扩增结果Table 3 Amplification results of different primers
2.2.6 品种亲缘关系分析 根据8个引物的扩增结果,用DPS软件绘制出甜叶菊12个品种的亲缘关系聚类图(图12)。由图12可知,品种内遗传距离的变异范围为0.12~0.88,国内品种与来自日本的两个品种,尤其是与“守甜3号”的亲缘关系较远。
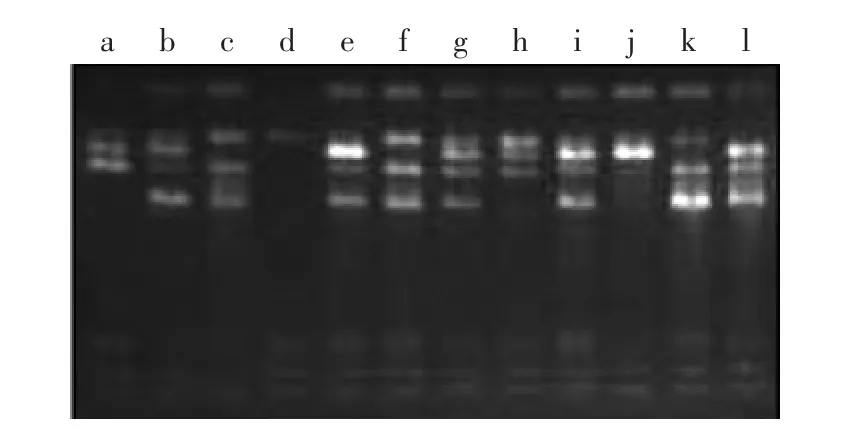
图10 引物B扩增结果Fig.10 Amplification results of primer BG

图11 引物AZ扩增结果Fig.11 Amplification results of primer AZ
当遗传距离为0.37时,可将上述12个甜叶菊品种分为四类。第一类是来自日本的品种“守甜3号”,第二类是品种“ST”,第三类包括两个品种,分别为“守甜2号”和“加3”,其余的8个品种则聚为第四类。从聚类分析结果可知,来自日本的品种和中国的品种亲缘关系较远,这也为系统育种和杂种优势利用提供基础。
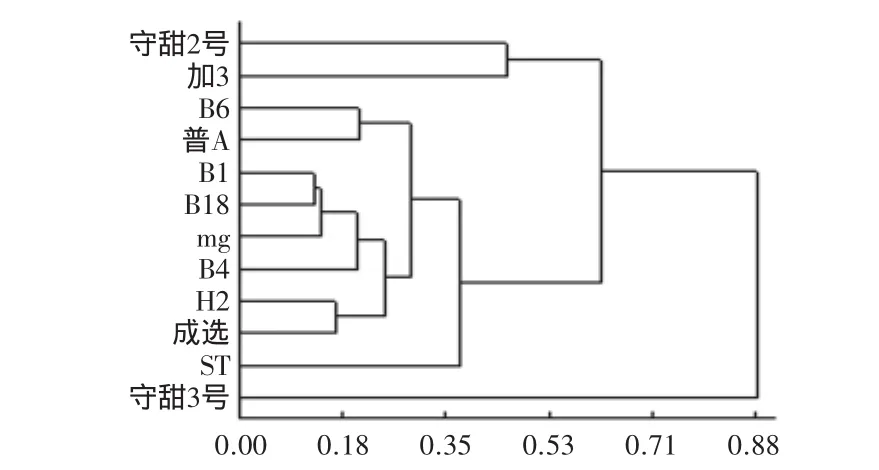
图12 12个品种亲缘关系聚类图Fig.12 Clustering map of relationship in 12 kinds of cultivars
3 结论
任何生物种都具有特定顺序和结构的遗传物质——DNA,RAPD技术就是通过分析遗传物质DNA经过PCR扩增的多态性来诊断生物体内在基因排布与外在性状表现规律的一项技术,该技术只需要一个长度为10bp的核苷酸为引物,其使用不必预先知道DNA序列的信息。因此,可以在对被检对象无任何分子生物学资料的情况下对其基因组进行分析[10]。
许多研究发现,RAPD带谱对实验程序和条件的变化很敏感。一般影响条带的数目、大小和强度的因素有DNA条件和含量、引物浓度、dNTPS和Mg2+浓度、循环数、退火温度、Taq酶浓度等[10]。本实验采用单因素实验,以上述7个因子对甜叶菊RAPD反应体系开展优化研究,探索合适的反应体系。通过对RAPD反应体系的7个因子的优化表明,适合甜叶菊20μL的RAPD反应体系为:双蒸水13.6μL,10×Buffer(含15mmol/L MgCl2)溶液3μL,2.5mmol/L的dNTPS 1.2μL,10μmol/L的引物1μL,20ng的模板DNA 1μL,1U Taq聚合酶;热循环程序为:94℃预变性4min,94℃变性30s,35℃退火30s,72℃延伸1min,40个循环,最后72℃延伸7min。利用该体系可以获得稳定的扩增产物。
近10年来,各种不同分子标记技术在不同植物上的应用见诸报端,其优化方法也各不相同[12-15]。如辣椒RAPD优化的单因素实验法(马艳青,2001)和回归分析法(张子学等,2005),万寿菊RAPD优化的正交设计法(沈一岚等,2006),金弹RAPD优化的单因素实验结合均匀设计法(张宏梓等,2009),天门冬ISSR优化的单因素实验和正交设计法(欧立军等,2011),以单因素实验法和正交设计法居多。在上述优化方法中,单因素实验法直观、明了,但对于各因素在优化体系中的重要性大小及因素之间的互作无法计算,其结果是局部最优[14];正交设计法属于多因素多水平实验方法,可以用较少的处理组合数研究较多的实验因素,可估计各因素对结果的重要性大小,其最优组合仍然属于具体实施的实验组合中;回归分析法则通过建立方程,对入选因子进行优化分析,比较因子之间的作用大小和互作效应的影响,获取稳定的优化体系,该体系中因子的最优水平往往并非实验所设计的,因此,该设计方法对统计学知识的应用提出了更高的要求。
基于稳定的RAPD反应体系,本实验将12个甜叶菊品种进行了亲缘关系聚类。品种间的遗传距离变异范围为0.12~0.88,在遗传距离为0.37时,可将12个品种分为四类,其中来自日本的甜叶菊品种与国内的品种遗传距离较远,这种分析结果可为甜叶菊的系统育种和优势杂交育种工作提供重要的理论依据。
[1]舒世珍.中国甜叶菊栽培及应用技术[M].北京:农业出版社,1994:1-4.
[2]杨文婷,蔡乾蓉,徐应文,等.四川引种甜叶菊的糖苷含量变异及优良单株筛选[J].中国糖料,2010(2):27-30,34.
[3]张志,滕祥金,郝再彬.薄板层析法分析甜叶菊糖苷[J].中国调味品,2009,34(3):94-95,98.
[4]Sung JH.Rapid in vitro propagation and enhanced stevioside accumulation in Stevia rebaudiana Bert[J].Journal of Plant Biology,2006,49(4):267-270.
[5]Sreedhar R V,Cenkatachalam L,Thimmaraju R,et al.Direct organogenesis from leaf explants of Stevia rebaudiana and cultivation in bioreactor[J].Biologia Plantarum,2008,52(2):355-360.
[6]Ferrira C M,Walter H.Production,maintenance and plant regeneration from cell suspension cultures of Stevia rebaudiana(Bert.)Bertoni[J].Plant Cell Reports,1988(7):123-126.
[7]Ibrahim I A,Nasr M I,Mohammedm B R,et al.Nutrient factors affecting in vitro cultivation of Stevia rebaudiana[J].Sugar Tech,2008,10(3):248-253.
[8]Motomu A,Takeo S,Yoko K,et al.Mass propagation of shoots of Stevia rebaudiana using a large scale bioreactor[J].Plant Cell Reports,1994,13:180-183.
[9]胡能兵.紫色辣椒再生体系的建立及种质亲缘关系分析[D].合肥:安徽农业大学,2008.
[10]周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005:79-85.
[11]张子学,侯喜林.回归分析在辣椒品种RAPD反应体系优化中的应用[J].云南植物研究,2005,27(4):425-432.
[12]马艳青.辣椒种质资源的RAPD技术建立及其应用研究[D].长沙:湖南农业大学,2001.
[13]沈一岚,续九如,李福荣,等.万寿菊RAPD分子标记优化体系的建立[J].吉林林业科技,2006,35(1):10-14.
[14]张宏梓,黄儒珠,吴擢溪,等.金弹总DNA提取及RAPD体系优化[J].亚热带植物科学,2009,38(1):7-11.
[15]欧立军,颜旺,廖亚西,等.天门冬ISSR分子标记技术的建立与体系优化[J].中草药,2011,42(2):353-357.
Study on optimization of random amplified polymorphic DNA reaction system and genetic relationship in Stevia rebaudiana Bertoni
HU Neng-bing1,HE Ke-qin1,ZHANG Zi-xue1,LIN Ping1,SUI Yi-hu1,CUI Guang-rong1,2,*
(1.College of Plant Science,Anhui Science and Technology University,Fengyang 233100,China;2.Anhui Province Research and Technology Center of Stevia rebaudiana Bertoni,Bengbu 233000,China)
Optimization of 7 factors of random amplified polymorphic DNA(RAPD)reaction system and relationship analysis of 12 kinds of cultivars in Stevia rebaudiana Bertoni were studied.The results indicated that,optimization system of 20μL included:13.6μL of ddH2O,3μL of 10×Buffer with 15mmol/L MgCl2,1.2μL of 2.5mmol/L dNTPS,1μL of 10μmol/L Primer,1μL of 20ng DNA and 1unit of Taq polymerase;thermal cycle program was:1 cycle of denaturing for 4min at 94℃,40 cycles of denaturing for 30s at 94℃,annealing for 30s at 35℃,primer extension for 1 min at 72℃,and the last cycle of extension for 7min at 72℃.The result of clustering showed that the genetic distance among 12 cultivars ranged from 0.12 to 0.88,and could be classified into four groups when the genetic distance was 0.37,while two cultivars from Japan was far away from Chinese cultivars.
Stevia rebaudiana Bertoni;random amplified polymorphic DNA;optimization;genetic realtionship
TS201.1
A
1002-0306(2012)05-0159-05
2011-03-16 *通讯联系人
胡能兵(1980-),男,在职博士,讲师,主要从事园艺植物组织培养及育种工作。
安徽省教育厅省级重点自然科学基金项目(KJ2010A073);蚌埠市科技计划项目(科字051)。
