海参虫草复剂对糖尿病大鼠肾脏保护机制的研究
2012-11-15杨延存王静凤李晓林杨玉红薛长湖
杨延存,王静凤,李晓林,张 珣,杨玉红,薛长湖
(中国海洋大学食品科学与工程学院,山东青岛266003)
海参虫草复剂对糖尿病大鼠肾脏保护机制的研究
杨延存,王静凤,李晓林,张 珣,杨玉红,薛长湖*
(中国海洋大学食品科学与工程学院,山东青岛266003)
目的:研究海参虫草复剂(Apostichopus japonicus and Cordyceps militaris,AC)对链脲佐菌素(Streptozocin,STZ)诱导的糖尿病大鼠肾脏功能的保护作用。方法:采用一次性腹腔注射STZ 60mg/kg建立大鼠糖尿病模型,在长期高血糖环境下造成对肾脏的损伤。糖尿病大鼠分为海参虫草复剂低剂量组和高剂量组,灌胃剂量分别为300、1200mg/kg·bw,8周后分别检测大鼠肾肥大指数、尿中总蛋白、微量白蛋白(Microalbuminuria,mAlb)和N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-Glucosaminidase,NAG)含量,并取肾皮质对其结构变化进行显微和亚显微观察。结论:海参虫草复剂能显著防止糖尿病肾病大鼠肾小球肥大、降低mAlb与NAG排泄率、降低肾小管内溶酶体数量、减轻肾小管的肿胀程度、保护肾小管刷状缘结构,说明海参虫草复剂对糖尿病大鼠肾脏的结构和功能具有显著的保护作用。
日本刺参,蛹虫草,糖尿病肾病,肾小球基底膜
糖尿病肾病(Diabetes nephropathy,DN)是糖尿病最常见的慢性并发症之一,是糖尿病病人致残和减寿的主要原因之一[1]。因此如何有效防治DN是当前糖尿病和肾脏病学者们共同面临的一个重要任务[2]。国内外学者对海参营养成分的研究表明,海参富含各种人体所需的氨基酸、维生素、脂肪酸以及常量和微量元素,几乎不含胆固醇[3],并且含有海参皂苷、海参多糖、胶原蛋白等活性成分,具有抗肿瘤、提高免疫力、调节血脂、延缓衰老等功效。蛹虫草,又称北冬虫夏草、北虫草等,是冬虫夏草的近缘种,其味甘、性平,有益肺肾、补精髓、止血化痰的功能[4]。研究表明,蛹虫草含有虫草酸、虫草素、虫草多糖、蛋白质、超氧化物歧化酶、维生素及多种微量元素,与冬虫夏草的化学成分基本相同且功效相近,具有提高免疫力、抗肿瘤、降血糖、降血脂等多方面药理作用[5-8]。海参和虫草对肾脏的保护作用近年来逐渐受到关注。将二者配药具有大补元气、补肾益肺、养血生精之功效。本实验将海参和虫草制成复剂灌胃经STZ诱导糖尿病大鼠,研究其对糖尿病大鼠肾脏功能的调节作用,并对其保护机制进行深入探讨,为其合理开发应用提供理论依据。
1 材料与方法
1.1 材料与仪器
健康SD大鼠 雄性,体重(200±20)g,SPF级,由北京维通利华实验动物技术有限公司提供,合格证号为 SCXK(京)2007-0001;干制日本刺参(Apostichopus japonicus)、蛹虫草(Cordyceps militaris)均由市场购得,分别经超微粉碎后,按2∶1的比例混合制成海参虫草复剂(AC),室温储存;蒸馏水配制成所需浓度悬浊液;STZ 美国Sigma公司产品;尿微量白蛋白测试盒 上海太阳生物技术有限公司产品;葡萄糖试剂盒 中生北控生物科技股份有限公司产品;β-N乙酰葡萄糖苷酶测定试剂盒南京建成生物工程研究所产品。
680型酶标仪 美国Bio-Rad公司;TGL-16G型台式离心机 上海安亭科学仪器厂;HW.SY11-K电热恒温水浴锅 北京市长风仪器仪表厂;WFJ2000型可见分光光度计 上海尤尼柯仪器有限公司; BH-2正置显微镜 日本OLYMPUS公司。
1.2 实验方法
1.2.1 动物分组及模型建立 SD大鼠适应性喂养5d,随机取出10只作为正常对照组,其余大鼠禁食不禁水12h,一次性腹腔注射STZ 60mg/kg·bw(临用前溶解于pH=4.3、0.1mmol/L的柠檬酸-柠檬酸钠缓冲液,终浓度为2%)。正常对照组大鼠注射等体积柠檬酸缓冲液。继续饲养3d后,禁食不禁水5h,尾静脉采血,测空腹血糖值,以血糖值≥16.7mmol/L者为造模成功。
将造模成功的大鼠按照体重及血糖值随机分为3组:模型对照组、海参虫草复剂低、高剂量组,每组10只。剂量组灌胃海参虫草复剂(分别为 300、1200mg/kg·bw),正常和模型对照组灌胃生理盐水。灌胃体积均为10mL/kg·bw,1次/d,共8周。实验期间大鼠自由进食普通饲料和饮水。
1.2.2 肾肥大指数测定 大鼠麻醉后摘取双肾,称重,并计算肾脏肥大指数:肾脏肥大指数(%)=双侧肾脏重量之和/体重×100%。
1.2.3 尿中总蛋白、微量白蛋白(mAlb)含量测定实验结束前4d,大鼠于代谢笼中单只饲养,收集24h尿液,记录尿液总体积。取一定量尿液离心,上清液于-20℃冻存。尿中总蛋白含量采用双缩脲法测定。mAlb含量参照试剂盒方法检测。
1.2.4 尿液中 N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-Glucosaminidase,NAG)活力测定在400nm处测NAG水解产物的吸光度,并计算酶活力单位。酶活力单位(U/L)=(测定管OD值-对照管OD值)/(标准管OD值-空白管OD值)×标准品浓度/15×1000,尿液中NAG含量参照试剂盒方法检测,并计算其排泄率=尿液中NAG含量×24h尿量。
1.2.5 肾脏的组织学观察 大鼠于末次给药后禁食不禁水10h,称重后,腹腔注射3%戊巴比妥钠进行麻醉(剂量为35mg/kg·bw),经心脏插管注入4℃预冷生理盐水灌洗至肾脏颜色发白后,取肾皮质于10%中性甲醛中固定,常规石蜡包埋,制成4μm切片。切片经HE染色,于显微镜下观察和拍照。
1.2.6 透射电镜观察 取大鼠肾皮质,切取体积为1mm3的组织块,用2.5%戊二醛缓冲液固定,常规透射电镜制样,超薄切片,透射电镜观察。
1.2.7 统计学分析 数据分析采用SPSS11.0软件进行单因素方差分析,同时进行LSD比较,以<0.05为具有统计学意义上的差异。实验结果用±s表示。
2 结果与分析
2.1 对肾脏肥大指数的影响
肾脏肥大是糖尿病肾病早期的重要病理特征。由表1可见,与正常对照组相比,模型对照组大鼠的肾脏肥大指数升高了89.84%(P<0.01)。经灌胃海参虫草复剂后,各组大鼠肾肥大指数均显著下降,平均较模型对照组下降了21.25%(P<0.05),说明海参虫草复剂可显著抑制高血糖引起的肾脏肥大。
2.2 对尿中总蛋白、微量白蛋白(mAlb)含量的影响
尿蛋白及mAlb检测为早期糖尿病肾病的临床诊断指标。由表1可见,与正常对照组比较,模型对照组大鼠的尿总蛋白和mAlb排泄率分别提高了236.25%和135.14%(P<0.01)。与模型对照组相比,低、高海参虫草复剂均能显著降低模型大鼠的尿总蛋白和mAlb排泄率(P<0.05,P<0.01),平均降低了32.30%和38.51%。
表1 海参虫草复剂对大鼠肾脏指数、尿蛋白和mAlb的影响(n=10,±s)Table 1 Effects of AC on kidney index,protein,and mAlb in diabetic rats(n=10,±s)
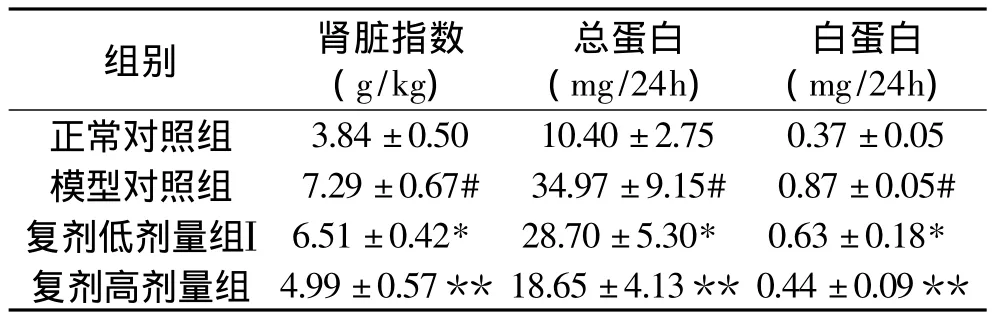
表1 海参虫草复剂对大鼠肾脏指数、尿蛋白和mAlb的影响(n=10,±s)Table 1 Effects of AC on kidney index,protein,and mAlb in diabetic rats(n=10,±s)
注:#P<0.01与正常对照组相比较;*P<0.05,**P<0.01与模型对照组相比较;图1同。
组别 肾脏指数(g/kg)总蛋白(mg/24h)白蛋白(mg/24h)**3.84±0.50 10.40±2.75 0.37±0.05模型对照组 7.29±0.67# 34.97±9.15# 0.87±0.05#复剂低剂量组Ⅰ 6.51±0.42* 28.70±5.30* 0.63±0.18*复剂高剂量组 4.99±0.57**18.65±4.13**0.44±0.09正常对照组
2.3 尿液中NAG排泄率的影响
NAG是一种溶酶体水解酶,主要存在于近端肾小管细胞的溶酶体中,尿液中NAG活性增高可作为肾小管细胞损伤的早期标志物[9]。由图1可见,模型对照组大鼠NAG排泄率较正常对照组提高了2.9倍(P<0.01),经灌胃样品后,各组大鼠NAG排泄率均显著降低(P<0.05,P<0.01),分别较模型对照组降低了33.89%、46.61%。
2.4 肾皮质的显微观察
在光镜下可见,正常对照组大鼠的肾小球体积正常,毛细血管袢开放,系膜细胞无增生,肾小管结构正常(见图2-A)。模型对照组大鼠肾小球体积增大,系膜区明显扩增,系膜细胞增生,GBM增厚明显,肾小管出现明显肿胀(见图2-B)。灌胃海参虫草复剂8周后,大鼠肾小球病理症状得到明显改善。其中,海参虫草复剂高剂量组肾小球体积基本恢复正常,毛细血管袢开放,未见系膜细胞增生和GBM增厚,肾小管结构趋于正常(见图2-C)。表明海参虫草复剂能显著改善糖尿病大鼠肾小球肥大及系膜细胞增生现象。
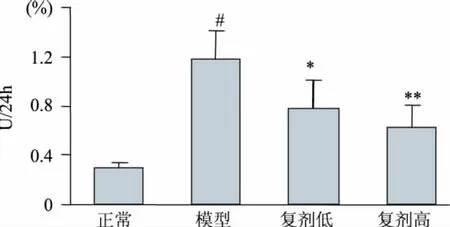
图1 海参虫草复剂对模型大鼠NAG排泄率的影响(n=10,±s)Fig.1 Effects of AC on the excretion of NAG in diabetic rats(n=10,±s)
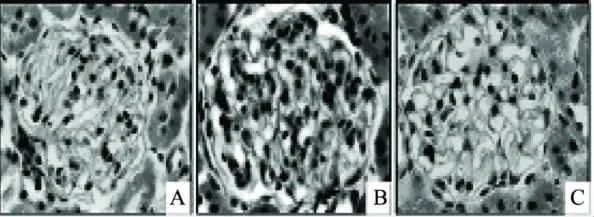
图2 糖尿病大鼠肾皮质显微观察HE染色(400×) Fig.2 HE stains of renal cortex in diabetic rats(400×)
2.5 肾皮质的亚显微观察
2.5.1 肾小球 正常大鼠肾小球结构清晰,滤过膜厚度均匀,三层细微结构清晰(图3-A,f、b、p所示)。足突分布均匀,无融合现象。模型对照组大鼠肾脏滤过膜节段性增厚,内皮细胞三层细微结构消失成匀质状(图3-B),足细胞突多呈连续性附着于基膜上,形成足突融合。系膜细胞中出现细胞核凋亡,染色质凝结成块,系膜区扩大,系膜基质增多,系膜区出现溶酶体大量聚集的情况(图3-C,L所示),表明模型对照组肾小球内存在炎症;经海参虫草复剂干预后,均有所改善。其中,高复剂组效果最为突出,组成结构接近正常大鼠(图3-D)。表明海参虫草复剂可有效保护糖尿病大鼠肾小球滤过膜结构,从而改善肾小球的滤过功能。
2.5.2 肾小管 正常对照组大鼠肾小管上皮细胞排列整齐,游离面具有刷状缘,近曲小管近端刷状缘涮状缘整齐致密,远端稀疏(图4-A,b所示)。基部内陷成顶部小管和顶部小泡,衬在小管和小泡膜的内面有一层中等电子密度的糖衣。这种结构为近曲小管吸收蛋白的一种方式。基底面可见系膜内褶系,褶间有许多纵行排列的杆状线粒体,并可见少量溶酶体(图4-A,L所示)。模型对照组大鼠肾小管上皮细胞脱落、涮状缘微绒毛减少变短、甚至脱落,胞质内出现大量溶酶体(图4-B,L所示)及空泡,且伴有髓样结构出现(图4-C)。经灌胃海参虫草复剂后,模型大鼠近曲小管近端结构基本正常,刷状缘微绒毛排列整齐致密,溶酶体数量较少(图4-D)。表明海参虫草复剂对糖尿病大鼠肾小管具有保护作用。
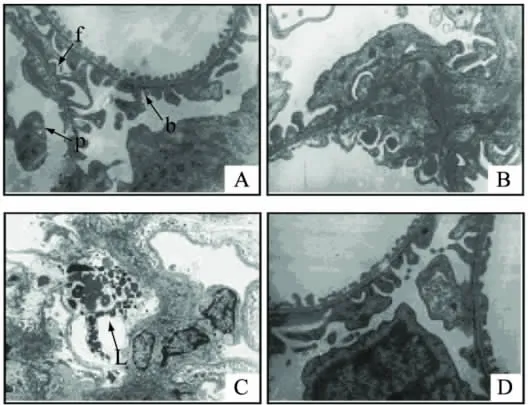
图3 糖尿病大鼠肾小球的透射电镜观察结果(10000×)Fig.3 Electron microscopy of glomerular in diabetic rats(10000×)

图4 糖尿病大鼠肾小管的透射电镜观察结果(8000×)Fig.4 Electron microscopy of tubular in diabetic rats(8000×)
3 讨论
NAG是一种重要的溶酶体水解酶,尿液中NAG主要来源于肾脏近曲小管上皮。当蛋白自肾小球滤过增多时,在近曲小管重吸收,导致溶酶体酶激活,随尿排出量增多。因此NAG可反映肾小管细胞的损害程度。孙建红[10-11]等报道,虫草能有效的降低血清Cr、BUN水平,减轻内生肌酐清除率的下降,降低尿中NAG和尿蛋白含量。本实验结果表明海参虫草复剂和虫草均能显著降低DN大鼠mAlb与NAG排泄率。
DN的病理特点是肾脏肥大,肾小球滤过膜增厚和以肾小球系膜区为主的ECM积聚。ECM增加是糖尿病微血管病变的结构标志,肾内ECM的积聚及血管内皮细胞受损是出现蛋白尿、肾功能下降等DN临床表现的结构基础[12]。ECM增多与细胞增殖密切相关。许多研究证实,细胞增生出现于ECM蓄积之前,并持续存在于ECM蓄积及肾小球硬化发展过程中。本实验结果表明,海参虫草复剂能显著抑制糖尿病大鼠ECM的积累和滤过膜变厚,减轻系膜细胞的增生,防止肾小球肥大。提示海参虫草复剂对肾小球的结构和功能具有显著的保护作用。
肾小管的主要功能是进行重吸收。DN患者因肾小球病变,导致肾小球滤过膜的通透性增强,滤过液中出现蛋白质,从而激活了近曲小管内的溶酶体,继而造成肾小管损害。本实验结果表明,海参虫草复剂能显著降低肾小管内溶酶体数量,减轻肾小管的肿胀程度,保护肾小管刷状缘结构。提示海参虫草复剂对肾小管的结构和功能具有显著地的保护作用。尿液生化分析表明,海参虫草复剂能显著降低糖尿病大鼠尿蛋白、白蛋白和NAG水平,该结果进一步从功能上证明了海参虫草复剂对糖尿病大鼠肾脏的保护作用。
[1]史铁蘩.协和内分泌和代谢学[M].北京:科学出版社,1999:1349-1351.
[2]胡仁明.内分泌代谢病临床新技术[M].北京:人民军医出版社,2002:464-468.
[3]肖枫,曾名湧,董士远,等.海参胶原蛋白的研究进展[J].水产科学,2005,24(6):39-41.
[4]吴征镒.新华本草纲要[M].上海:上海科学技术出版社,1990:731.
[5]孙悦迎,张旭东.冬虫夏草与蛹虫草特性分析[J].中医药学报,2002,30(2):43-44.
[6]汤晓云.蛹草的研究进展[J].基层中药杂志,2002,16(4): 50-53.
[7]王筱霞,吴兆龙.冬虫夏草对离体人肾小球系膜增殖的影响[J].中国临床药学杂志,2001,10(1):24-26.
[8]王要军,孙自勤,权启镇,等.冬虫夏草对人成纤维细胞形态及细胞外基质合成功能的影响[J].滨州医学院学报,1999,22(3):226-227.
[9]欧阳涓,姜傥.肾脏的损伤性诊断[J].中华检验医学杂志,2005,28(8):877-879.
[10]孙建红,何戎华,任传路,等.虫草制剂和开博通对糖尿病大鼠肾脏功能和形态影响的对比研究[J].徐州医学院学报,2000,20(6):450-453.
[11]黄海泉.百令胶囊治疗Ⅱ型糖尿病伴微白蛋白尿的临床观察[J].中国药业,2000,9(8):43.
[12]Striker LJ,Peten EP,Elliot SJ,et al.Biology of diseasemesangial cell turnover:effect of heparin and petide growth factors[J].Lab Invest,1991,64(3):446-456.
The protection mechanism of the mixture of Apostichopus japonicus and Cordyceps militaris in kidney of diabetic rats
YANG Yan-cun,WANG Jing-feng,LI Xiao-lin,ZHANG Xun,YANG Yu-hong,XUE Chang-hu*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
Objective:To study the protection mechanism of the mixture of Apostichopus japonicus and Cordyceps militaris(AC)in kidney of diabetic rats which were induced by Streptozotocin(STZ).Methods:Rats diabetic model,in which the kidneys were damaged under long-term high levels of blood glucose,was induced by one-time intraperitoneal injection of Streptozotocin(60mg/kg).The diabetic rats were given different dosage of the mixture of Apostichopus japonicus and Cordyceps militaris 300mg/kg·bw and 1200mg/kg·bw,8 weeks later,each of the following indicators were inspected:the renal index,the excretion of protein,Microalbuminuria(mAlb),N-acetyl-β-D-Glucosaminidase(NAG)in urine and the morphologic change in kidney with electron microscopy and transmission electron microscopy.Conclusion:The mixture of Apostichopus japonicus and Cordyceps militaris decrease the renal index,mAlb,NAG,and amounts of lysosome in renal tubules.The AC also suppressed turgidity of renal tubules and protects structure of kidney.The mixture had remarkable function of protection in kidney of diabetic rats.
Apostichopus japonicus;Cordyceps militaris;diabetes nephropathy;glomerular basal membrane
TS201.4
A
1002-0306(2012)02-0396-04
2011-01-10 *通讯联系人
杨延存(1985-),男,硕士研究生,研究方向:功能性食品。
海洋功能食品功效因子高效制备技术及产业化示范(201105029);海洋公益性行业科研专项和水环境污染、水产食品安全及废弃物综合利用技术研究(010DFA31330);国际科技合作项目。
