啤酒糟蛋白中高F值寡肽的制备
2012-11-15刘玲,刘茜,王红
刘 玲,刘 茜,王 红
(沈阳农业大学食品学院,辽宁沈阳110866)
啤酒糟蛋白中高F值寡肽的制备
刘 玲,刘 茜,王 红
(沈阳农业大学食品学院,辽宁沈阳110866)
以啤酒糟为原料,采用双酶水解法制备高F值寡肽。通过对蛋白质水解度的测定,采用响应面法进行优化,得出双酶水解最佳条件为:碱性蛋白酶加酶量为6%、酶解时间4h、pH8.6、酶解温度56℃;木瓜蛋白酶的加酶量为3%、酶解时间3h、pH6.3、酶解温度48℃。用活性炭吸附酶解液,去除其中的芳香族氨基酸,采用G-25葡聚糖凝胶分离纯化,测其分子质量为794.24u,此时的F值为21.02。
啤酒糟蛋白,酶解,响应面法(RSM),高F值寡肽
F值是指支链氨基酸(BCAA)与芳香族氨基酸(AAA)的摩尔比值[1]。高F值寡肽即是由动、植物蛋白酶解后制得的具有高支链、低芳香族氨基酸组成的寡肽,具有消除或减轻肝性脑病症状、改善肝功能和蛋白质营养失常状态及抗疲劳等功能[2]。一般认为,F值大于20时具有治疗效果[3]。啤酒糟(BSG)是啤酒生产过程中最大量的副产物,它是由麦芽和未发芽谷物原料在啤酒糖化中的不溶解物质组成的[4]。其营养成分为:蛋白质24%~28%,脂肪8%~11%,纤维素55%~61%,糖分1%~3%,灰分3%~5%。我国啤酒糟主要作为饲料使用,很少一部分用来生产食醋[5]。近年来,人们致力于将麦糟转化为高蛋白质源和饮食纤维源的研究,以提高麦糟的应用价值。本研究采用多次水洗法提取啤酒糟蛋白,然后采用响应面法对水提啤酒糟蛋白的两次酶解条件进行优化,酶解液经过分离纯化后得到高F值寡肽。该高F值寡肽的制备有利于更大程度地开发啤酒糟蛋白质再生资源,扩大其使用范围,实现经济效益和社会效益双丰收。
1 材料与方法
1.1 材料与设备
啤酒糟 沈阳华润雪花啤酒厂;碱性蛋白酶诺维信(中国)生物技术有限公司;木瓜蛋白酶 国药集团沈阳化学试剂有限公司;其他试剂 均为分析纯。
胶体磨 新光动力机械公司;数显恒温水浴锅HH-6 国华电器有限公司;TD25-WS低速自动平衡离心机 长沙湘仪离心机仪器有限公司;pH S-25酸度计 上海雷磁仪器厂;TU-1810紫外可见分光光度计 北京普析通用仪器有限公司;日立835-50氨基酸自动分析仪。
1.2 实验方法
1.2.1 提取蛋白 湿啤酒糟水浸泡一段时间,胶体磨粉碎、过筛,去除筛上物,离心、沉淀水洗,重复3~5次。弃去上清液,沉淀干燥、粉碎,得到啤酒糟蛋白。
1.2.2 高F值寡肽制备[6]啤酒糟蛋白纤维素酶[7]水解后,分别加入碱性蛋白酶和木瓜蛋白酶水解、离心,上清液活性炭吸附过滤,得到寡肽混合物,透析脱盐,SephadexG-25柱分离纯化,得到高F值寡肽溶液,浓缩干燥得到高F值寡肽干品。
1.2.3 水解度的测定 甲醛电位滴定法[8]。
1.2.4 分子量大小的测定 采用SephadexG-25凝胶装柱,上样量为1mL,双蒸水1mL/min的速度洗脱,流出液280nm检测,根据寡肽溶液的洗脱体积,用凝胶层析法[8-9]测其相对分子质量。
1.2.5 氨基酸分析和F值的测定 通过氨基酸自动分析仪测定酶解液中氨基酸的组成成分,计算F值。

1.2.6 酶解条件的单因素实验
1.2.6.1 加酶量对水解度的影响 取5份啤酒糟蛋白,每份2g,1∶10料液比加水,纤维素酶水解,离心取滤渣,50℃、pH9.0条件下分别加入碱性蛋白酶1%、3%、5%、7%、9%,恒温酶解4h,4000r/min离心15min,取上清液,定容至100mL,测量pH,记录NaOH消耗,计算其水解度。
1.2.6.2 温度对水解度的影响 pH9.0,加酶量5%,时间4h条件下,温度分别为45、50、55、60、65℃,其余做法同上,记录NaOH消耗,计算其水解度。
1.2.6.3 时间对水解度的影响 50℃,pH9.0,加酶量5%的条件下,时间分别为2、3、4、5、6h,其余做法同上,记录NaOH消耗,计算其水解度。
1.2.6.4 pH对水解度的影响 50℃,加酶量5%,4h条件下,pH分别为7.5、8.0、8.5、9.0、9.5,其余做法同上,记录NaOH消耗,计算其水解度。
1.2.7 响应面法对酶解条件的优化 综合单因素实验结果,根据Box-Benhnken的中心组合实验设计原理,采用响应面法在3因素3水平上对啤酒糟蛋白的酶解条件进行优化,设计采用15个实验点,1~12为析因实验,13~15为中心实验,析因点为自变量,取值在X1、X2、X3所构成的三维顶点,0点为区域的中心点,0点实验重复3次。实验因素和水平见表1。

表1 响应面分析因素及水平表Table 1 Factors and levels table of RSM analysis
2 结果与讨论
2.1 单因素实验结果

图1 加酶量对水解度的影响Fig.1 Effect of the amount of enzyme on the degree of hydrolysis
2.1.1 加酶量对水解度的影响 由图1可知,加酶量从1%~5%递增,水解度显著增加;从5%增加到9%水解度的变化不大,考虑成本选择最适加酶量为5%。
2.1.2 温度对水解度的影响 由图2可知,在55℃之前,水解度随温度的升高不断增加,55℃时达到最大。之后由于温度过高使部分酶失活,水解度开始下降,所以选择最佳酶解温度为55℃。

图2 温度对水解度的影响Fig.2 Effect of hydrolysis temperature on the degree of hydrolysis
2.1.3 时间对水解度的影响 由图3可知,水解度在4h之前增加较明显,之后水解度的变化较平缓,逐渐趋于一条直线,为了节省时间,选择最佳的酶解时间为4h。
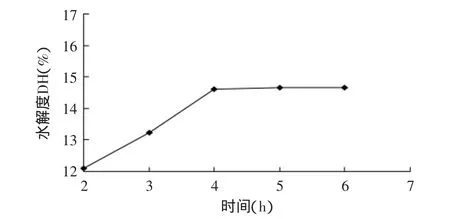
图3 时间对水解度的影响Fig.3 Effect of hydrolysis time on the degree of hydrolysis
2.1.4 pH对水解度的影响 由图4可知,pH7.5~8.0时,水解度增加比较缓慢;pH8.0后,水解度增加比较显著;当pH8.5时达到最大的水解度,之后缓慢下降;当pH>9.0时,水解度显著下降,所以选择最佳的酶解pH为8.5。

图4 pH对水解度的影响Fig.4 Effect of pH on the degree of hydrolysis
2.2 响应面分析
2.2.1 回归模型的建立及方差分析 在单因素实验结果基础上,确定水解时间为4h。采用Box-Benhnken的中心组合实验设计原理,分析三个主要因素加酶量(%)、酶解温度(℃)及pH,分别用X1、X2、X3来表示,并以1、0、-1代表变量水平,以x1=(X1-5)/2,x2=(X2-55)/5,x3=(X3-8.5)/0.5为自变量,以水解度Y为响应值进行响应面分析实验,实验结果见表2。

表2 响应面实验方案与结果Table 2 Test design and result of RSM

表3 回归系数分析Table 3 Analysis of regression coefficient

表4 回归方程方差分析Table 4 Variance analysis of regression equation
以啤酒糟蛋白的水解度为响应值(Y),采用Minitab15统计软件对实验结果进行回归分析,经过回归拟合得到回归模型方程为:
Y=-378.94800+437.68800X1+3.15575X2+ 67.64750X3-690.62500X12-0.03905X22-4.25500X32+ 0.10000X1X2-40.00000X1X3+0.14700X2X3
为了说明回归方程的有效性及各因素对水解度的影响程度,对回归方程进行了回归系数及其方差分析,见表3和表4。由表3和表4对回归方程的分析可知,R2=0.9910,模型的显著水平远远小于0.01,此时回归模型是极显著的,说明该方程能正确反映水解度与加酶量、酶解温度及pH之间的关系,证明该实验方法可靠。由表4可知,一次项、二次项及交互作用的P值都小于0.05,达到显著水平。又由表3可知,X1、X2、X3、X12、X22、X32、X1X3、X2X3对响应值Y的影响都极显著,只有交互项中X1X2不显著,这表明实验因子对响应值不是简单的线性关系。方程的失拟误差表现不显著,进一步说明各因素和响应值之间的关系可以用此模型来函数化,可用该回归方程代替实验真实点对实验结果进行分析。

图5 温度与加酶量交互作用对水解度的影响Fig.5 Combined effect of temperature and the amount of enzyme on the degree of hydrolysis
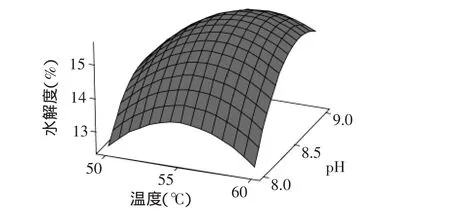
图6 温度与pH交互作用对水解度的影响Fig.6 Combined effect of temperature and pH on the degree of hydrolysis

图7 pH与加酶量交互作用对水解度的影响Fig.7 Combined effect of pH and the amount of enzyme on the degree of hydrolysis
2.2.2 水解度的响应面分析及优化 图5~图7给出了各个因子交互作用对水解度的影响。图5为温度与加酶量交互作用对水解度的影响,当温度为55℃时,加酶量增加则水解度随之增加;当温度过高或过低时,无论加酶量如何变化水解度都降低,但交互作用对水解度的影响不是很显著。图6为温度与pH交互作用对水解度的影响,从响应面的最高点可以看出,在所选范围内存在极值,说明温度与pH的共同作用对水解度的影响较大。图7为pH与加酶量交互作用对水解度的影响,随着pH和加酶量的增加,水解度也随之增加,pH增加到8.6时水解度达到最大,继续增加水解度又会降低,图5~图7与回归方程的方差分析相吻合。
由Minitab15统计软件分析得到最大响应值时x1=0.265,x2=0.252,x3=0.192。与其对应的最佳酶解条件为:加酶量5.53%,酶解温度为56.26℃,pH为8.55,理论最大水解度为15.76%,为了检验响应面法的可行性,采用最佳条件进行验证实验,同时考虑实际操作的便利性,以加酶量6%,酶解温度56℃,pH8.6进行3次重复,水解度平均值为15.36%,与理论值有0.40%的偏差,由此可见此酶解条件是可行的。

表5 高F值寡肽中氨基酸的种类及含量(mmol)Table 5 Components and contents of amino acids in BSG’s high F ratio oligo-peptide(mmol)
2.3 木瓜蛋白酶及活性炭的用量
第二步采用木瓜蛋白酶[11]对酶解液进一步酶解,酶解最优条件同样采用响应面优化法(图略),得到加酶量3%,酶解温度48℃,酶解时间3h,pH6.3为最适酶解条件;活性炭[12]在固液比1∶10,温度30℃,时间2h,pH3.0的条件下静态吸附酶解液中的芳香族氨基酸。
2.4 分子量的测定
采用SephadexG-25将制得的酶解液进行分离纯化,选取铬酸钾、还原型谷胱甘肽、氧化型谷胱甘肽、维生素B12、Nisin为标准品,1mL/min的双蒸水洗脱,280nm收集流出液,根据各标准物质的洗脱体积,作出标准曲线(如图8),其中第3点为寡肽溶液的洗脱体积。然后根据寡肽溶液的洗脱体积,采用凝胶层析方法测其相对分子质量为794.24u。

图8 标准物质的洗脱体积与分子质量的关系Fig.8 The relationship between elution volume and molecular weight of control sample
2.5 啤酒糟蛋白高F值寡肽的氨基酸组成
见表5。
2.6 啤酒糟蛋白F值的计算
由表5可得,BCAA=2.145+1.167+4.236=7.548, AAA=0.241+0.118=0.359,F=7.548/0.359=21.02>20。
3 结论
本文在单因素实验的基础上,采用响应面法,经优化得到最适酶解条件:碱性蛋白酶的加酶量为6%,酶解时间4h,pH8.6,酶解温度56℃,水解度为15.36%;木瓜蛋白酶的加酶量3%,酶解温度48℃,酶解时间3h,pH6.3,水解度为13.78%。得到的酶解液在活性炭与酶解液的固液比1∶10,温度30℃,时间2h,pH3.0的条件下采用静态吸附法吸附酶解液中的芳香族氨基酸。然后采用SephadexG-25对酶解液进行分离纯化,凝胶层析法测定其分子量为794.24u,酶解液用氨基酸自动分析仪测定其氨基酸组成成分,计算F值为21.02,满足高F值寡肽的要求。
[1]陈石良,吴建平,古文英.高F值寡肽的研究进展[J].食品与机械,1998(2):12-14.
[2]孟宪军,迟玉杰.功能食品[M].北京:中国农业大学出版社,2010,7:28-29.
[3]李小勇,李洪军.高F值低聚肽研究进展[J].粮食与油脂,2006(6):9-11.
[4]Stojceska V,Ainsworth P.The effect of different enzymes on the quality of high-fibre enriched brewer’s spent grain breads[J]. Food Chemistry,2008a,110(4):865-872.
[5]杨燕红,薛业敏.利用啤酒糟生产食醋[J].中国酿造,1999(6):13-14.
[6]周敏华,章超桦,曾少葵,等.酶解牡蛎肉制备高F值寡肽的研究[J].现代食品科技,2009,25(7):751-755.
[7]周瑞宝.植物蛋白功能原理与工艺[M].北京:化学工业出版社,2007,9:350-351.
[8]Justo P,Maria MY,Hassane L,et al.Production and characterization of casein hydrolysates with a high amino acid Fischer’s ratio using immobilized proteases[J].International Dairy Journal,2004(14):527-533.
[9]陈雅蕙,陈来同,余瑞元,等.生物化学实验原理和方法[M].北京:北京大学出版社,2005,8:250-256.
[10]赵丰丽,麻维华.米糟蛋白酶解制备高F值寡肽的研究[J].中国酿造,2009(3):96-99.
[11]赵晨霞,刘新华,李治龙,等.活性炭吸附玉米肽中芳香族氨基酸的应用研究[J].食品工业科技,2011,32(6):244-246.
Preparation of high ficher ratio oligo-peptide from protein of brewer’s spent grains
LIU Ling,LIU Qian,WANG Hong
(College of Food Science,Shenyang Agricultural University,Shenyang 110866,China)
High ficher ratio oligo-peptide was achieved from the protein of brewer’s spent grains by the way of double enzymatic hydrolysis.The degree of hydrolysis was optimized by RSM,the optimum conditions of protease were established:the amount of alkaline protease was 6%、time was 4h,pH was 8.6,temperature was 56℃.The amount of papain was 3%,time was 3h,pH was 6.3,temperature was 48℃.The hydrolysis fluid was absorbed in active carbon in order to remove the aromatic amino acids and was purified by G-25 gel flirtation chromatography,then determined the molecular weight was 794.24u and the high F value was 21.02.
protein of brewer’s spent grain(BSG);enzymatic hydrolysis;response surface methodology(RSM);high ficher ratio oligo-peptide
TS201.1
B
1002-0306(2012)09-0309-04
2011-07-22
刘玲(1973-),女,博士,副教授,主要从事食品质量安全的教学和科研工作。
