卵泡中肝素结合表皮生长因子样生长因子的表达及其与卵泡发育的关系
2012-11-15潘伯臣冯翼飞叶莹心
潘伯臣,冯翼飞,叶莹心
(中国医科大学附属盛京医院妇产科辅助生殖中心,沈阳 1 1 0 0 0 4)
卵泡发育是一个以形态变化为特征的生长过程,同时伴随着卵泡功能的分化。这种发育与分化过程是在垂体分泌的促性腺激素、性激素以及卵巢的局部细胞因子的协同作用下完成的。其中,卵巢局部因子如生长因子的作用是不可或缺的,因此也成为近年来卵巢生殖生理研究的热点问题。肝素结合表皮生长因子样生长因子(heparin-binding epidermal growth factor-like growth factor,HB-EGF)是表皮生长因子家族中新的成员,因与肝素有很强的结合力而得名。HB-EGF有2种存在形式:溶解型HBEGF(soluble HB-EGF,sHB-EGF)和膜结合型HBEGF(proHB-EGF),后者是溶解型(也称为分泌型)的前体。sHB-EGF是多种细胞的分裂原,而proHBEGF的生物学效应则主要表现为抑制细胞生长等[1]。
我们先前的研究发现,不孕女性患者在接受体外受精—胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)的超促排卵过程中,获得的黄素化颗粒细胞在体外培养条件下表达HB-EGF及其特异受体,提示了HB-EGF可能在卵泡发育及分化中发挥一定的作用[2,3]。但是,在体情况下卵泡中是否存在HB-EGF表达,尚未见报道。本研究检测IVF-ET超促排卵过程中生成的黄素化卵泡中HB-EGF的表达,并探讨sHB-EGF和proHB-EGF与卵泡发育的关系。
1 材料与方法
1.1 材料
1.1.1 主要仪器和试剂:HB-EGF抗体(美国Santa Cruz公司),高速冷冻离心机(3C15K,美国Sigma公司),多功能电泳仪(北京六一仪器厂),722可见光分光光度计(上海精密科学仪器有限公司),凝胶自动成像及分析系统(ChemiImager 5500,美国Alpha公司)。
1.1.2 实验材料:选择在我院辅助生殖中心接受IVF-ET治疗的患者42例,年龄25~37岁。取卵时,在同一患者同时获取大卵泡与小卵泡的卵泡液。其中17例患者同时分离、获取了黄素化颗粒细胞,用于实验及数据分析。
1.2 方法
1.2.1 超促排卵:取卵前常规给予患者刺激卵泡发育治疗,包括使用促性腺激素释放激素激动剂(达菲林或抑那通)降调垂体敏感性和使用人绝经期促性腺激素(丽申宝或果纳芬)刺激卵泡发育。当最大卵泡长至大于18 mm时,给予人体绒膜促性腺激素(human chorionic gonadotropin,hCG)5 000~10 000 IU促进卵泡进成熟。hCG注射后36 h取卵。
1.2.2 卵泡液及颗粒细胞的采集:按我院常规经阴道B超引导下取卵,记录卵泡直径大小,直径>16 mm定义为大卵泡(成熟卵泡),卵泡直径<14 mm定义为小卵泡(未成熟卵泡)。取卵日根据需要每侧卵巢各取第1个卵泡(大或小卵泡)。卵泡液以1 500 r/min离心10 min,取上清-20℃冰箱保存待测。然后将细胞沉淀物置于60%细胞分离液Percoll表层,4℃、1 200 r/min离心15 min以去除红细胞,收集中间相细胞,PBS洗净后取少许细胞置于显微镜下观察,确认为颗粒细胞后,将颗粒细胞置于-20℃冰箱保存待测。
1.2.3 Western blot测定卵泡液中sHB-EGF蛋白:卵泡液中蛋白定量采用考马斯亮蓝法,按试剂盒说明操作。蛋白变性处理后经12%SDS-PAGE电泳2 h,转印至硝酸纤维素膜,用含5%去脂奶粉的TTBS封闭4℃过夜,加一抗(1∶400)室温下孵育2 h,加碱性磷酸酶标记的二抗(1∶2 000),室温下孵育2 h,清洗后酶法显色。结果量化分析使用FlourChem V 2.0凝胶成像分析软件(美国Alpha公司),记录每条蛋白电泳带的灰度值,进行定量分析。
1.2.4 Western blot测定颗粒细胞中proHB-EGF蛋白:(1)蛋白的提取:取出液氮中冻存的标本,加入RIPA裂解液作用30 min,经超声粉碎后,10 000 r/min离心30 min,吸取上清备用。(2)其余步骤同卵泡液中sHB-EGF蛋白的测定。
1.3 统计学分析
采用SPSS 11.5软件包进行统计学分析。计量资料以x±s表示,组间比较采用配对t检验,计数资料的组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
42例患者穿刺的42个大卵泡中有2个(4.76%)为空卵泡,42个小卵泡中有9个(21.43%)空卵泡,大小卵泡比较,空卵泡比例差异有统计学意义(P<0.05)。
42例患者中,有17例患者可以同时分离到大、小卵泡的卵泡液和颗粒细胞;这部分患者的材料用于HB-EGF的检测和分析。结果发现,大卵泡与小卵泡的卵泡液中sHB-EGF蛋白全部呈阳性表达;同样,所有颗粒细胞中均检测到proHB-EGF的蛋白表达,见图1。
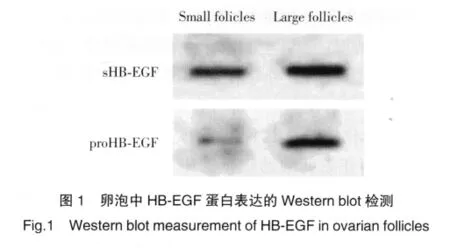
大卵泡和小卵泡卵泡液中sHB-EGF蛋白表达量分别为288.37±15.44和172.06±22.28,大卵泡和小卵泡颗粒细胞中proHB-EGF蛋白表达量分别为76.32±10.05和 28.50±6.20。同一卵泡中,卵泡液中sHB-EGF含量明显大于颗粒细胞中proHB-EGF表达量,差异有统计学意义(P<0.05)。大、小卵泡比较,大卵泡液中sHB-EGF含量明显大于小卵泡,差异有统计学意义(P<0.05);同样,大卵泡中颗粒细胞的proHB-EGF表达量明显高于小卵泡,差异有统计学意义(P<0.05);但小卵泡中sHB-EGF平均含量与proHB-EGF平均含量的比值(6.04)明显高于大卵泡(3.78)。此外,2个大的空卵泡中sHB-EGF含量分别为76.78和89.86。
3 讨论
原始卵泡一旦启动生长,便是一个连续不断的发育和分化过程,要么变成优势卵泡,成熟与排放,要么中途细胞凋亡形成闭锁卵泡。通常以为卵泡是由垂体促卵泡生长激素(follicle-stimulating hormone,FSH)调控的,因为卵泡颗粒细胞中存在FSH受体,而且临床上也发现女性基础FSH水平与卵巢储备功能有关[4],但许多生长因子参与了卵泡的发育及分化过程。例如,转化生长因子β(transforming growth factor-β,TGF-β)可以促进FSH受体的表达,放大FSH诱导的芳香化酶活化、黄体酮生成及黄体生成素(luteinizing hormone,LH)受体产生的生理过程[5]。IVF-ET超促排卵过程中,通常使用超生理剂量的FSH促使卵泡产生大量卵泡,继而使用hCG(LH)进一步促使生长的卵泡成熟与分化,以便获取更多的成熟卵子用于体外受精和胚胎移植,提高接受IVF-ET治疗患者的妊娠率。有报道指出,卵巢局部因子特别是生长因子同样也介导了FSH/LH(hCG)对卵泡的刺激作用。例如,血管内皮生长因子被认为是IVF-ET过程中产生卵巢过度刺激综合征的主要介导因子[6]。但IVF-ET超促排卵过程中产生的卵泡中是否存在HB-EGF,以及HB-EGF是否参与了卵泡的发育与分化,至今尚未见报道。此外,HB-EGF蛋白的2种存在形式即sHB-EGF和pro-HB-EGF,它们在卵泡中的分布如何以及它们与卵泡发育和分化的关系也不十分清楚。
我们在先前的动物试验中发现,大鼠卵巢中HB-EGFmRNA表达量在大鼠发情前期的上午(相当于卵泡生长期)明显高于发情前期的晚上(此时卵巢中存在大量排卵前的成熟卵泡);与此同时,大多数的初级卵泡和全部次级卵泡的颗粒细胞中存在proHB-EGF的蛋白表达,但成熟卵泡的颗粒细胞中却不存在proHB-EGF的表达;而且,闭锁卵泡中正在凋亡的颗粒细胞也表达proHB-EGF。类似的现象同样存在于未成年大鼠假孕模型中:经PMSG刺激卵泡生长后,小卵泡及闭锁卵泡中存在proHB-EGF蛋白表达,而大卵泡中则不存在[7]。这种现象提示,在卵泡发育的相对早期阶段,HB-EGF的表达可能主要是为了卵泡的生长发育,而到卵泡发育晚期接近成熟阶段,HB-EGF新的合成及分泌需要关闭,以利于卵泡的分化成熟。为了进一步研究HB-EGF与人卵泡发育与分化的关系,特别是了解HB-EGF是否参与了IVF-ET中FSH/LH促超排卵过程,我们在先前的研究中对体外培养的人黄素化颗粒细胞进行了检测,发现该细胞中存在HB-EGF及其特异受体的表达[2,3]。本研究在这些前期研究的基础上,进一步探讨HB-EGF是否存在于在体的卵泡中,以及HB-EGF与IVF-ET超促排卵中卵泡的发育与分化是否有关。结果发现,所有检测的卵泡中均存在HBEGF的表达。而且,大卵泡中无论是卵泡液中的sHB-EGF还是颗粒细胞的proHB-EGF,其含量均明显高于小卵泡,提示HB-EGF参与了卵泡发育和成熟的过程。进而卵泡中HB-EGF的2种存在形式以sHB-EGF为主,提示在卵泡的发育及分化过程中sHB-EGF发挥了主要作用。本研究的另一个重要发现是,小卵泡中sHB-EGF与proHB-EGF的比值明显高于大卵泡。小卵泡与大卵泡的不同之处在于小卵泡处于卵泡发育的相对早期阶段,主要生理现象是细胞增殖、卵泡生长,而大卵泡则处于卵泡发育的较晚阶段,主要是细胞的分化与成熟,为卵子的成熟与排出构建适宜的环境。因此,相对于大卵泡而言,小卵泡可能更需要生长因子来维系细胞的增殖和卵泡的生长。从目前HB-EGF相关的研究结果看,sHB-EGF对绝大多数的细胞具有促增殖作用,而proHB-EGF的作用多为介导细胞形态学变化、抑制细胞生长等[1,8,9]。因此,本研究中小卵泡 sHB-EGF与proHB-EGF比值高于大卵泡的实验结果,从一个侧面反映了小卵泡比大卵泡更具有生长潜能的现象,与上述的动物实验观察到的现象一致。而且,从卵泡中卵子的回收情况看,大卵泡的卵子回收率明显高于小卵泡;同时,2个大的空卵泡中sHB-EGF浓度远低于含有卵子的大卵泡中sHB-EGF浓度。这一结果似乎也提示了sHB-EGF对卵子发育的重要性,但仍需加大样本量进一步探讨。
[1]Higashiyama S.Metalloproteinase-mediated shedding of heparinbinding EGF-like growth factor and its pathophysiological roles[J].Protein Pept Lett,2004,11(5):443-450.
[2]潘伯臣,叶莹心,王秀霞,等.人黄素化颗粒细胞中EGF受体家族的表达[J].中国医科大学学报,2007,36(2):183-184.
[3]潘伯臣,叶莹心,王秀霞,等.肝素结合表皮生长因子在人黄素化颗粒细胞中的表达[J]. 中国医科大学学报,2007,36(5):594-597.
[4]陈士岭,罗燕群,夏容,等.年轻妇女基础FSH高水平与卵子和胚胎的数量、质量及临床结局的关系[J].南方医科大学学报,2011,31(5):777-781.
[5]Knight PG,Glister C.TGF-beta superfamily members and ovarian follicle development[J].Reproduction,2006,132(2):191-206.
[6]Gómez R,Soares SR,Busso C,et al.Physiology and pathology of ovarian hyperstimulation syndrome[J].Semin Reprod Med,2010,28(6):448-457.
[7]Pan B,Sengoku K,Takuma N,et al.Differential expression of heparinbinding epidermal growth factor-like growth factor in the rat ovary[J].Mol Cell Endocrinol,2004,214(1-2):1-8.
[8]TakemuraT,Hino S,Okada M,et al.Role of membrane-bound heparinbinding epidermal growth factor-like growth factor(HB-EGF)in renal epithelial cell branching[J].Kidney Int,2002,61 (6):1968-1979.
[9]Uetani T,Nakayama H,Okayama H,et al.Insufficiency of pro-heparinbinding epidermal growth factor-like growth factor shedding enhances hypoxic cell death in H9c2 cardiomyoblasts via the activation of caspase-3 and c-Jun N-terminal kinase[J].J Biol Chem,2009,284(18):12399-12409.
