TNF-α对人肝癌细胞系CD15和CD15s含量及细胞侵袭性的影响
2012-11-15陈传萍何群王邵成潘忠诚王天骄张玉魁钟连声赵雨杰
陈传萍,何群,王邵成,潘忠诚,王天骄,张玉魁,钟连声,赵雨杰
(中国医科大学生物芯片中心,卫生部细胞生物学重点实验室,沈阳 1 1 0 0 0 1)
CD15是细胞表面糖蛋白或糖脂含有的外链岩藻糖化的乙酰乳糖胺糖链,作为细胞黏附分子成员,与肿瘤的发生发展密切相关[1~4]。CD15s是CD15的唾液酸化形式,通过结合含有选凝素的血小板、粒细胞及内皮细胞促进癌灶细胞转移[5]。ST3GaL糖基转移酶在催化CD15s的生物合成中起重要作用[6]。肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)是具有广泛生物学活性的细胞因子[7],对肿瘤细胞有多向调节和直接细胞毒作用[8]。肝癌患者血清TNF-α水平随病情进展明显上升,随肝病的有效治疗其水平逐渐下降。肿瘤微环境中低剂量的TNF-α可促进肿瘤细胞的侵袭和转移[9,10]。提示TNF-α在肝癌的发生发展及侵袭转移中起重要作用。研究表明,TNF-α能诱导多种肿瘤中CD分子含量的变化,从而影响细胞生物学功能[11]。本研究拟探讨TNF-α对肝癌细胞系CD15、CD15s、ST3GaL糖基转移酶家族蛋白含量以及细胞侵袭力的影响,阐明TNF-α影响细胞侵袭转移的可能机制。
1 材料与方法
1.1 材料
人原发性肝癌细胞系HepG-2,人高转移肝癌细胞系SMMC-7721购自南京KeyGEN公司;CD15、CD15s鼠抗人单克隆抗体,Matrix基质胶购自美国BD公司;糖基转移酶ST3GaL家族:ST3GaL-Ⅰ、ST3GaL-Ⅱ、ST3GaL-Ⅲ、ST3GaL-Ⅳ、ST3GaL-Ⅴ、ST3GaL-Ⅵ兔抗人多克隆抗体购自美国Abcam公司;蛋白内参β-Actin一抗购自Santa Cruz公司;羊抗兔IgG-HRP、羊抗鼠IgG-HRP、羊抗鼠IgM-HRP购自博士德公司;凯基全蛋白提取试剂盒、BCA蛋白定量检测试剂盒购自碧云天公司;蛋白彩虹Marker购自Fermentas公司;ECL发光反应试剂盒购自Thermo公司;人重组TNF-α购自美国Promega公司;Transwell购自Millipore公司(24孔,8 μm孔径);RPMI 1640细胞培养基购自美国HyClone Laboratorles公司;优级胎牛血清购自天津市灏洋生物制品科技有限公司。
1.2 方法
1.2.1 细胞培养:用RPMI 1640培养基(含10%优级胎牛血清、青霉素、链霉素100 U/mL),在37℃、5%CO2孵箱中培养HepG-2和SMMC-7721细胞系。每2~3 d用0.25%胰酶细胞传代1次。
1.2.2 Western blot检测:用 20 ng/mLTNF-α 处理对数生长期的HepG-2及SMMC-7721细胞系0、24、48 h,提取细胞全蛋白,取40 μg行SDS-聚丙烯酰胺凝胶电泳。转膜,5%脱脂奶粉TBS封闭1 h,CD15、CD15s、ST3GaL糖基转移酶家族蛋白一抗溶液(稀释200~1 000倍)室温下振荡孵育2 h,加入辣根过氧化物酶标记的二抗溶液(稀释5 000倍),室温下振荡孵育1.5 h。ECL发光反应,照相分析,采用Quantity One软件分析灰度值,β-actin用作内参照,实验重复3次。
1.2.3 Transwell法:取对数生长期HepG-2、SMMC-7721细胞,接种于6孔板(2×104/孔),24 h贴壁后换液,加入含 TNF-α(终浓度 20 ng/mL)的培养基,24 h和48 h后,用胶原酶消化,离心洗涤并重悬于无血清培养基中,调整细胞密度为5×105/mL,取200 μL接种于Transwell小室的上室(24孔板),下室加入含10%新生小牛血清RPMI 1640培养液,置37℃、5%CO2湿化孵箱中培养24 h。取出Transwell小室,棉签擦净Transwell膜上室面细胞,4%多聚甲醛固定30 min,结晶紫染色25 min,200倍光镜下计数上、下、左、右、中5个不同视野穿过膜的细胞数,取均值,以迁移的细胞数表示肿瘤细胞的侵袭能力。设3个平行小室,重复3次。
1.3 统计学分析
采用SPSS 13.0统计软件,计量资料以x±s表示,组间比较采用t检验,Transwell实验数据采用单因素方差分析进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 TNF-α对HepG-2细胞中CD15和CD15s含量的影响
用 TNF-α 分别作用 HepG-2细胞 24、48 h,CD15含量逐渐下降,CD15 s含量逐渐上升,变化呈时间依赖性。与0 h组比较,48 h组CD15含量明显下调(P<0.05),CD15s含量明显上调(P<0.05)。见图1。

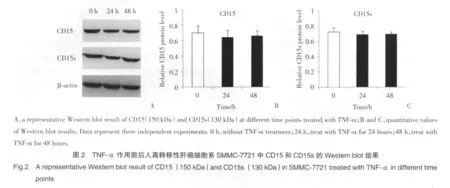
2.2 TNF-α对SMMC-7721细胞中CD15及 CD15s含量的影响
TNF-α分别作用SMMC-7721细胞24 h和48 h,CD15及CD15s含量较0 h组均无明显变化(P>0.05)。见图 2。
2.3 TNF-α对HepG-2细胞中ST3GaL糖基转移酶家族蛋白表达的影响
TNF-α作用HepG-2细胞48 h,ST3GaL糖基转移酶家族蛋白(Ⅰ~Ⅳ)中ST3GaL-Ⅱ和ST3GaL-Ⅳ的表达较对照组明显上调(P<0.05),其他4种ST3GaL糖基转移酶的表达无明显变化(P>0.05)。见图3。
2.4 TNF-α对HepG-2和SMMC-7721细胞侵袭力的影响
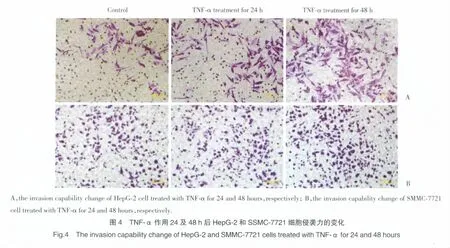
Transwell结果显示:TNF-α作用24 h组HepG-2细胞的穿膜细胞数(61.7±10.4)略高于无药物处理对照组(48.3±5.77),差异无统计学意义(P>0.05);TNF-α作用48 h组HepG-2细胞的穿膜细胞数(106.7±17.56)明显高于无药物处理对照组(48.3±5.77),差异有统计学意义(P<0.05),提示此时HepG-2细胞侵袭力显著增强。见图4A。
TNF-α作用24 h组及48 h组SSMC-7721细胞的穿膜细胞数(100±11.36,105±13.23)较无药物处理组穿膜细胞数(90±10.0)均无统计学差异(P>0.05)。见图 4B。
3 讨论

细胞黏附分子作为介导细胞与细胞或细胞与基质相互识别和作用的分子,在肿瘤细胞的侵袭和转移过程中发挥着双重作用:一方面肿瘤细胞首先通过黏附分子表达下调,从原发灶脱落,另一方面又需要通过细胞外基质受体或内皮细胞配体的表达上调,与细胞外基质或血管内皮细胞黏附而移动,才能发生转移[12,13]。研究表明,细胞黏附分子的表达易受细胞因子的作用。细胞因子TNF-α可诱导多种肿瘤细胞,如乳腺癌、胰腺癌等的细胞黏附分子CD44的表达上调[11,14]。本研究首次发现:TNF-α 同样可使原发性肝癌细胞系HepG-2中细胞黏附分子CD15s含量增加,同时使CD15含量下降。CD15和CD15s需要经过1个共同的前体并通过2条途径分别合成[15],而ST3GaL糖基转移酶家族蛋白在催化CD15s的生物合成中起重要作用[6,16]。为了进一步探讨TNF-α诱导CD15及CD15s含量变化的原因,我们应用Western blot检测了TNF-α作用后HepG-2细胞系中ST3GaL糖基转移酶家族蛋白相关成员的表达,发现ST3GaL-Ⅱ和ST3GaL-Ⅳ表达明显上调,而其他成员的表达无明显改变。我们推测ST3GaL-Ⅱ和ST3GaL-Ⅳ的上调可能使前体偏向CD15s生物合成途径,增加了CD15s含量,同时偏离CD15合成途径使CD15的合成减少。本研究结果还显示,SMMC7721细胞中CD15和CD15s的含量无明显改变,推测其原因可能是由于该细胞中CD15和CD15s含量已接近饱和状态。
肿瘤微环境中低剂量的TNF-α能促进卵巢癌、人类黑色素瘤等多种肿瘤细胞侵袭[9,10]。本研究发现,HepG-2细胞中,TNF-α在诱导CD15和CD15s含量变化的同时,能促进细胞侵袭;但在SMMC-7721细胞中,TNF-α作用后,无论是CD15和CD15s含量还是细胞侵袭力均无明显改变。通过比较我们推测TNF-α诱导CD15s上调及CD15下调可能是其促进肝癌侵袭转移的一个重要机制。研究发现,肿瘤细胞中CD15表达异常导致细胞黏附的改变是介导肿瘤侵袭转移的一个重要机制[17],CD15s上调则与肿瘤侵袭呈明显正相关[18,19]。谷化平等[20]发现,在伴有淋巴结转移的乳腺癌组织中,CD15s阳性率为90.2%,显著高于无淋巴结转移组(67.4%,P<0.05),提示CD15s对判断肿瘤恶性程度和预测淋巴结转移状况是一个具有实用价值的标志物。
综上所述,本研究结果提示:TNF-α可提高原发性肝癌细胞系HepG-2细胞侵袭转移能力,调控HepG-2中CD15和CD15s的含量,使CD15s上调,CD15下调。而TNF-α通过何种途径调控CD15及CD15s含量变化进而影响肿瘤细胞侵袭和转移的机制尚不明确。我们将进一步探讨相关机制,为临床上研发新的抑制肿瘤侵袭和转移的靶向药物提供理论依据。
[1]Alex S,Maria M,Jose M,et al.Glycoproteomic characterization of carriers of the CD15/Lewis-x epitope on Hodgkin′s Reed-Sternberg cells[J].BMC Biochem,2011,12:13-19.
[2]Wai Wong C,Dye D,Coombe DR.The role of immunoglobulin superfamily cell adhesion molecules in cancer metastasis[J].Int J Cell Biol,2012:340296.Epub 2012 Jan 9.
[3]Yu J,Sadaria M,Meng X,et al.Lung cancer cell invasion and expression of intercellular adhesion molecule-1 (ICAM-1)are attenuated by secretory phospholipase A2 inhibition[J].J Thorac Cardiovasc Surg,2012,143(2):405-411.
[4]阚和平,王宇,谭永法,等.多吉美对肝癌的疗效与Ki-67及CD34表达的关系[J].南方医科大学学报,2010,30(28):1930-1934.
[5]Nakagawa T,Endo Y,Watanabe M,et al.Adhesional function of canine mammary gland tumor cells expressing sialyl Lewis X[J].J Vet Med Sci,2009,71(9):1225-1228.
[6]Nakamura M,Furukawa Y,Sasaki R,et al.UDP-GlcNAc:Galbeta1-->3GalNAc (GlcNAc to GalNAc) beta1-->6N-acetylglucosaminyltransferase holds a key role on the control of CD15s expression in human pre-B lymphoid cell lines[J].Glycobiology,1999,9(1):1-12.
[7]Chen G,Goeddel D.TNF-R1 signaling:a beautiful pathway[J].Science,2002,296(5573):1634-1635.
[8]张海燕,李卫红,马鸿儒.肿瘤坏死因子抑制人肺癌细胞增生能力的体外研究[J].首都医科大学学报,2000,21(1):20-22.
[9]Zhu N,Lalla R,Eves P,et al.Melanoma cell migration is upregulated by tumor necrosis factor-alpha and suppressed by alpha-melanocytestimulating hormone[J].Br J Cancer,2004,90(7):1457-1463.
[10]Kulbe H,Thompson R,Wilson J,et al.The inflammatory cytokine tumor necrosis factor-generates an autocrine tumor-promoting network in epithelial ovarian cancer cells[J].Cancer Res,2007,67(2):585-592.
[11]郑劲草,许国铭,李淑德,等.TNF、IFN对人胰腺癌细胞株SW-1990中CD44蛋白表达的影响[J].解放军医学杂志,1999,24(4):275-277.
[12]Dimitroff C,Lechpammer M,Long-Woodward D,et al.Rolling of human bone-metastatic prostate tumor cells on human bone marrow endothelium under shear flow is mediated by E-selectin[J].Cancer Res,2004,64(15):5261-5269.
[13]李强,陈德,李悦,等.E-selectin和ICAM-1在肝癌细胞与内皮细胞黏附作用中的实验研究[J].岭南现代临床外科杂志,2009,9(5):327-330.
[14]李俊,缪苏宇,陈薇,等.肿瘤坏死因子对乳腺癌细胞CD44表达调控及其影响细胞迁徙机制的探讨[J].中华肿瘤防治杂志,2010,17(8):566-570.
[15]陈继华,陈惠黎.α 1,3-岩藻糖基转移酶及其相关产物[J].生命化学,1997,17(4):32-35.
[16]Gadhoum S,Sackstein R.CD15 expression in human myeloid cell differentiation is regulated by sialidase activity[J].Nat Chem Biol,2008,4(12):751-757.
[17]滕少辉,赵小立,陆永良,等.阶段特异表达的胚胎抗原[J].生命科学,2005,17(3):261-265.
[18]Iwata T,Nishiyama N,Nagano K,et al.Preoperative serum value of sialyl Lewis X predicts pathological nodal extension and survival in patients with surgically treated small cell lung cancer[J].J Surg Oncol,2012,105(8):818-824.
[19]Julien S,Ivetic A,Grigoriadis A,et al.Selectin ligand sialyl-Lewis x antigen drives metastasis of hormone-dependent breast cancers[J].Cancer Res,2011,71(24):7683-7693.
[20]谷化平,尚培中,倪灿荣.CD15s抗原在乳腺癌中的表达及意义[J].中国普外基础与临床杂志,2002,9(5):313-315.
