大黄酸对体外大鼠皮质神经元突起长度及微管相关蛋白2 mRNA表达的影响
2012-11-12周晓雯赖永长罗焕敏
鄢 黎,周晓雯,周 星,赖永长,罗焕敏,2,3
(暨南大学1.医学院药理学系,2.脑科学研究所,广东广州 510632;3.暨南大学-香港大学脑功能与健康联合实验室,广东广州 510632)
神经元的丢失、死亡以及神经网络破坏近年来被认为是神经退行性疾病的重要病理学特征,例如帕金森病、阿尔茨海默病和亨廷顿病等[1]。在神经退行性疾病中,神经元及其突触的丢失与神经营养因子(neurotrophic factors,NTF)的减少和缺失密切相关[2]。NTF是一类对中枢和周围神经系统均具有营养活性的蛋白质或多肽,能促进神经细胞生长、发育、分化,维持其形态功能的完整性并提高其存活率[2-4]。但是由于其分子量过大难以通过血脑屏障,且易被降解和生物利用率低等弊端限制了这类物质的临床应用[5]。
大黄酸属单蒽醌类1,8-二羟基蒽醌衍生物,是从大黄、何首乌和虎杖等多种传统中药分离提纯出的有效成分,具有抗菌、免疫抑制、利尿及抗炎等作用,并可用于治疗糖尿病性肾病[6];大黄酚具有改善 Aβ25~35致小鼠学习记忆障碍的作用[7];大黄素能保护去卵巢大鼠并拮抗 Aβ对神经元的毒性作用[8],提示大黄素有雌激素样作用;大黄素甲醚的预处理对大鼠的局灶性脑缺血再灌注损伤具有神经保护作用[9]。大黄酸与大黄酚、大黄素和大黄素甲醚等的化学结构相近,研究RH的促进神经突起再生方面作用有利于进一步肯定蒽醌类结构在神经保护方面的作用,也有利于发现新的神经营养与保护类先导化合物,为结构改造提供母核。
1 材料与方法
1.1 药品与试剂
RH(纯度>98% 中国药品生物制品检定所);L-多聚赖氨酸,噻唑蓝(MTT),二甲基亚砜(DMSO),LY294002,K252a ,Hoechst33258,焦碳酸二乙酯(diethyl pyrocarbonate,DEPC),单克隆兔抗大鼠神经元微管相关蛋白2(microtubule-associated protein 2,MAP2)(美国 Sigma公司);B27添加剂,DMEM/F12培养基 (美国Gibco公司);胎牛血清(美国Hyclone公司);胰蛋白酶(美国 Amresco公司);单克隆兔抗大鼠神经元特异性烯醇化酶(neuron-specific enolase,NSE)IgG,即用型SABC免疫组化试剂盒(武汉博士德生物工程有限公司);Trizol(Introvengen公司);RT-PCR试剂盒(大连宝生物工程有限公司);SYBR Premix Ex TaqTM荧光定量试剂盒和150 bp DNA标志物(日本TaKaRa公司);溴化乙锭(ethidium bromide,EB)替代染料(北京普利莱基因技术有限公司)。
1.2 主要仪器
3K18冷冻高速离心机(美国 Sigma公司);Arium631纯水仪(德国 Sartorius公司);AG梯度RT-PCR仪(美国 Eppendorf公司);450型酶标仪,Mini protean 3 cell电泳系统(美国Bio-Rad公司);Omega 10凝胶成像分析系统(美国 Ultra-Lum公司)。
1.3 细胞培养
24 h内的新生大鼠置于75%乙醇中消毒20 s,在超净台内将大脑皮质与嗅球和海马分离开,并置于含有D-Hank液的青霉素瓶中。用眼科剪将其剪成1 mm3组织块。用0.08%(W/V)的胰酶在37℃的培养箱中消化10 min。用DMEM/F12+10%FBS终止消化,再过滤离心收集细胞。用DMEM/F12将细胞混匀,并将细胞均匀地接种于用多聚赖氨酸0.1 g·L-1处理过的培养板上。采用无血清培养。
1.4 神经元的鉴定
1.4.1 NSE免疫细胞化学染色
将细胞接种于24孔板,培养72 h后用4%多聚甲醛固定20 min。用PBS 0.1 mol·L-1漂洗3次后加入纯甲醇和30%H2O2(50∶1)室温下浸泡20 min,PBS0.1 mol·L-1漂洗3 次后加一抗(抗NSE 1∶80),室温2 h;除去一抗用PBS 0.1 mol·L-1漂洗3次后加入辣根过氧化物酶标记单克隆兔抗大鼠NSE,室温避光放置于湿盒内20 min,除去二抗用PBS漂洗2次滴加SABC,置于湿盒20 min,再用PBS漂洗加入DAB显色,镜下观察并记录结果。
1.4.2 MAP2 免疫荧光染色
将细胞接种于24孔板,培养72 h后用4%多聚甲醛固定20 min。用PBS0.1 mol·L-1漂洗3次后加入 0.1%TritonX-100 作用 10 min。PBS 0.1 mol·L-1漂洗3次后加一抗(抗MAP2 1∶200),4℃过夜;除去一抗用PBS 0.1 mol·L-1漂洗3次后加入Cy3标记单克隆兔抗大鼠MAP2,室温避光放置于湿盒内孵育1 h,除去二抗用PBS漂洗2次,荧光显微镜下观察并记录结果。
1.5 神经元平均突起长度测量
24孔板培养神经元,6 h细胞贴壁后加药换培养基,实验分为9组:溶媒对照组(0.1%DMSO)组,bFGF 10 μg·L-1组,RH 2,4 和 8 μmol·L-1组,K252a 50 nmol·L-1组,RH 8 μmol·L-1+K252a 50 nmol·L-1组,LY294002 10 μmol·L-1组,RH 8 μmol·L-1+LY294002 10 μmol·L-1组。作 用72 h,每孔随机选取24个视野,每组4个复孔,拍照。以突起长度大于2倍胞体的神经元为阳性神经元,统计视野中的10个阳性神经元。采用Image Pro软件计算照片中神经元的平均突起长度。
1.6 神经元存活率检测
1.6.1 MTT 比色法
将大鼠皮质神经元接种于96孔板中,每孔3.3×104个细胞,6 h神经元贴壁后,换培养基加药,实验分为 5组:0.1%DMSO溶媒对照组;bFGF 10 μg·L-1组,RH 2,4 和 8 μmol·L-1组。培养72 h后,每孔加入20μl MTT 5 g·L-1,4 h后移去上清,加入 150μl DMSO,震荡 10 min,用酶标仪上在570 nm波长下测各孔吸光度值(absorbance,A),每组6个复孔,计算其平均值。细胞存活率(%)=(A实验组-A对照组)/A对照组×100%。
1.6.2 LDH 测定
将大鼠皮质神经元接种于24孔板中,每孔2.5×105个细胞,6 h神经元贴壁后,换培养基加药,按1.6.1项分组处理。取上清液,4℃,92×g离心1 min。按照LDH测定试剂盒说明书操作,用7600全自动生化仪测定LDH含量(U·L-1)。
1.7 RT-PCR测定神经元MAP2 mRNA含量
将大鼠皮质神经元接种于6孔板中,每孔1.0×106个细胞,贴壁后,换培养基加药,实验分为5组:溶媒对照组(0.1%DMSO)组,bFGF 10 μg·L-1组,RH 2,4和8μmol·L-1组。培养72 h后用Trizol提取大鼠皮质神经元总RNA,管家基因GAPDH作为内参基因。根据GenBank的序列(表1),用Primer5.0软件设计小鼠MAP2引物。PCR反应参数为:预变性94℃,30 s;变性 94℃,15 s;退火 58℃,15 s;延伸72℃,30 s;总循环数为35。用2%琼脂糖凝胶在60 V,70 mA,1 h条件下对扩增好的PCR反应产物进行电泳,并用Multi Genius型凝胶成像分析系统进行图像分析,对扩增DNA片段进行吸光度扫描,求出积分吸光度(integrated absorbance,IA),计算MAP2基因与内参照基因GAPDH的IA比值表示mRNA的相对含量并拍摄照片。
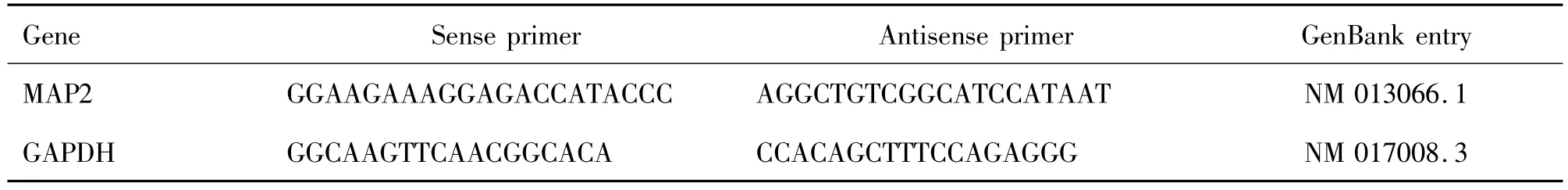
Tab.1 Primer sequences of microtubule-associated protein 2(MAP2)and GAPDH
2 结果
2.1 培养的神经元形态学观察与鉴定
从图1A中可以看出细胞有明显的突起,胞体呈圆形或梭形,在其周围伴有明显的光晕,胞核及核仁清晰可见。NSE免疫细胞化学鉴定(图1B)和MAP2免疫荧光鉴定(图1C)结果表明,95%以上的细胞呈阳性反应,故所培养的细胞大多数为神经元。
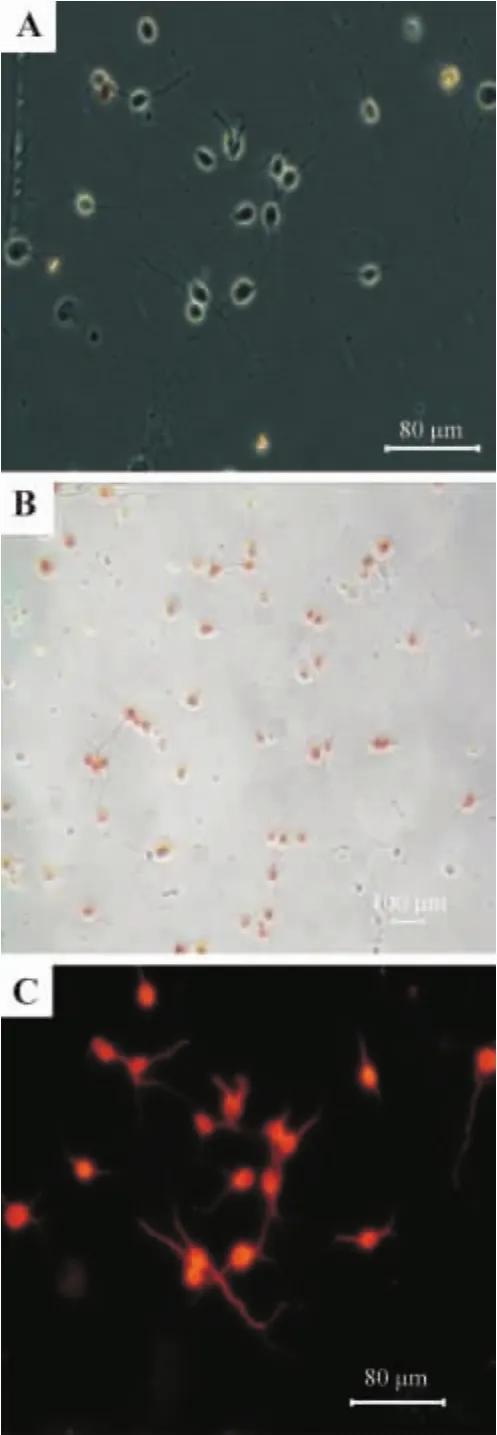
Fig.1 Immunocytochemical staining to identify cells in culture.A:the cultured neurons observed by inverted phase contrast microscope;B:the same neurons stained by NSE;C:these neurons stained further by MAP2 immunfluorescence.
2.2 大黄酸对神经元突起生长的影响
表2结果显示,与溶媒对照组相比较,RH 2,4和8μmol·L-1组能明显促进神经元突起生长,从(127±33)μm增加到(160±36)μm,具有统计学差异(P <0.01)。
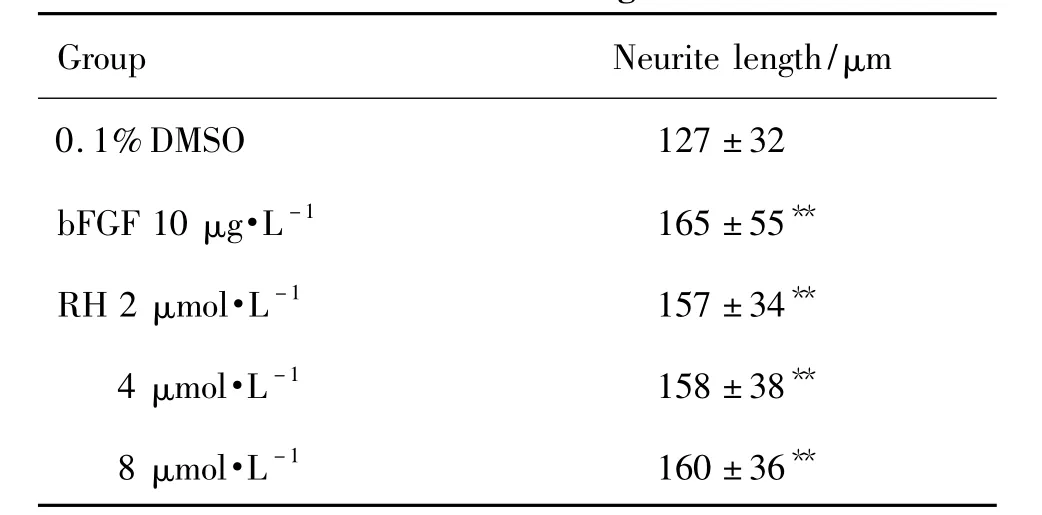
Tab.2 Effect of RH on neurite length
与RH 8μmol·L-1组相比较,Trk受体拮抗剂K252a 50 nmol·L-1和 PI3K拮抗剂 LY294002 10μmol·L-1组神经元的平均突起长度均显著性缩短,具有统计学差异(P<0.01)。RH与K252a或与LY294002同时加入,RH延长神经元长度的作用被拮抗剂阻断(P<0.01),基本恢复至溶媒对照组水平(表3,表4)。

Tab.3 Effect of RH with K252a on neurite length

Tab.4 Effect of RH with LY294002 on neurite length
2.3 大黄酸对神经元存活率的影响
MTT结果(表5)表明,与溶媒对照组相比,RH 2,4和8μmol·L-1组细胞的存活率均明显增加。A值从0.089 ±0.002增加到 0.100 ±0.005,存活率增加到(115.7±2.5)%具有显著意义(P <0.05)。bFGF 10μg·L-1组细胞存活率明显增高,达(178.7 ±8.0)%。
神经细胞衰老或受损时会导致生物膜功能异常,LDH的渗漏量增加,因此,培养液中LDH的活性可反映神经细胞的生长和存活状态。LDH检测结果(表6)显示,与溶媒对照组相比,RH 2,4和8 μmol·L-1组神经元中LDH含量均显著降低(P<0.05),最低达 (7.50 ±0.58)U · L-1;bFGF 10μg·L-1组神经元中LDH含量也明显降低(P<0.01),达到(7.25 ±1.26)U·L-1。

Tab.5 Effect of RH on neurons survival rate by MTT assay
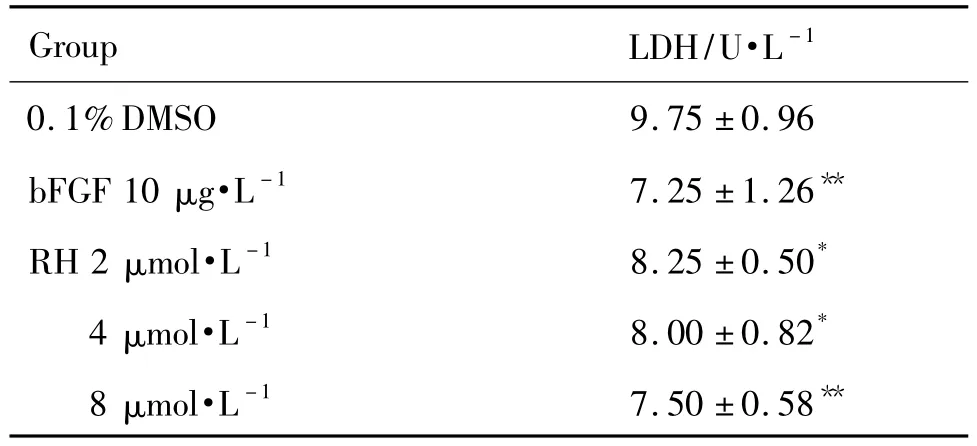
Tab.6 Effect of RH on neurons survival rate by LDH release assay
2.4 大黄酸对大鼠皮质神经元MAP2 mRNA表达的影响
RT-PCR结果(图2和表7)表明,与溶媒对照组比较,RH 2μmol·L-1组 MAP2 mRNA 无明显改变,RH 4和8μmol·L-1显著增加皮质神经元中MAP2 mRNA表达(P<0.05),作用效果与阳性对照药bFGF 10μg·L-1相当。说明RH可以增强大脑皮质神经元MAP2 mRNA表达能力。
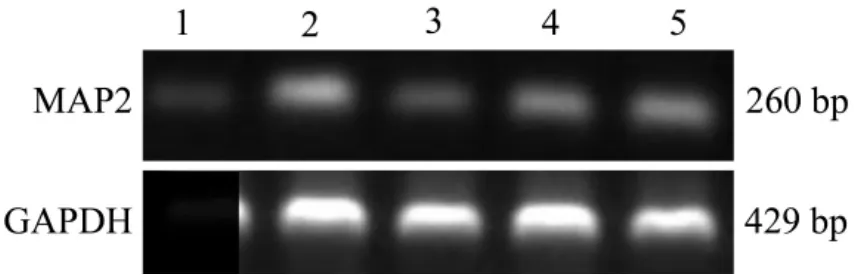
Fig.2 Effect of RH on microtubule-associated protein 2 mRNA(MAP2 mRNA)expression in cortical neurons of rats.Lane 1:0.1%DMSO;lane 2:bFGF 10 μg·L-1;lanes 3-5:RH 2,4 and 8 mmol·L-1 .

Tab.7 Effect of RH on MAP2 mRNA expression
3 讨论
神经元体外培养模型是神经元发育分化、神经再生、神经疾病的发生机制药物筛选等众多研究领域的重要模型。体外培养神经元的方法总体可分为有血清培养和无血清培养。血清可以提供细胞生长所需要的各种营养物质,当培养基中去除血清后,神经元存活率会大大降低[10]。但由于血清成分复杂,对实验结果影响干扰较大。而无血清培养步骤简便,培养的细胞活性及生理特性保持良好。故本实验选用无血清培养模型,探讨RH对神经元突起生长及神经元存活率的影响。
提高神经元的存活率和促进突起生长是考察被筛选的药物在体外实验中是否具有神经营养作用的主要指标。本实验形态学结果表明,RH与溶媒对照组比较能显著增长神经元突起长度,MAP2属于结构性相关蛋白家族,主要存在于中枢神经元的树突和胞体[11],在维持神经元形态方面起着重要的作用,并能调控突起的生长和可塑性[12]。RT-PCR结果表明,RH促进MAP2 mRNA表达,说明RH能促进神经元突起的生长,维持其形态的稳定。MTT比色法和LDH检测结果显示,与溶媒对照组相比,RH各浓度组均可以提高细胞活力,使神经元的存活率提高。以上结果提示,RH兼有促进神经元突起生长和促进细胞存活的双重作用,与神经营养因子的作用类似。具有潜在的治疗神经退行性疾病及其相关疾病的作用。
目前一般认为,小分子神经营养拟似物可通过直接激活Trk受体、间接激活Trk受体(有些物质可能通过腺苷A2a受体活化间接激活Trk受体)、促进NTF与Trk受体结合以及诱导神经营养素的表达或分泌等途径发挥作用。本实验中,工具药K252a(Trk受体抑制剂)能部分阻断RH的作用,表明RH可能是部分通过Trk受体产生作用。
NTF主要通过激活Ras/PI3K/PKB途径,促进神经元存活,抑制其凋亡,从而起到神经保护作用的[14]。本实验中,加入LY294002后,RH的作用被完全阻断,暗示RH可能主要通过PI3K这一信号通路产生神经营养作用。后续实验将运用Western印迹技术检测PI3K等下游相关蛋白的磷酸化水平,从而进一步确证RH的作用机制是否是通过激活Ras/PI3k/PKB通路而发挥作用的。
[1]Golde TE.The therapeutic importance of understanding mechanisms of neuronal cell death in neurodegenerative disease[J].Mol Neurodegener,2009,4:8.
[2]Salton SR.Neurotrophins,growth-factor-regulated genes and the control of energy balance[J].Mt Sinai J Med,2003,70(2):93-100.
[3]Sharma HS,Sharma A.New strategies for CNS injury and repair using stem cells,nanomedicine,neurotrophic factors and novel neuroprotective agents[J].Expert Rev Neurother,2011,11(8):1121-1124.
[4]Sullivan AM,Toulouse A.Neurotrophic factors for the treatment of Parkinson's disease[J].Cytokine Growth Factor Rev,2011,22(3):157-165.
[5]Esumi T,Makado G,Zhai HF,Shimizu Y,Mitsumoto Y,Fukuyama Y.Efficient synthesis and structureactivity relationship of honokiol,a neurotrophic biphenyl type neolignan[J].Bioorg Med Chem Lett,2004,14(10):2621-2625.
[6]Zhao RZ,Yuana D,Liu SJ,Chen YJ,Liu LY,Zhao Y.Liver targeting effect of vinegar-baked Radix Bupleuri on rhein in rats[J].J Ethnopharmacol,2010,132(2):421-428.
[7]Gervais F ,Paquette J,Morissette C,Krzywkowski P,Yu M,Azzi M,et al.Targeting soluble Aβ peptide with tramiprosate for the treatment of brain amyloidosis[J].Neurobiol Aging,2007,28(4):537-547.
[8]Li L,Duan GL,Zhao L,Wu JL.Influence of emodin on the behavior of ovariectomized rats and its protective effect on cultured neurons from these rats and those murine neurons treated with β-amyloid protein[J].Her Med(医药导报),2005,24(2):100-103.
[9]França VC,Agra M,Barbosa-Filho JM,da-Cunha EVL,da-Silva MS.Physcion and dihydrocarinatin from Aristolochia birostris[J].Biochem Syst Ecol,2003,31(11):1341-1343.
[10]Zhai H,Nakatsukasa M,Mitsumoto Y,Fukuyama Y.Neurotrophic effects of talaumidin,a neolignan from Aristolochia arcuata,in primary cultured rat cortical neurons[J].Planta Med,2004,70(7):598-602.
[11]Mandelkow E,Mandelkow EM.Microtubules and microtubule-associated proteins[J].Curr Opin Cell Biol,1995,7(1):72-81.
[12]Kurz JC,Williams RC Jr.Microtubule-associated proteins and the flexibility of microtubules[J].Biochemistry,1995,34(41):13374-13380.
[13]Segal RA,Greenberg ME.Intracellular signaling pathways activated by neurotrophic factors[J].Annu Rev Neurosci,1996,19:463-489.
